서 론
재료 및 방법
1. 육묘 조건 및 마이크로웨이브 처리
2. 생육 조사
3. Chlorophyll a, chlorophyll b 및 총 carotenoids 함량 측정
4. 총 페놀 함량 측정
5. 총 플라보노이드 함량 측정
6. 통계분석
결과 및 고찰
1. 생육 분석
2. Chlorophyll a, chlorophyll b 및 총 carotenoids 함량 분석
3. 총 페놀 함량 분석
4. 총 플라보노이드 함량 분석
서 론
상추(Lactuca sativa L.)는 국화과에 속하는 1년생 초본성 식물이다. 우리나라는 2021년 기준 3,830ha의 면적에서 재배 중이며, 총 생산량은 97,137톤으로 쌈 및 샐러드 채소 중 배추 다음으로 많이 생산되는 작물이다(KOSIS, 2021).
식물에서 추출한 이차대사산물은 의약품, 식품 및 산업 원료 등 여러 분야에서 이용되고 있다. 이차대사산물은 생합성 경로에 따라 페놀류(phenolics), 테르펜(terpenes)과 알카로이드(alkaloids) 등으로 분류할 수 있다(Tiwari와 Rana, 2015). 상추의 대표적인 이차대사산물로는 플라보노이드 및 심플페놀 등이 있으며, 플라보노이드에는 사이아니딘(cyanidin), 퀘르세틴(quercetin), 루테올린(luteolin) 등이 있고(García-Macías 등, 2007), 심플페놀에는 카페인산(caffeic aicd), 레스베라트롤(resveratrol), 카테콜(catechol), 갈산(gallic) 등이 있다(Urquiaga와 Leighton, 2000). 페놀화합물은 항산화 물질로 세포손상을 막아 노화를 지연시켜주는 것으로 알려져 있다(Tungmunnithum 등, 2018). 이차대사산물은 식물의 생장과 발달에 직접적으로 관여하지 않고 주로 일차대사산물을 이용하여 합성되며, 곤충, 초식동물, 병원균 등에 의한 생물적 스트레스나 비생물적 스트레스로부터 보호하는 데 이용된다(Demain과 Fang, 2000). 식물의 이차대사산물은 유전, 환경 및 재배법 등에 의해 함량이 달라질 수 있고, 생물적 및 비생물적 스트레스로 증가하거나 감소할 수 있다(Akula와 Ravishankar, 2011; Neugart 등, 2018).
다양한 비생물적 스트레스 중에는 방사선 조사 방법이 있으며, 그 중 마이크로웨이브는 라디오파와 적외선 사이의 파장과 주파수를 가지고 있는 전자기파로 파장은 보통 1mm-1m 사이와 주파수는 0.3-300GHz의 범위를 갖는 전자기 방사이다(Banik 등, 2003). 마이크로웨이브를 발생시키는 장치에는 WLAN(wireless lan), GSM(global system /standard for mobile communication), 클라이스트론(klystron) 및 마그네트론(magnetron) 등 다양하게 존재한다(Chen 등, 2009; Soran 등, 2014; Halmagyi 등, 2017; Kumari 등, 2018). 특히, 마그네트론은 2.45GHz 주파수의 마이크로웨이브를 방출하며, 대표적으로 마그네트론 장치를 응용한 기계는 전자레인지로 물 분자를 운동시켜 음식을 데우는 데 사용된다(Vollmer, 2004). 식물을 대상으로 마이크로웨이브를 처리하면 식물의 이차대사산물 함량을 변화시킬 수 있다고 보고되었다(Jayasanka와 Asaeda, 2014).
전자레인지를 이용한 2.45GHz 주파수와 700W의 마이크로웨이브 처리가 밀 종자의 발아 후 유묘의 염분 스트레스 저항성을 증가시킨다고 보고되었다(Chen 등, 2009). 또한, López-Orenes 등(2022)의 결과에 따르면 in-vitro 내 끈끈이주걱(Drosera rotundifolia L.)에 2.45GHz 주파수와 26.3kW의 마이크로웨이브 처리는 chlorophyll, carotenoids, 총 페놀 및 플라보노이드 함량을 증가시켰다. 이러한 결과들은 마그네트론이 방출하는 마이크로웨이브가 식물의 생육과 이차대사산물의 함량 변화에 영향을 줄 수 있다는 것을 시사한다. 하지만, 현재 마그네트론 장치를 응용한 전자레인지를 사용하여 어린 묘 상태의 상추에 처리를 하고 정식 이후의 생육과 이차대사산물 변화를 관찰하는 연구는 보고된 바 없다. 선행연구에서 마이크로웨이브 처리 후 chlorophyll과 이차대사산물 함량에 변화가 있었으며, chlorophyll 함량의 변화는 생육 증진에 영향을 줄 것으로 사료된다. 따라서, 본 실험은 전자레인지를 이용하여 2.45GHz 주파수의 마이크로웨이브를 200W 출력으로 상추 유묘를 시간별로 처리하고, 이를 수경재배 시스템에 이식 후 4주간 재배하여 상추의 생육과 이차대사산물 함량 분석을 목적으로 하였다.
재료 및 방법
1. 육묘 조건 및 마이크로웨이브 처리
청로메인 상추(Lactuca sativa L.) 종자(Romaine lettuce, Danong Co., Ltd., Korea)를 150공(Kiemplug standard tray, Grodan, Denmark) 암면 파종판에 파종 후, 22±2℃에 48시간 동안 암 처리 후 광도 200±10μmol·m-2·s-1, 상대습도 70-75%, 광주기 16/8h(명기/암기)의 조건에서 3주간 저면관수 방법으로 육묘하였다. NO3-N 6.0me·L-1, PO4-P 0.4me·L-1, K 4.4me·L-1, Ca 2.0me·L-1, SO4-S 1.0me·L-1, Mg 1.0me·L-1로 조제된 야마자키 양액을 pH 6.5±0.3, EC 1.5±0.2dS·m-1로 본엽이 발생한 시점부터 격일 간격으로 공급하였다.
Fujikawa 등(1992)의 연구를 참고하여 마이크로웨이브를 처리하였다. 파종 후 3주째 본엽이 3-4매 전개되었을 때 균일한 묘를 선발하여 실험에 이용하였다. 근권부의 수분함량을 포화수분이 되도록 저면관수를 하였으며, 저면관수 후 전자레인지(MW25B, LG Electronics Inc., Korea)를 이용해 200W(4.17kW·m-3) 출력으로 상추 유묘 개체 당 각각 0, 4, 8 및 12초 동안 마이크로웨이브를 처리하였다. 마이크로웨이브 처리 후 완전제어형 식물생산 시스템에 설치된 semi-DFT(deep-flow technique) 수경재배 장치에 정식하였고, 재배 중 명/암기 및 기온은 각각 16/8h, 25/20±1℃, 상대습도 70±10%, 광도(PPFD) 200±10μmol·m-2·s-1 조건으로 설정하여 4주간 재배하였다. 정식 후 양액의 농도는 EC 1.5±0.2dS·m-1, pH 6.5±0.3으로 유지하고, 무기양분의 균형을 고려하여 1주일 간격으로 교체해 주었다.
2. 생육 조사
정식 4주 후에 생육조사를 위하여 각 처리구 당 상추를 5주씩 수확하였다. 상추의 생육조사는 캘리퍼스(SD500-300PRO, Shin Con Co., Ltd., Korea)를 이용하여 상, 중 및 하엽을 선정하여 엽장 및 엽폭을 측정하였다. 지상부의 생체중 및 지하부의 생체중은 전자저울(MW-2N, CAS Co., Ltd., Korea)을 이용하여 측정하였다. 건물중 측정을 위해 지하부는 시료 분석용 봉투에 넣어 70℃로 설정한 건조기(HB-501M, Hanbaek Scientific Technology Co., Ltd., Korea)에 7일간 건조시킨 후 전자저울로 측정하였고, 지상부는 동결건조기(TFD5503, Ilshin BioBase Co., Ltd., Korea)를 이용하여 4일간 건조시킨 후 전자저울로 측정하였다.
3. Chlorophyll a, chlorophyll b 및 총 carotenoids 함량 측정
상추의 chlorophyll a, b, 총 carotenoids 함량을 Lichtenthaler와 Buschmann(2001)의 방법으로 분석하였다. 생육 조사 후 수확한 잎을 액체 질소를 이용하여 급속 냉각시키고 –70℃에 보관하였다. 냉동된 시료를 동결건조기를 이용하여 동결건조 시킨 후 믹서기와 막자사발을 사용하여 분말화하였다. 분말된 시료 20mg을 2mL 튜브에 넣고, MeOH와 증류수를 혼합한 90% H2O-methanol 용매 2mL를 넣어 Voltex Mixer(SI-0246A, Coleparmer, USA)로 섞어주었다. 이후 Ultrasonic Bath(powersonic420, Hwashin Tech Co., Ltd., Korea)에서 중간강도로 40℃, 40분 동안 음파 처리 후 원심분리기(Smart 15 plus, Hanil, Korea)를 이용하여 4℃, 21,092g로 5분간 원심분리하여 상층액을 1.5mL를 취하였다. 상층액은 96 well plate(SPL30096, SPL., Korea)에 200μL씩 분주하여 Microplate Spectrophotometer(EpochTM, Agilent Technologies, USA)로 652nm, 665nm, 470nm에서 흡광도를 측정하고 메탄올과 10% 증류수 방법으로 측정값을 식에 대입하여 chlorophyll a, chlorophyll b 및 총 carotenoids 함량을 구하였다.
ca (μg/mL) = 16.82 A665.2-9.28 A652.4
cb (μg/mL) = 36.92 A652.4-16.54 A665.2
c(x+c) (μg/mL) = (1000 A470-1.91 ca-95.15 cb)/225
ca : Chlorophyll a
cb : Chlorophyll b
c(x+c) : Carotenoids (x + c = xanthophylls and carotenes)
4. 총 페놀 함량 측정
Severo 등(2011)의 방법을 변형시켜 총 페놀 함량(total phenolic contents)을 측정하였다. 시료의 전처리는 chlorophyll a, b, 총 carotenoids 함량 분석에 이용된 방법으로 진행하였다. 각 시료 75μL, Folin-Ciocalteureagent 75μL, 증류수 1125μL를 1.5mL 튜브에 넣고 5분간 반응시킨 후, 7.5% Na2CO3 용액 225μL를 넣고 40분간 상온에서 반응시켰다. 이후 96 well plate에 200μL씩 분주하고 Microplate Spectrophotometer(EpochTM, Agilent Technologies, USA)로 765nm에서 흡광도를 측정하였다. 측정값을 gallic acid를 이용한 standard curve에 대입하여 함량값을 계산하였다.
5. 총 플라보노이드 함량 측정
Chang 등(2002)의 방법을 변형시켜 총 플라보노이드(total flavonoids) 함량을 측정하였다. Chlorophyll a, b, 총 carotenoids 함량 분석에 이용된 방법으로 전처리 후 시료 100μL, 95% 에탄올 300μL, 10%(w/v) aluminum chloride 20μL, 1M(w/v) potassium acetate 20μL, 증류수 600μL를 1.5 mL 튜브에 넣어 상온에서 40분간 반응시켰다. 이후 96 well plate 200μL씩 분주하고 Microplate Spectrophotometer(EpochTM, Agilent Technologies, USA)로 415nm에서 흡광도를 측정하였다. 측정값을 Quercetin을 이용한 standard curve에 대입하여 함량값을 계산하였다.
6. 통계분석
본 실험은 2반복으로 수행되었으며, 데이터의 통계 분석은 SPSS 프로그램(SPSS 26, SPSS Inc., Chicago, IL, USA)을 사용하여 ANOVA 변량분석을 수행하였으며, 평균 간 유의차 검증을 위하여 Tukey의 다중검정법으로 유의수준 p ≤ 0.05에서 분석하였다. 그래프 작성을 위해 Sigmaplot(12.0, Systat software Inc., Chicago, IL, USA) 프로그램을 사용하였다.
결과 및 고찰
1. 생육 분석
상추의 유묘 단계에서 마이크로웨이브를 처리하고 정식 후 4주 동안 재배한 뒤 상추를 생육조사하였다. 엽수는 무처리구에서 평균 30.4개로 나타났으며, 마이크로웨이브 처리시간이 증가할수록 감소하는 경향성을 보였다(Table 1). 엽장, 엽면적, 지상부의 생체중 및 건물중에서도 엽수와 마찬가지로 처리시간이 증가됨에 따라서 감소하였으며, 각각 평균 20.2cm, 3,021cm2, 146.6g/plant 및 7.5g/plant로 무처리구에서 가장 높았다(Table 1). 지하부의 생체중 및 건물중은 12초 처리구에서 각각 평균 5.60g/plant 및 0.32g/plant로 4초 처리구와 비교하여 감소하였다(Table 1).
Table 1.
The growth parameters of lettuce (Lactuca sativa L.) grown in a hydroponics culture system after the microwave irradiation treatments for 0, 4, 8, and 12 seconds at the seedlings stage and 4 weeks later.
|
Microwave irradiation (seconds) |
Number of leaves |
Leaf length (cm) |
Leaf width (cm) |
Leaf area (cm2) | Shoot | Root | |||
|
Fresh weight (g/plant) |
Dry weight (g/plant) |
Fresh weight (g/plant) |
Dry weight (g/plant) | ||||||
| Controlz | 30.4 ay | 20.3 a | 8.6 | 3,021 a | 146.68 a | 7.57 a | 8.35 ab | 0.49 a | |
| 4 | 28.4 ab | 15.5 b | 7.3 | 1,875 b | 105.18 b | 5.54 b | 8.53 a | 0.49 a | |
| 8 | 26.2 ab | 17.0 ab | 7.8 | 1,877 b | 92.00 b | 4.81 b | 6.33 ab | 0.34 ab | |
| 12 | 25.4 b | 16.0 b | 7.6 | 1,851 b | 76.26 b | 3.95 b | 5.60 b | 0.32 b | |
| Significancex | * | ** | NS | ** | *** | *** | * | * | |
마그네트론(magnetron)에서 발생되는 2.45GHz 마이크로웨이브는 물 분자와 강하게 상호작용하여 물을 가열시킬 수 있다고 알려져 있다(Oh 등, 2008). 보통 상추 유묘에는 약 94%의 물을 함유하고 있기 때문에(Tibbitts와 Bottenberg, 1976), 전자레인지의 마이크로웨이브 처리는 상추 유묘 안의 물 분자를 운동시켜 열 스트레스와 동반될 것으로 사료된다. WLAN을 이용하여 2.4GHz 주파수와 70mW·m-2의 마이크로웨이브 처리는 파슬리(Petroselinum crispum)의 엽록체 길이와 면적, 세포벽 두께 및 미토콘드리아의 길이가 감소하였고, 세포소기관을 손상시켰다(Soran 등, 2014). 엽록체 및 미토콘드리아의 손상은 광합성과 물질대사를 감소시키며 식물의 성장을 억제시킨다(Griffin 등, 2001; Quintana-Cabrera 등, 2018). 본 실험 결과, 2.45GHz 주파수와 200W(4.17 kW·m-3)의 마이크로웨이브는 4, 8 및 12초 처리구에서 무처리구와 비교하여 엽면적, 지상부의 생체중 및 건물중이 감소하였다. 이는 마이크로웨이브 4초 처리부터 상추 유묘의 세포소기관에 악영향을 준 것으로 판단된다(Table 1). 이에 따라 광합성 및 물질대사가 감소되어 생육 증진이 저하된 것으로 사료된다. 근권부의 열 스트레스를 확인하기 위해 마이크로웨이브 처리 후 온도계(cooking thermometer, Shenzhen Anseny Electronic Technology Co., Ltd., China)를 이용하여 온도를 측정하였다. 마이크로웨이브 4, 8 및 12초 처리 후 근권부의 온도가 각각 23.7℃, 37.3℃, 55.1℃로 측정되었다. 겨이삭(Agrostis clavata)을 40℃의 환경조건에서 7일간 재배하였을 때 뿌리의 생육 증진이 저해되었다(Xu 등, 2008). 연구 결과를 고려하면 4초 처리구의 지하부는 열 스트레스를 받지 않아 생체중 및 건물중이 무처리구와 차이가 없었으며, 12초 처리구의 지하부는 열 스트레스로 인해 뿌리의 생육 증진이 저해된 것으로 판단된다.
2. Chlorophyll a, chlorophyll b 및 총 carotenoids 함량 분석
마이크로웨이브 처리 시간에 따른 상추의 chlorophyll a 및 chlorophyll b를 분석하였다(Fig. 1). Chlorophyll a는 12초 처리구에서 2.8μg·mg-1 DW로 4초 처리구 2.31μg·mg-1 DW와 비교하여 21.2% 증가하였지만, 무처리구 및 8초 처리구는 각각 2.54 및 2.45μg·mg-1 DW로 12초 처리구와 비교하여 유의한 차이가 없었다(Fig. 1A). Chlorophyll b의 경우 chlorophyll a와 유사한 경향을 나타냈다. 12초 처리구에서 2.36μg·mg-1 DW로 4초 처리구 1.28μg·mg-1 DW와 비교하여 84.4% 증가되었지만, 무처리구 및 8초 처리구는 각각 1.66 및 1.31μg·mg-1 DW로 12초 처리구와 비교하여 유의한 차이가 없었다(Fig. 1B).
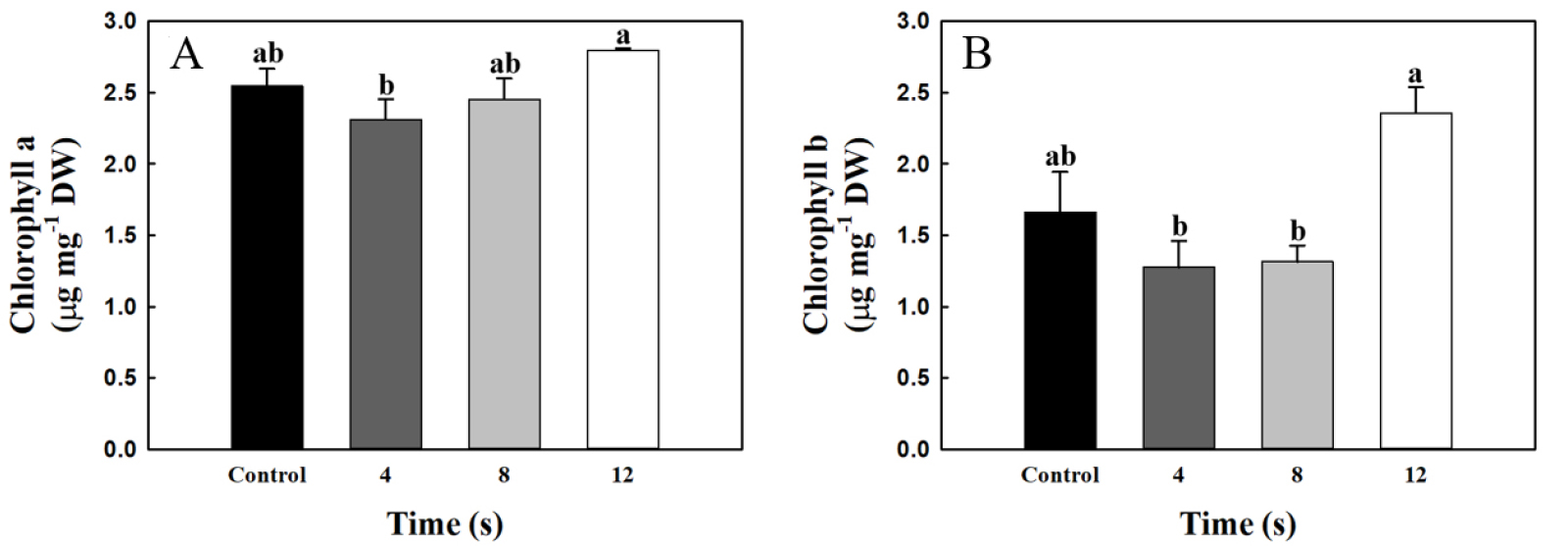
Fig. 1.
(A) Chlorophyll a and (B) chlorophyll b contents of lettuce (Lactuca sativa L.) under different microwave irradiation times (0, 4, 8, and 12 seconds) at the seedlings stage and 4 weeks later. Data are means ± SE (n = 10). Different letters indicate significant differences among treatments at the level of 5%, according to Tukey’s test.
낮은 출력의 마이크로웨이브는 온도 변화 없이 세포와 조직 내의 분자를 진동시키며 분자의 진동에 의해 활성산소종(reactive oxygen species)을 생성한다(Campisi 등, 2010; Senavirathna 등, 2014; Durdik 등, 2019). 활성산소종 분자는 불안정하여 세포 내부 구조의 세포막을 손상시켜 산화적 스트레스를 유발한다(Stark, 2005; Das와 Roychoudhury, 2014). 따라서, 마이크로웨이브는 식물체에 활성산소를 생성하여 산화적 스트레스를 발생시킬 수 있다(Sharma 등, 2009). Pérez-Gálvez 등(2020)의 보고에 의하면 광에너지를 수집하고 전달하는 과정에서 광에너지에 의해 활성산소종이 생성되어 산화적 스트레스를 발생시킬 수 있으며, 이러한 상황에서 chlorophyll은 항산화효소와 같이 활성산소종을 제거하고 세포 손상을 예방한다. 옥수수에 945MHz 주파수와 0.07-0.15mW·cm-2의 마이크로웨이브를 2주간 처리하여 총 chlorophyll이 42% 증가하였다(Khalafallah와 Sallam, 2009). 이러한 연구 결과들은 마이크로웨이브가 식물체에 산화적 스트레스를 발생시켰으며, 산화적 스트레스에 대한 방어작용으로 총 chlorophyll이 증가된 것으로 사료된다. 본 실험에서 상추 유묘에 200W와 2.45GHz의 마이크로웨이브는 4초 처리구와 비교하여 12초 처리구에서 활성산소종이 생성되어 산화적 스트레스가 발생되었으며, 활성산소종을 제거하기 위해 chlorophyll a 및 chlorophyll b의 함량이 증가된 것으로 사료된다.
총 carotenoids 함량은 chlorophyll a 및 chlorophyll b와 유사한 경향성을 나타냈다. 12초에서 12.29μg·mg-1 DW로 4초 처리구 9.22μg·mg-1 DW와 비교하여 33.3% 증가하였지만, 무처리구 및 8초 처리구는 각각 10.94 및 9.41μg·mg-1 DW로 12초 처리구와 비교하여 유의한 차이가 없었다(Fig. 2A). Carotenoids는 지질 과산화 반응(lipid peroxidation reaction)과 세포 내 초산화물 라디칼(superoxide radicals)의 생성을 감소시킨다(Zhu 등, 2016; Maslova 등, 2021). Krinsky(2001)에 의하면 carotenoids 색소가 일중항 산소(singlet oxygen)와 활성산소를 소멸시킨다. 이러한 연구들은 carotenoids가 산화물을 제거하여 산화적 스트레스로부터 세포를 보호한다는 것을 시사한다. Randhir와 Shetty(2004)의 연구에 따르면 마이크로웨이브가 세포에 산화적 스트레스를 발생시키며, 발생된 산화적 스트레스는 식물체가 열 스트레스를 감지하고 생존에 도움이 되는 생화학적 경로로 유도한다. 따라서, 4초 처리구와 비교하여 12초 처리구는 마이크로웨이브가 상추 유묘에 산화적 스트레스로 인식되었으며, 산화적 스트레스로부터 세포를 보호하기 위해 총 carotenoids의 함량이 증가된 것으로 사료된다.
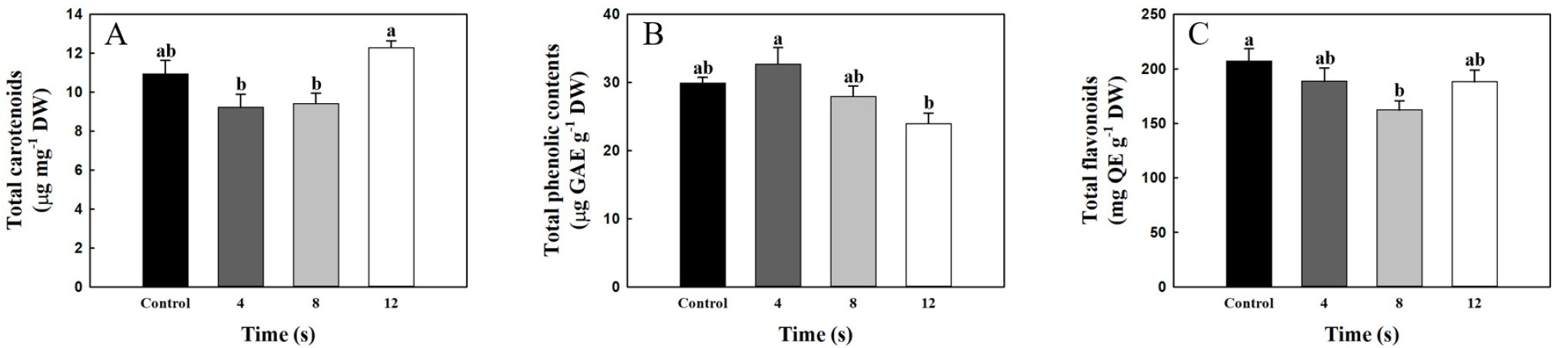
Fig. 2.
(A) Total carotenoids, (B) total phenolic contents, and (C) total flavonoids of lettuce (Lactuca sativa L.) under different microwave irradiation times (0, 4, 8, and 12 seconds) at the seedlings stage and 4 weeks later. Data are means ± SE (n = 10). Different letters indicate significant differences among treatments at the level of 5%, according to Tukey’s test.
마이크로웨이브 4, 8 및 12초 처리구에서 chlorophyll a, chlorophyll b 및 총 carotenoids의 함량이 무처리구와 비교하여 유의한 차이가 없었다(Fig. 1과 Fig. 2A). Chlorophyll a, chlorophyll b 및 carotenoids는 엽록체의 틸라코이드에 존재하는 광합성색소로 광합성 과정에 필요하며, 식물은 광합성을 통해 동화산물을 생성하여 이를 기반으로 생장한다(Staehelin, 2003; Evans, 2013). 마이크로웨이브는 NADH를 산화시켜 활성산소종이 증가함에 따라 산화적 스트레스가 발생하여 미토콘드리아에 손상을 주며, 증가된 활성산소종이 세포 핵의 DNA를 파손시켜 세포를 손상시킨다(Hao 등, 2015). 30mW·cm-2 출력으로 5분간 마이크로웨이브를 쥐에 처리 후 3일째에 미토콘드리아의 ATP함량이 가장 낮았으며, 7일째에 ATP함량이 정상적으로 회복되었다(Zhao 등, 2007). 이 연구결과는 마이크로웨이브 처리가 세포와 세포소기관들을 손상시키지만, 일정 시간이 지나면 정상적으로 회복할 수 있음을 시사한다(Khalil와 Villota, 1988; Shckorbatov 등, 2011). 마이크로웨이브 처리 후 상추 유묘는 산화적 스트레스로 엽록체가 손상되었으며, 4주 동안 광합성을 정상적으로 진행하기 위해 손상된 엽록체의 틸라코이드에서 광합성 색소가 무처리구 수준으로 회복된 것으로 사료된다. 무처리구와 비교하여 각 처리구에서 유의한 차이가 없었지만, 4초와 12초 처리구에서 유의한 차이는 마이크로웨이브 처리시간에 따라 상추 유묘가 산화적 스트레스의 감응도가 다르며, 4주 후 상추의 광합성 색소 함량에 영향을 줄 수 있음을 시사한다(Fig. 1과 Fig. 2A). 이에 낮은 출력에서 적절한 시간 동안 마이크로웨이브를 처리하면 광합성 색소 함량이 증대될 가능성이 있을 것으로 사료되며, 다양한 조건에서 추가 연구가 필요하다고 판단된다.
3. 총 페놀 함량 분석
총 페놀 함량(total phenolic contents)은 마이크로웨이브 무처리구에서 29.9μg GAE·g-1 DW로 나타났다. 4초 처리구에서 32.7μg GAE·g-1 DW로 12초 처리구 24μg GAE·g-1 DW와 비교하여 36.3% 증가되었으며, 8초 처리구 28μg GAE·g-1 DW와 유의한 차이가 없었다(Fig. 2B). 녹두(Vigna radiata)에 마이크로웨이브 처리시간이 길수록 항산화효소인 polyphenoloxidases(PPO)와 peroxidases(POD)가 증가하였고(Sharma 등, 2010), PPO와 POD는 페놀을 산화시키기 때문에 PPO와 POD의 증가는 페놀 함량의 감소를 시사한다(Alfred와 Eitan, 1979; Alemzadeh와 Nejati, 2009). 상추 유묘는 4초 처리구와 비교하여 12초 처리구에서 PPO와 POD를 증가시켰을 것으로 사료되며, PPO와 POD의 증가로 총 페놀 함량이 감소된 것으로 판단된다. 항산화 효소의 증감에 따라 총 페놀 함량이 변화할 때, 200W 조건의 마이크로웨이브는 4초 처리구와 비교하여 12초 처리구에서 식물체에 강한 스트레스로 인식되고 이를 방어하는 기작의 일환으로 항산화 물질의 감소를 유발하는 것으로 판단된다.
4. 총 플라보노이드 함량 분석
총 플라보노이드(total flavonoids) 함량의 경우, 8초 처리구에서 163.5mg QE·g-1 DW로 무처리구 207.9mg QE·g-1 DW와 비교하여 27.2%로 감소되었다(Fig. 2C). 4 및 12초 처리구는 각각 188.6 및 188.2mg QE·g-1 DW으로 무처리구와 유의한 차이가 없었다. 플라보노이드는 초산화물(superoxide)을 제거하며, 식물에서 산화적 스트레스에 의해 플라보노이드 함량이 증가될 수 있다(Arora 등, 1998; Cos 등, 1998; Mierziak 등, 2014). 하지만, 전자레인지의 마이크로웨이브는 강한 산화적 스트레스를 발생시키며, 세포기관들을 파괴하여 정상적인 물질대사를 진행하지 못하여 플라보노이드 함량이 감소될 것으로 사료된다(Kesari 등, 2013; Zeng 등, 2014; Yao 등, 2023). 본 실험에서 무처리구와 비교하여 8초 처리구에서 강한 산화적 스트레스에 의해 총 플라보노이드 함량이 감소된 것으로 판단된다. 마이크로웨이브는 극성분자의 전기 쌍극자를 진동시키며 열을 발생시킨다(Hoz 등, 2005; Jin 등, 2022). 식물에서 플라보노이드는 열 적응 및 동결 내성에 기능적 역할을 하며 열 스트레스로 플라보노이드 함량이 증가될 수 있다(Samanta 등, 2011; Wang 등, 2020). 끈끈이주걱(Drosera rotundifolia L.)에서 전자레인지를 이용한 마이크로웨이브 26.3kW 출력의 30초 처리는 열을 발생시켜 총 플라보노이드 함량을 증가시킨 것으로 보고되었으며(López-Orenes 등, 2022), 상추에 열 스트레스를 처리하였을 때 총 플라보노이드 함량이 증가한 연구가 보고되었다(Hawrylak-Nowak 등, 2018). 플라보노이드는 전구물질로 페닐알라닌(phenylalanine), 신남산(cinnamic acid), p-쿠마르산(p-coumaric acid) 등이 있다(MacDonald와 D’Cunha, 2007; Liu 등, 2021; Singh 등, 2021). 토마토를 열 스트레스 조건에서 재배하였을 때 페닐알라닌 암모니아 분해효소(phenylalanine ammonia-lyase)의 활성도가 증가하였으며(Rivero 등, 2001), 이는 신남산 함량이 증가될 수 있음을 시사한다. Austen 등(2019)의 연구에서 버드나무 삽수에 열 스트레스 처리 시 p-coumaroyl CoA의 함량이 증가되었지만, 플라보노이드의 함량은 감소되었다. 마이크로웨이브 12초 처리구는 8초 처리구와 비교하여 열 스트레스로 인해 플라보노이드의 전구물질인 신남산 및 p-coumaroyl CoA 함량이 증가된 것으로 사료된다. 선행연구에서 열 스트레스로 플라보노이드의 함량이 감소되었지만, 본 실험에서 상추 유묘는 4주 동안 마이크로웨이브로 발생한 손상을 회복하였으며, 8초 처리구와 비교하여 12초 처리구에서 회복된 상추 유묘가 증가된 p-coumaroyl CoA를 플라보노이드로 합성시켜 총 플라보노이드 함량이 증가된 경향성이 나타난 것으로 사료된다.




