서 론
현재 국내 공정육묘장에서는 농가의 다양한 요구수준 에 맞춘 고품질 채소 플러그묘가 정밀한 환경조절 조건 하에서 생산되고 있으나, 환경 및 재배관리의 기준은 묘 생산자의 경험을 바탕으로 이루어지고 있다(Park 등, 2017). 특히, 생산시기 및 생육단계별 적절한 수분관리는 채소 묘의 내적 및 외적 품질을 결정하는 중요한 환경 관리의 요소 중 하나이나, 관수의 시기와 관수량의 조절 에 있어서는 재배관리자의 주관적 판단에 전적으로 의존 하고 있어, 향후 공정육묘장의 생산효율성 제고를 위해 능동적 수분함량 계측을 통한 정밀관수 및 자동화 시스 템의 개발 필요성이 제기되고 있다(Kim 등, 2011).
식물의 광합성은 생물적(biotic) 및 비생물적(abiotic) 스트레스에 의해 크게 영향을 받는데, 특히 비생물적 스 트레스 중 건조스트레스는 광합성 활성을 제한하는 중요 한 환경요인으로 알려져 있다(Bradford와 Hsiao, 1982). 부적절한 관수에 의한 건조 스트레스는 외적인 식물 생 육 저하와 함께, 세포 탈수 및 삼투압 불균형 등의 체내 생리적 변화를 야기시키며(Mahajan과 Tuteja, 2005), 품 종, 생육단계 및 스트레스 수준에 따라서도 다양한 반응 을 보인다(Abbas 등, 2019).
최근 식물표현체학(Plant Phenomics)의 발달과 함께, 대량 유전자원의 표현형과 생리적 특성을 비파괴적으로 신속하게 판단하기 위한 기초 연구가 진행되고 있다 (Baker, 2008;Banks, 2018). 이러한 비파괴적인 표현형 특성평가 연구는 생물적 및 비생물적 스트레스에 대한 내성의 평가 영역으로까지 확장되고 있으며, 여러 스트 레스 평가 방법 중 엽록소형광의 측정은 비파괴적인 방 법으로서 다양한 연구가 진행되고 있다(Murchie와 Lawson, 2013). 식물체는 외부환경으로부터의 다양한 환 경스트레스에 의하여 광합성 활성이 감소되며 이러한 광 합성 수준의 감소는 엽록소형광반응의 측정을 통해 간접 적으로 정량화될 수 있다(Chaerle 등, 2007). 식물은 광 합성에 이용되는 에너지 이상의 과도한 에너지를 열이나 형광으로 방출하게 되는데, 이때 발생하는 형광을 엽록 소형광(Chlorophyll fluorescence)이라고 하며, 엽록소형 광의 다양한 지수들의 측정을 통하여 특정 환경조건에서 개별 작물의 광합성 활성을 수치화하여 객관적으로 평가 할 수 있다(Mishra 등, 2016). 이러한 엽록소형광 측정 기술은 식물체의 비생물적 스트레스(수분, 건조, 고온, 저 온, 염류 및 양분결핍)의 조기 탐지에 폭넓게 활용되고 있 다(Murchie와 Lawson, 2013). 비생물적 스트레스는 광계 II(Photosystem II)의 기구에 영향을 주어 광합성 활성 기 능을 저하시킨다고 알려져 있으며(Yamamoto 등, 2013), 엽록소형광 측정을 통해 얻은 다양한 단일 또는 복합지수 의 분석을 통해 특정 작물의 생리적 반응 및 광합성 기구 에 대한 정보를 해석할 수 있다(Force 등, 2003).
식물의 엽록소형광 수준은 JIP test(chlorophyll fluorescence induction curve), Kautsky effect(chlorophyll a fluorescence induction), Quenching 등 다양한 측정 기법을 적용하여 분석할 수 있으며, 그러한 기법들 중, 식물 스트레스의 진단에 폭넓게 활용되는 Quenching 기법은 암적응 또는 광적응 식물체의 다양한 엽록소형광 지수 측정에 활용되 고 있다(Cen 등, 2017). 특히, 암적응 식물체의 최대 광 화학적 효율(Fv/Fm; Maximum PSII quantum yield)은 광계 II(PhotosystemII)의 잠재적인 광합성 효율을 나타 내는 대표적인 엽록소형광 측정 지수로 알려져 있으며, 스트레스 조건하에서 특정 식물의 건전성을 판단하는 지 수로서 많은 연구자들에 의해 폭넓게 활용되고 있다 (Hazrati 등, 2016). 비광화학적 형광 소멸(NPQ; Nonphotochemical quenching)은 과도한 광에너지로부터의 자체 보호기작이며, 스트레스를 받을 경우 그 수치가 증 가하고 잉여에너지를 열로 소산시킴으로써 광합성 기능 을 보호한다(Ruban, 2016). 이외에도 엽록소형광의 다양 한 측정 지수로는, Fo(minimum fluorescence in dark adapted state), Fm(maximum fluorescence in dark adapted state), ФPSII(steasy-state PSII quantum yield), qP(coefficient of photochemical quenching in steadystate), Rfd(fluorescence decline ratio in steady-state) 등 이 있으며, 스트레스 수준의 진단에 독립적 또는 복합적 으로 사용되고 있다(Gorbe와 Calatayud, 2012).
이와 같이 엽록소형광 기법을 이용하여 건조 등 다양 한 스트레스 수준의 정량화 및 공정육묘장의 관수 자동 화를 위한 연구 등이 개별적으로 진행되고 있으나, 실용 적으로 정밀 관수를 하기 위한 지표로서의 엽록소형광 지수의 선발과 선발지수의 활용 가능성에 대한 연구는 부족한 실정이다. 따라서 본 연구는 수박 접목묘 생산 시 플러그트레이 셀 내 수분함량을 비파괴적으로 측정함 과 동시에 현재의 건조스트레스 수준을 정량화할 수 있 는 엽록소형광 지수를 선발하여, 관행적으로 이루어지는 플러그트레이 수분관리의 보완 가능성을 평가하였다.
재료 및 방법
실험재료 및 재배 환경조건
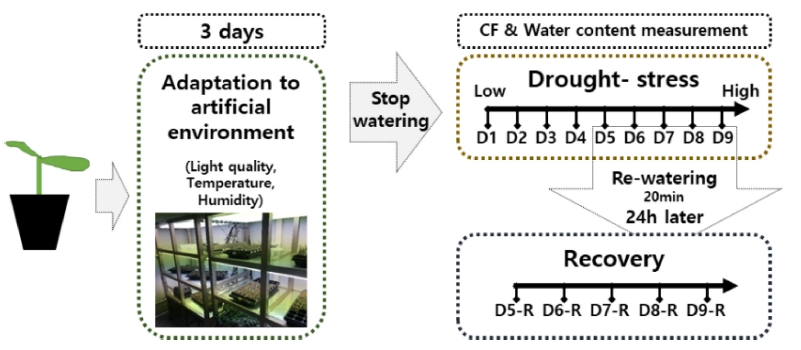
실험에는 전문육묘장에서 생산된 수박 접목묘가 이용되 었다. 파종 6일째에 대목품종 ‘동장군’(Syngenta Korea Co., Seoul, Korea)과, 접수품종 ‘퍼스트 꿀’(Jenong Co., Jeju, Korea)을 단근편엽합접 방법으로 접목하였다. 접목 후 6일차 활착이 정상적으로 이루어진 묘를 선별하여 건조스트레스 실험을 진행하였다. 건조스트레스 처리 실 험은 다단형 인공광이용 베드가 설치되어 있는 폐쇄형 식물공장 내에서 이루어졌으며, 실험기간 동안 식물공장 내 온도조건은 주야간 24/18°C, 일장은 주야간 14/10h, 습도는 40%로 유지하였고, 저면관수를 통해 1일 10분간 관수하였다. 인공광원으로서는 형광등(TLD 32W/865RS, Philips, Amsterdam, Netherlands)을 사용하였으며, 광도는 광원으로부터 플러그트레이의 하단에 위치시켜 측정된 210±10μmol·m-2·s-1 로 실험 종료 시점까지 재배하였다.
플러그트레이 단일 셀 내 수분함량 측정
플러그트레이 단일 셀 내 수분함량 수준을 비파괴적으 로 측정하기 위해 유전율 측정을 원리로 하는 플러그트 레이 셀 단위 수분함량 측정장치(Celmon-01, TSE Co, Seongnam, Korea)를 이용하였다. 측정장치는 개별 50공 플러그셀 크기의 고정장치, LCD모니터 및 전원공급장치 등으로 구성되어 있으며, 센서를 통해 수분함량 수준에 따라 유전율에 의한 일정 상대적 수치를 확보하였고, 이 를 실제 지하부 단일 셀의 배지 내 수분함량과 비교 분 석하였다. 플러그트레이 셀 단위 수분함량 측정장치와 일반적으로 사용하는 토양건조법과의 상관관계를 도출하 기 위해 50공 플러그트레이에 상토를 충전하고 0(일반적 인 상토 상태)부터 2ml 단위로 30ml까지 수분 공급 수 준을 달리하여 다양한 수분함량 조건의 배지를 확보하였 다. 상토가 충전된 개별 플러그트레이에 1차 증류수를 피펫으로 관수하고 2시간동안 일반 상온상태에 보관한 후 플러그트레이 셀 단위 수분함량 측정장치를 이용하여 각 처리별 유전율 수치를 확보하였다. 일반적으로 토양 함수량은 채취한 토양의 무게를 측정 후 항온기에서 105~110°C내에서 24~72시간 내에서 건조하여 건조 후 토양과 건조 전 토양과의 무게 차이를 통해 토양함수율 을 계상한다. 본 실험에서는 처리별 상토를 건조용 봉투 에 넣고 105°C 상태에서 96시간동안 건조하였다. 건조 전과 건조 후 상토의 실제 토양 무게를 측정하여, 실제 개별 플러그트레이 셀 내의 수분함량과의 상관관계 (R2=0.9698)을 도출하였다. 이를 바탕으로 실제 측정된 수분함량과 센서의 수치 값의 이용가능 범위를 상관분석 을 통해 확인하였다(Fig. 1).
건조스트레스 처리
활착이 완료된 접목묘는 식물공장 환경조건 하에서 건 조스트레스 처리 시작 전까지 3일간 적응시켰으며, 이후 관수를 제한함으로써 건조스트레스를 부여하였다(Fig. 2). 플러그트레이 개별 셀 단위의 건조스트레스 수준의 객관적 평가를 위하여 플러그트레이 셀 내 수분함량 센서 의 수치값과 개별 셀 내 상토의 수분함량 실측값(토양건 조법)과의 상관관계를 도출하고(Fig. 1), 이를 토대로 건조 스트레스 수준이 서로 다른 9그룹의 접목묘를 구분하였다. 세부적으로 유전율 측정센서의 수치값을 기준으로, D1(41~50, 충분한 관수 직후), D2(31~40), D3(21~30), D4(11~20), D5(6~10), D6(0~5), D7, D8 및 D9(극심한 건조스트레스)의 9단계로 건조 스트레스 수준을 구분하였 다. D1부터 D6까지의 범위에서는 센서로 스트레스 수준 의 구분이 가능하였으나, D7단계 이후의 심한 스트레스 범위에서는 단계간에 수치상 구분이 불가하였다. 플러그트 레이 수분함량 센서의 수치값이 구분되지 않는 단계에서는 24시간을 간격으로 측정하였다. 각 9단계의 단일 플러그트 레이 셀 내 실측 수분함량은 평균값으로서 53.0±1.8%(D1), 49.5±3.0%(D2), 42.3±3.1%(D3), 37.5±2.5%(D4), 32.1±2.9% (D5), 22.2±1.8%(D6), 20.8±1.6%(D7), 17.01±1.2%(D8) 및 15.7±1.1%(D9)에 해당하였다. 건조 스트레스 수준별로 구분된 수박 접목묘는 식물개체별 5반복으로 이후의 엽 록소형광이미지 측정에 이용하였다.
건조스트레스 회복 평가
건조스트레스로 인한 시듦증상이 육안으로 확인되는 단계(D5~D9)의 접목묘에 대해서는 재관수를 통한 생육 회복여부를 평가하였다(Fig. 2). 육안으로 건조스트레스 의 판단이 가능했던 D5(32.1%)단계 이후 D9(15.7%)단 계까지 관수 전 엽록소형광을 대조구로서 측정하였고, 회복 그룹은 20분간 저면관수한 뒤 24시간 후 회복 수 준을 측정하였다. 이는 저면관수 후 식물체가 완전히 플 러그트레이 셀내 수분을 이용할 수 있도록 충분한 시간 을 부여하였다. 저면관수를 통해 완전히 습윤한 상태의 단일 플러그트레이의 배지를 토양건조법을 통해 재관수 처리 그룹의 함수율을 측정한 결과, 수분함량 실측값은 D5-R(52.2%), D6-R(50.0%), D7-R(41.1%), D8-R(38.0%) 및 D9-R(27.4%)로 나타났다. 대조구 및 회복그룹에 해 당하는 각 접목묘는 식물개체별 5반복으로 엽록소형광 이미지 측정에 사용하였다.
엽록소형광 지수 측정
엽록소형광이미지장치(Chlorophyll fluorescence imaging; Closed Fluorcam FC 800-C, PSI, Drasov, Czech)를 이 용하여 16종의 엽록소형광 지수와 이미지를 획득하였다 (Table 1). 엽록소형광 측정을 위해 20분간 암적응시킨 후, 카메라와 식물체간의 거리를 20cm로 고정하고 측정하였 다. 엽록소형광 지수 획득을 위한 측정 기법은 Quenching Act2를 이용하였으며, 개별 식물체에 대하여 193초간 엽록 소형광 수준을 연속 측정하고, FluorCam7 (Version. 1.2.5.16, PSI, Chez)을 이용하여 측정된 이미지에서 수 박 접목묘의 접수부위의 영역을 직접 분리하여 다양한 지수와 영상을 획득하였다.
결과 및 고찰
건조스트레스 수준별 엽록소형광곡선의 패턴 변화
플러그트레이 셀 내 수분 감소에 따라 D1(53.0%, 충 분한 수분 상태)부터 D9(15.7%, 극심한 건조스트레스)단 계로 구분하여 각 단계별로 Quenching Act2를 이용하여 엽록소형광을 측정하였다. 건조 스트레스의 탐지에 있어 서 엽록소형광측정 기법의 효용성을 사전 평가하기 위하 여, 9단계로 구분된 건조스트레스 단계 중, 뚜렷한 외관 적 차이의 인지가 가능했던 D1(53.0%, 충분한 수분 상 태), D5(32.1%, 육안판단 가능) 및 D9(15.7%, 극심한 건 조스트레스)의 3단계를 선정하여 엽록소형광곡선을 분석 하였다(Fig. 3). D1(53.0%, 충분한 수분 상태)단계는 본 실험에서 초기 설정을 통해 유도되는 정상적인 표준 엽 록소형광곡선으로 나타났으며, 건조스트레스를 받은 것으 로 추정되는 D5(32.1%, 육안판단 가능) 및 D9(15.7%, 극심한 건조스트레스)단계 역시 D1단계와 유사한 형태 의 패턴을 보였으나, 플러그트레이 셀 내 수분 함량에 따라 엽록소형광의 절대 수준은 차이가 있는 것으로 나 타났다.

Fig. 3
Representative kinetic chlorophyll fluorescence curves in scion of grafted watermelon seedlings at different level of water content (D1: 53.0% water content; D5: 32.1% water content; and D9: 15.7% water content). Fo: minimum fluorescence in dark-adapted state; Fm: maximum fluorescence in dark-adapted state; Fm Ln: maximum fluorescence during light adaptation; Fm_Dn: instantaneous maximum fluorescence during dark relaxtion; Fm_Lss: steady-state maximum fluorescence in light; Fp: peak fluorescence during the intial phase of the kautsky effect; Ft_Ln: instantaneous fluorescence during light adaptation; Ft_Dn: instantaneous fluorescence during dark adaptation; Ft_Lss: steady-state fluorescence in light.최근 엽록소형광을 이용하여 식물체의 비생물적 및 생 물적 스트레스에 따른 피해를 확인하기 위해 다양한 기 법들이 활용되고 있으며, 이중 Quenching Act2를 이용 하여 측정된 엽록소형광 곡선은 식물체의 최소 및 최대 형광, 암적응과 광적응 구간, 연속광의 횟수와 세기에 따라 엽록소형광 수준 변화를 모니터링하는데 활용되고 있다(Ruban, 2016;Yao 등, 2018). 건조스트레스 단계 중 D9(15.7%, 극심한 건조스트레스)단계에서 엽록소형 광 수준이 낮아지는 것은 광합성 기구 내 PSII 반응 중 심에 위치한 전자수용체 퀴논(quinone)이 환원됨에 따라 PSII가 지니고 있는 광화학적 효율성이 감소하는 기존 결과와 유사하였다(Mishra 등, 2016;Yamamoto 등, 2013). 특이적으로 극심한 건조스트레스인 D9(15.7%)단 계와 배지내 수분이 충분한 상태인 D1(53.0%)단계에 비 해 D5(32.1%, 육안판단 가능)단계에서 엽록소형광 수준 이 증가하는 것을 확인하였는데, 이는 Arabidopsis를 대 상으로 건조스트레스를 부여하여 엽록소형광 수준을 검 토한 결과, 일정 수준의 건조스트레스를 받은 처리구는 광에너지를 받아들여 활용하는 광합성 기구의 특이적인 광에너지 이용 차이에 따른 것으로 본 연구와 유사하였 다(Yao 등, 2018). 따라서 엽록소형광을 측정하면 육묘단 계에서의 건조스트레스 수준을 정량적으로 수치화하고, 평가할 수 있을 것으로 판단된다.
건조스트레스 수준에 따른 개별 엽록소형광 지수의 변화
단일 플러그트레이 셀 내 건조스트레스에 반응하는 수 박 접목묘의 엽록소형광 지수 변화를 9단계의 수분스트 레스 그룹에 대하여 분석하였다(Fig. 4). 측정된 총 16개 의 모든 엽록소형광 지수는 건조스트레스의 육안판단 직 전 단계인 D1에서 D4단계까지 유의적인 차이를 보이지 않고 일정한 범위를 유지하였다. 대목의 떡잎이 시들기 시 작하여 육안으로 건조스트레스의 판단이 가능했던, 초기 스트레스 범위인 D5∼D7단계에서 일부 지수의 특이적인 증감 경향이 관찰되었으며, 이후 D8∼D9단계에서는 모든 지수에 대하여 전체적으로 감소하는 경향을 보였다. 엽록 소형광곡선 분석을 통해 일정 수준의 건조스트레스는 식 물체의 엽록소형광 발생량을 증가시키고, 이후 극심한 건 조스트레스가 지속되면 광합성 기구의 광에너지를 이용할 수 있는 능력을 잃어버리는 것으로 판단된다. 엽록소형광 지수 중 Fm_Lss, Ft_Lss, Fv_Lss, NPQ_Lss 및 qN_Lss의 D9(15.7%, 극심한 건조스트레스)단계에서의 큰 감소는 극단적인 건조스트레스 조건에서 식물체의 광합성 기구 의 손상 때문인 것으로 판단된다(Yao 등, 2018).
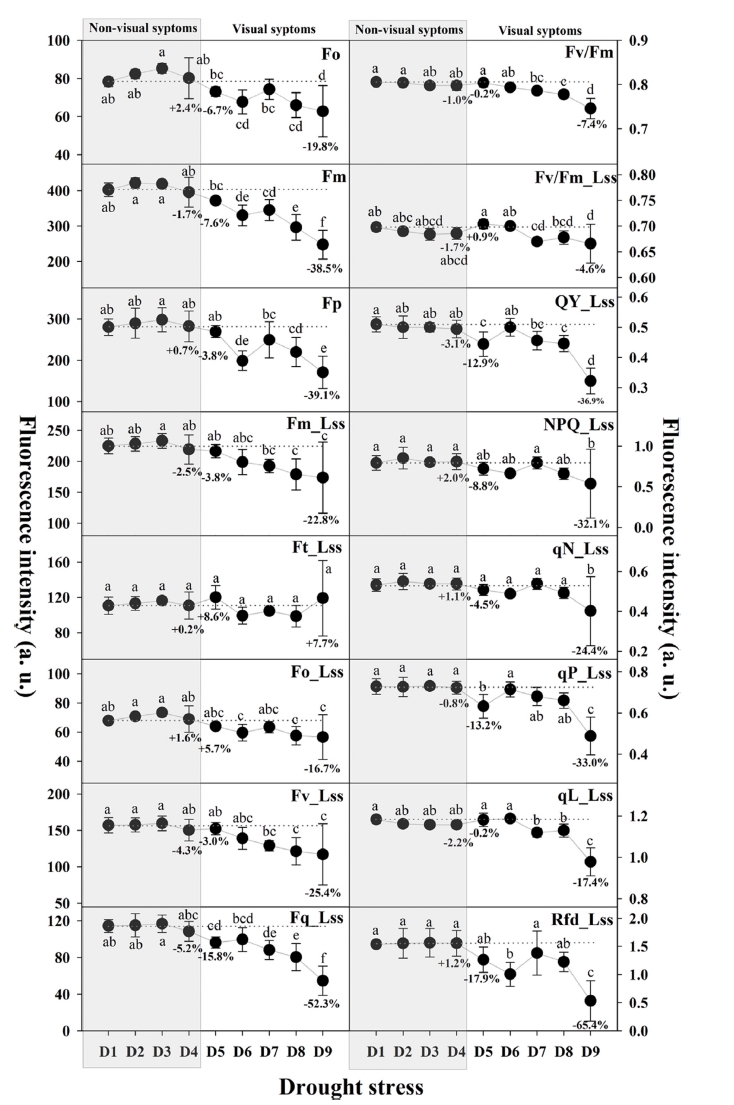
Fig. 4
Changes in chlorophyll fluorescence parameters during the different water levels. D1: 53.0%; D2: 49.5%; D3: 42.3%; D4: 37.5%; D5: 32.1%; D6: 22.2%; D7: 20.8%; D8: 17.0%; D9: 15.7%. Please refer to the table 1 for all the fluorescence parameters. Different letters within the graph represent a significant difference at p<0.05 using Duncan’s multiple range test.다른 모든 지수들에 비해, 엽록소형광감소율(Rfd_Lss) 는 D5(32.1%, 육안판단 가능)단계에서 감소경향을 보이 며 D6단계의 초기 건조스트레스 조건에서 유의적인 감 소를 확인하였다. 그러나 이후 좀 더 지속적인 스트레스 조건인 D7단계에서의 일시적 증가는 건조스트레스에 반 응하는 식물체의 기작으로 판단된다. 이러한 일시적인 증가는 건조스트레스로 기인한 식물체의 광합성 기구의 대응전략으로 볼 수 있으며, 더욱 극심한 건조스트레스 는 잎의 수분포텐셜을 감소시키고, 광합성 속도를 낮추 어 광합성 효율을 감소시키는 것으로 보인다(Lawlor와 Cornic, 2002;Chaves와 Oliveira, 2004).
일반적으로 수분 스트레스는 식물체의 기공폐쇄, RuBisCo의 비활성화로 인하여 단기적 및 장기적으로 광 합성에 영향을 주는 비생물적 스트레스로 알려져 있다 (Gorbe와 Calatayud, 2012). Fv/Fm은 암적응시 식물체의 광합성 수준을 평가할 수 있는 대표적인 엽록소형광 지 수로, 다양한 비생물적 및 생물적 스트레스 탐지에 활용 되고 있으나(Rungrat 등, 2016), 본 연구에서 수박접목묘 의 건조스트레스로 인한 Fv/Fm은 유의한 차이를 보이지 않았다. 이러한 결과는 건조스트레스가 PSII의 최대 광 화학적 효율(Fv/Fm) 감소에 미치는 연관성이 적다는 연 구결과와 일치하였다(Yao 등, 2018). 따라서 단기적인 건조스트레스 조기 탐지를 위한 엽록소형광 지수로 PSII 의 최대 광화학적 효율(Fv/Fm)의 활용은 어려울 것으로 판단된다. 식물은 광에너지를 흡수한 후, fluorescence, qP 및 qN의 세가지 경로로 활용하며(Wang 등, 2018), qP_Lss는 광합성 과정 중 사용되는 에너지 비율을 나타 내기 때문에 PSII의 개방성 수준을 나타내는 측정 지수 로 활용된다(Baker 와 Rosenqvist 2004;Li 등, 2013;Hazrati 등, 2016). 건조스트레스는 식물체의 엽에 존재 하는 수분 감소로 이어져 광합성 기구에 존재하는 PSII 반응 센터의 구조적 손상을 일으키는데, 광에너지 수준 을 나타내는 qP_Lss가 감소한 것으로 보여진다(Zlatev, 2013;Wu et al., 2018). 따라서 초기 Rfd_Lss와 qP_Lss 의 두 지수들은 최대 광화학적 효율(Fv/Fm)에 비해 건 조스트레스 수준에 따른 민감도가 높아 수박접목묘의 건 조스트레스 진단에 활용할 수 있을 것으로 판단된다.
건조스트레스 후 관수재개에 따른 광합성 회복수준 평가
일반적으로 심각한 건조스트레스에 노출된 후 회복된 묘의 건전성을 육안으로 판단하고, 이를 정량적으로 객 관화하기에는 어려운 실정이다. 따라서 육안으로 판단할 수 없는 광합성 수준을 엽록소형광 이미지 기술을 이용 하여 정량화하고 신속하게 건전묘 분류를 위한 판단 기 준으로 적용하고자 하였다.
앞서 건조스트레스에 반응하는 다양한 엽록소형광 지 수 중 신속한 건조스트레스 탐지를 위해 초기 건조스트 레스 범위 D5(32.1%)~D7(20.8%)단계에서 반응하는 엽 록소형광 지수를 모니터링 하였다. 그 결과 엽록소형광 감소율(Rfd_Lss)과 장기적인 건조스트레스 및 광합성 회 복 수준을 평가하기에 적합하다고 판단되는 최대 광화학 효율(Fv/Fm)을 선발하였다. 더불어 D5(32.1%, 육안판단 가능)∼D9(15.7%, 극심한 건조스트레스)단계에 각 단계 별로 재관수하여 생육의 변화를 확인하였다(Fig. 5).
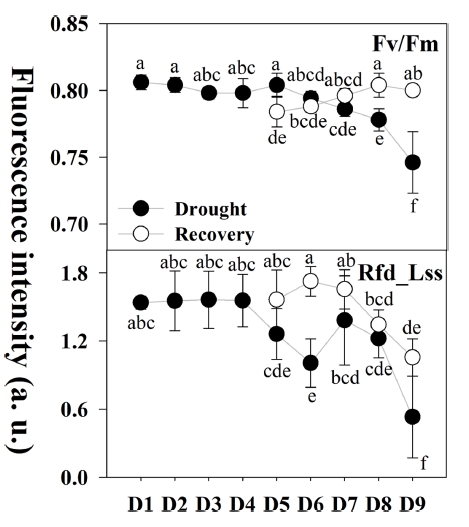
Fig. 5
Changes in chlorophyll fluorescence parameters (Fv/Fm and Rfd_Lss) after the recovery test during different water level condition. D1: 53.0%; D2: 49.5%; D3: 42.3%; D4: 37.5%; D5: 32.1%; D6: 22.2%; D7: 20.8%; D8: 17.0%; D9: 15.7%. Please refer to the table 1 for all the fluorescence parameters. Different letters within the graph represent a significant difference at p<0.05 using Duncan’s multiple range test.초기 건조스트레스 범위 D5(32.1%)~D7(20.8%)단계에 서 Fv/Fm 지수로 스트레스 수준 판단이 어려웠으나, 심 각한 건조스트레스에 노출되면 지수가 감소하는 것으로 나타났다.
회복 그룹 중 D5-R(52.2%)단계는 건조 그룹인 D5(32.1%, 육안판단 가능)단계에 비해 회복되지 않은 것 으로 나타났으나, 이후 회복그룹은 일반적인 식물체의 건전성을 나타내는 0.80~0.83 수준으로 회복되었다.
엽록소 형광 감소율(Rfd_Lss)은 식물의 광합성 과정에 대한 잠재적인 활성 수준을 나타내는 지표로서 활용되고 있다(Yao 등, 2018). Rfd_Lss는 건조그룹에 비해 회복그 룹은 높은 광합성 활성 수준을 나타냈으나, 초기 건조스 트레스 범위 D7(20.8%)단계 이후 감소하였으며 이후 동 일한 수준으로 회복되지 않았다. 이는 극심한 건조스트 레스를 받은 묘에 다시 관수가 이루어지더라도 광합성 기구에 큰 손상에 따른 피해의 결과로 판단된다. 회복 그룹 D5-R(52.2%), D6-R(50.0%) 및 D7-R(41.1%)단계 에서 건조 그룹에 준하여 광합성 활성 수준이 회복되는 것을 확인하였으며, 이는 식물체의 필요 수분 공급으로 인해 광합성 활성 수준이 회복된 것으로 보여진다(Gashi 등, 2013). 더불어 건조스트레스에 영향을 받은 식물은 근권부의 이용 수분 부족으로 인한 피해가 나타나기 때 문에, 접목묘의 접수 부위를 보호하고 있는 대목이 접수 에 비해 먼저 나타난 것으로 나타났다(Widaryanto 등, 2017).
이를 통해 초기 건조스트레스 범위에는 엽록소형광감 소율(Rfd_Lss), 극심한 건조스트레스 및 재관수를 통한 회복 평가에는 최대 광화학 효율(Fv/Fm)지수가 건조스 트레스 탐지에 적용 가능할 것으로 판단된다.
건조스트레스 및 재관수에 따른 외형 및 엽록소형광 이미지 변화
엽록소형광 이미지(CFI)는 각각의 측정 지수 형광 강 도에 의한 색의 변화에 근거하였으며, 건조스트레스 및 회복처리에 따른 형광 수준 범위 내에서 파란색은 형광 강도가 가장 낮고 붉을수록 형광 강도가 가장 높음으로 설정하여 분석하였다(Fig. 6). 건조스트레스처리 이후 실 제 수분함수율의 감소와 외관상 생육 변화도 함께 확인 하였다.
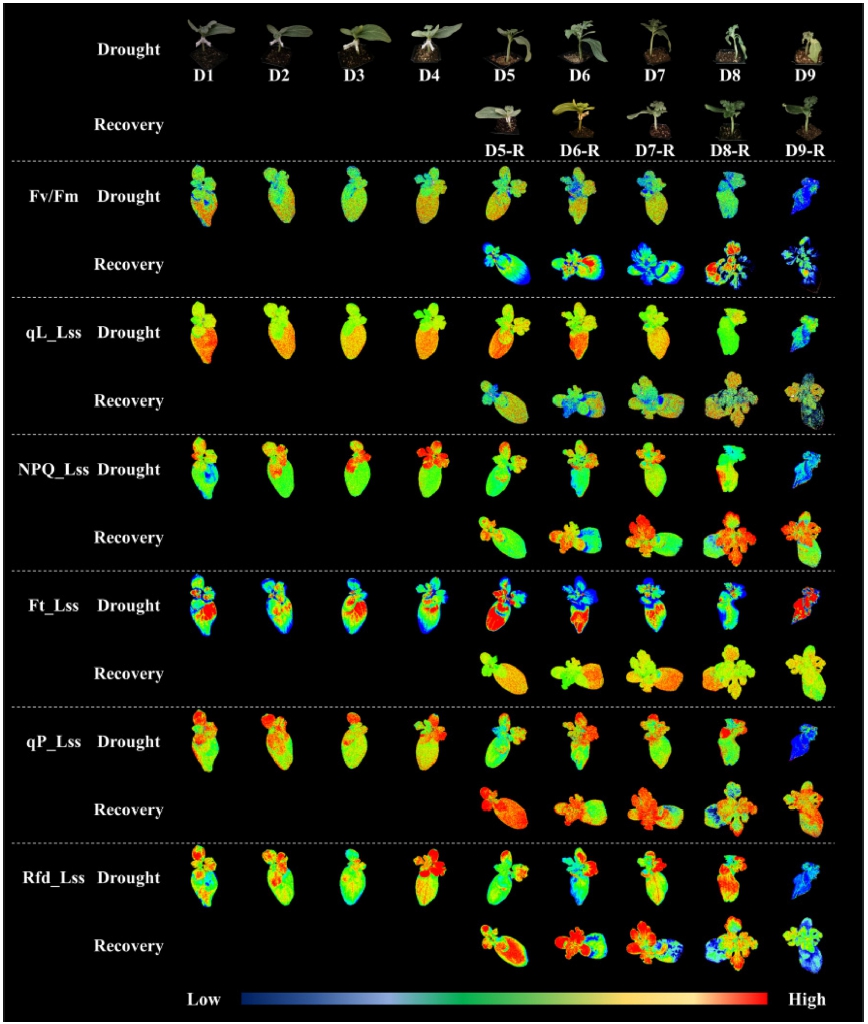
Fig. 6
Changes in chlorophyll fluorescence imaging of scion of grafted watermelon during different water level conditions and recovery tests. D1: 53.0%; D2: 49.5%; D3: 42.3%; D4: 37.5%; D5: 32.1%; D6: 22.2%; D7: 20.8%; D8: 17.0%; D9: 15.7%. Please refer to the table 1 for all the fluorescence parameters.D5(32.1%, 육안판단 가능)단계에서 육안으로 대목부터 건조스트레스에 의한 시듦 증상이 나타났으며, 접수에는 육안상 증상이 나타나지 않았다. 초기 건조스트레스 범 위 D6(22.2%)~D7(20.76%)단계 이후 접수에도 일부 시 듦 증상이 나타났으며, 이후에는 식물체가 도복하였다. 극심한 건조스트레스 범위 D8(17.0%)~D9(15.7%)단계 에 이르러 육안으로도 접수의 수분함량이 크게 감소된 것으로 판단된다. 시듦 증상이 심해지는 것은 플러그트 레이 단일 셀 내 토양 건조를 통해 극심한 건조스트레 스 범위의 셀 내에서도 수분이 확인되었으나, 식물체가 이용할 수 없는 수분의 형태로 존재하기 때문으로 판단 된다.
초기 건조스트레스 단계에서 Fv/Fm은 유의적인 지수 의 변화가 확인되지 않았으며, 엽록소형광 이미지 상에 서도 큰 변화는 없는 것으로 나타났으나, D6(22.2%)단 계에서 형광이미지의 변화가 탐지되었다. 또한 회복그룹 D8-R(38.0%)~D9-R(27.4%)단계에서는 접수의 잎 말단의 조직 파괴로 엽록소형광의 탐지가 불가능하였다. Rfd_Lss 는 초기 건조스트레스 범위 D5-R(52.2%), D6-R(50.0%) 단계에서 감소하였으며, D7-R(41.1%)단계에서 증가 경 향을 보였는데, 이는 초기 건조스트레스 단계에서 엽록 소형광지수가 일시적으로 민감하게 감소하나, 이후 스트 레스 수준이 지속되거나 심화될 때 다시 수치가 증가하 는 것은, 광에너지 이용 효율 증대를 위한 식물자체의 환경 적응과정으로 판단된다. qP_Lss는 건조그룹 D4(37.5%, 육안판단 직전)단계에서 다른 단계에 비해 대목의 활성도가 낮은 것으로 나타났으며, NPQ_Lss는 일반적으로 스트레스시 증가하는데, 재관수가 되어 회복 된 외형에 비해 엽록소형광 이미지로 접수의 열 소산 수치가 높은 것으로 나타났다. 따라서 엽록소형광 이미 지를 통해 재관수시 수박접목묘의 광합성 기구의 활성을 확인할 수 있을 것으로 판단된다. 개별 엽록소형광지수 의 수치값의 유의적 차이뿐만 아니라 이미지만으로도 직 관적으로 건조스트레스 수준을 확인할 수 있었으며, 이 는 건조스트레스에 대응하여 엽록소형광 이미지를 분석 제시한 기존 연구결과와 동일한 것으로 나타났다(Baker 와 Rosenqvist 2004;Rungrat 등, 2016;Yao 등, 2018).
본 연구의 결과로, 수박접목묘의 플러그트레이 셀 단 위 건조스트레스 수준을 조기 탐지할 수 있는 엽록소형 광 지수로는, 초기 건조스트레스 범위에서 민감하게 반 응한 엽록소형광감소율(Rfd_Lss)로 판단되었다. 또한 조 기 건조스트레스 탐지 외에 극심한 건조스트레스 및 재 관수를 통한 회복 평가에는 최대 광화학 효율(Fv/Fm)지 수가 건조스트레스 탐지에 적용 가능할 것으로 판단된다. 본 연구는 엽록소형광 이미지 측정 기술을 이용하여 플 러그트레이 단일 셀 내 건조스트레스 수준을 정량화하고 적합한 지수를 선발한 선도적인 연구결과로 판단되며, 향후 대상 작물 및 비생물적 스트레스의 종류별 엽록소 형광 지수의 선발과 농업적 적용에 대한 연구 확대가 필요할 것으로 판단된다.