서 론
재료 및 방법
1. 실험 재료 및 온도 처리
2. 시료 채취 및 과실 품질 분석
3. 개별 안토시아닌 함량 분석
4. ABA, GA 함량 분석
5. 통계 분석
결 과
1. 야간 고온에 의한 과피색 및 품질 변화
2. 안토시아닌 함량 변화
3. ABA, GA 함량 변화
고 찰
1. 수준별 야간 고온에 의한 과피색 불량
2. 과피색 불량과 안토시아닌 조성
3. ABA, GA 함량과 과피색 변화
서 론
포도의 과피색은 과실의 품질을 평가하는 중요한 요인이며, 과피색은 안토시아닌의 조성 및 함량에 의해 결정된다(Castellarin과 Gaspero, 2007). 포도 과피에는 자연계에 일반적으로 존재하는 6종의 안토시아닌 그룹 중 pelargonidin (Pel)을 제외한 cyanidin(Cya), delphinidin(Del), peonidin (Peo), petunidin(Pet), malvidin(Mal) 5종류의 안토시아닌이 존재하며(Liang 등, 2008), 안토시아닌 함량 및 조성은 유전적인 요인뿐만 아니라 광, 온도 등의 환경적인 요인에 의해서도 영향을 받는다(Shinomiya 등, 2015; Tarara 등, 2008). 과피의 안토시아닌 합성은 사과, 포도, 딸기 등의 과실에서 성숙기 고온에 의해 억제되고, 저온에 의해 촉진된다(Ikeda 등, 2011; Lin-Wang 등, 2011; Yamane 등, 2006).
성숙기 고온은 포도 과피의 식물호르몬 abscisic acid(ABA) 증가를 억제하고(Azuma 등, 2012) 반대로 gibberellin(GA)의 감소를 억제하는데(Ryu 등, 2020), 이러한 호르몬의 변화는 안토시아닌 생합성 유전자의 발현을 억제하며(Azuma 등, 2012; Shinomiya 등, 2015; Yamane 등, 2006) 총 안토시아닌 감소와 더불어 안토시아닌의 조성을 변화시켜 과피색 불량을 가져온다(Mori 등, 2005a; De Rosas 등, 2017).
국내 주요 대립계 품종인 ‘거봉’(Vitis labruscana L.) 포도는 여름철 고온으로 인한 과피색 불량이 수년간 보고되고 있으며, 기후변화로 인해 여름철 폭염 및 열대야 일수가 점점 증가하면서(Lee 등, 2012) 앞으로 이 문제가 더 심각해 질 것으로 예상된다. 여름철 이상 고온에 의한 포도의 과피색 불량을 예측하기 위해서는 고온이 과피색에 영향을 미치는 시기 및 과피색 발현을 억제하는 고온의 수준에 대한 연구가 필요하며, 고온에 가장 취약한 시기는 성숙 초기 과립의 색이 변하기 시작하는 변색기(veraison)로 밝혀져 있다(Azuma 등, 2012; Koshita 등, 2015). 주로 주야간 고온 처리의 영향을 분석했기 때문에(Mori 등, 2007b; Shinomiya 등, 2015) 야간의 수준별 고온에 의한 포도 과피색 발현 연구는 상대적으로 부족하며(Kliewer와 Torres 등, 1972) 여름철 열대야에 의한 과피색 발현을 예측하기에 한계가 있다. 따라서 본 연구는 변색기의 수준별 야간 고온이 '거봉’ 포도의 과피색 발현에 미치는 영향을 분석하기 위해서 수행되었으며, 과피색의 변화를 해석하기 위해 개별 안토시아닌과 식물호르몬 ABA, GA의 함량을 분석하였다.
재료 및 방법
1. 실험 재료 및 온도 처리
완주군 국립원예특작과학원 내의 유리온실에서 ‘거봉’ 나무를 대상으로 변색기의 야간 온도를 수준별로 처리하여 과피색 변화, 과실 품질, 개별 안토시아닌, 식물호르몬 ABA, GA의 함량을 비교하였다. 시험수는 약 150L 용량의 나무 화분에서 5년간 재배하였고, 매년 3월 완숙 퇴비를 주당 2kg, 7월부터 9월까지 관주용 비료를 물에 희석하여 3L씩 총 3번 관주하였다(S-Feed, 9N-11P-37K, Farm Hannong, Seoul, Republic of Korea). 만개기(6월 4일)와 만개 2주 후 두 번에 걸쳐 GA3 25ppm 용액(Gibberellin, Daeyu, Seoul, Republic of Korea)으로 처리하여 무핵으로 재배하였고, 6월 30일경 송이당 40립씩 남기고 제거하였다. 시험수는 7월 14일(만개 후 40일, 변색기 10일 전)부터 8월 3일(만개 후 60일)까지 20일 간 수준별 야간 고온으로 처리하였다. 처리 온도는 Shinomiya 등(2015)의 주야간 항온 실험을 통해 과피색 불량이 나타났던 온도를 기준으로 설정하였고, 주간 온도는 30°C로 고정하되 야간을 27, 24, 21°C의 3수준으로 처리하였다. 시험구 당 3주씩 처리하였고, 한 주당 4송이(송이당 성엽 15매 이상 확보)의 포도를 착과시켜 과실 품질 및 물질 분석에 활용하였다. 온도 처리가 종료된 이후에는 모든 시험구의 온도를 모두 완주지역 8, 9월의 30년 평균 기온을 시간 별로 적용하였으며, 8월의 온실 내 최저, 최고기온은 23.2-29.8°C, 9월은 20.1-27.8°C으로 유지되었다.
2. 시료 채취 및 과실 품질 분석
과피색의 변화를 관찰하기 위해 만개 후 40일부터 10일 간격으로 과립 시료를 채취하였다. 시료채취 방법은 시험수 내의 모든 과방의 착색을 농촌진흥청에서 제시한 ‘거봉’의 칼라차트 값(1, 녹색; 10, 자흑색)으로 환산하여 평균값을 산출하였고, 그 값에 해당하는 과립을 주당 4립씩 3반복으로 채취하였다. 과립은 양쪽 적도면을 대상으로 색차계(CR-300, Minolta, Osaka, Japan)를 이용하여 색차값을 측정한 후, 과피를 과육에서 분리하여 액체질소에 얼린 상태로 막자 사발로 분쇄하여 물질 분석에 활용하였다. 과실의 품질은 9월 11일(만개 후 100일)에 일괄 수확하여 과방중을 조사하였고, 송이 당 10개의 과립을 선정하여 과립중을 조사한 뒤, 과즙을 착즙하여 굴절 당도계(PR-101, Atago, Tokyo, Japan)로 당도를 측정하고 적정 산도(0.1N NaOH, pH 8.1)를 조사한 후 주석산으로 환산하여 표기하였다. 과피색은 농촌진흥청에서 제시한 ‘거봉’의 성숙기 판정용 칼라차트를 기준으로 조사하였다.
3. 개별 안토시아닌 함량 분석
안토시아닌의 추출 및 분석은 Ryu 등(2020)의 방법을 약간 수정하여 활용하였다. 분쇄한 과피 0.1g에 MeOH와 0.1N HCl을 85:15(v:v)로 혼합한 추출액을 2ml 넣고 암조건에서 15시간동안 추출한 뒤, 3,600rpm으로 10분 동안 원심분리하여 상등액을 0.45µm syringe filter에 여과하여 HPLC(1100 Series, Hewlett-Packard, Germany)로 분리 및 정량 분석하였다. 안토시아닌 분리에 이용한 컬럼은 YMC-Pack Pro C18 RS(250 × 4.6mm, 5µm, YMC, Japan)이며, 40°C에서 37분 동안 분석하였다. 안토시아닌 함량은 518nm의 파장에서 malvidin 3-glucoside(Extrasynthese, France)의 표준품을 이용해 작성한 표준곡선으로 정량하여 mg·g-1의 단위로 나타내었다.
4. ABA, GA 함량 분석
식물 호르몬 ABA, GA의 추출 및 정량 분석은 Ryu 등(2020)의 방법을 약간 수정하여 활용하였다. ABA는 30% MeOH를 추출 용매로 활용하였고, 내부표준물질로 d6-ABA를 4ng씩 첨가시켜 12시간 동안 암조건에서 추출하였고, dichloromethane으로 liquid-liquid extraction하여 감압 농축 후 MeOH에 재용해하여 기기 분석에 활용하였다. GA1은 50% MeOH을 추출 용매로 활용하였고, 내부표준물질로 d2-GA1을 4ng씩 첨가시켜 4°C 암조건에서 12시간 동안 추출하였다. 추출된 용매는 Sep-pak C18 카트리지에 통과시켜 감압 농축시킨 뒤 MeOH에 재용해시켜 분석하였다. ABA 및 GA1의 함량은 ng·g-1의 값으로 나타내었으며, 3반복으로 분석하였다. 호르몬의 정량 분석은 ion trap MS detector(Finnigan LXQ, Thermoelectron, Marietta, USA)가 부착된 HPLC(Nanospace SI-2, Shiseido, Japan)를 이용하였다. 내부표준물질과 목표 물질의 peak 면적 간의 비율을 기본으로 정량이 이루어졌으며, ABA는 263 → 153m/z, d6-ABA는 269 → 159m/z, GA1은 347.1 → 303.1m/z, d2-GA1은 349.2 → 305.2m/z를 multiple reaction monitoring 조건으로 각각 설정하여 정량하였다.
5. 통계 분석
과피 색차값, 안토시아닌, 호르몬 함량은 3반복으로 분석하여 평균값과 표준오차(standard error)로 나타내었고, 과실 품질은 송이당 1반복으로 하여 처리당 총 10반복 값에 대하여 평균 간의 차이를 분석하였다. 모든 통계처리는 SAS enterprise guide 7.2 프로그램(SAS Co., Cary, USA)을 활용하여 최소유의차 검정(least significant different)으로 평균 간의 유의성(p < 0.05)을 검정하였다.
결 과
1. 야간 고온에 의한 과피색 및 품질 변화
만개 후 40일부터 60일까지 야간 고온 처리에 의해 ‘거봉’ 포도의 과피색 불량이 나타났다(Fig. 1). 고온처리 종료 직후(만개 후 60일) 야간 21°C 처리구에 비해 야간 24, 27°C 처리구의 과피 착색이 지연되었고, 이러한 경향은 수확기인 만개 후 약 100일까지 유지되었다. 야간 24°C 처리구는 만개 후 70일부터 과피가 착색되기 시작하였고, 야간 27°C 처리구는 만개 후 70일과 80일 사이에 변하기 시작하였다. 만개 후 60일부터는 모든 처리구가 동일한 온도 조건에서 재배되었음에도 불구하고 야간 21°C 처리구의 송이가 ‘거봉’의 일반적인 과피색인 흑자색으로 발달한 것과 달리, 야간 24, 27°C 처리구의 송이는 수확기까지 정상적으로 발달하지 못하였다(Fig. 1). 야간 24°C 처리구의 송이는 만개 후 100일을 기준으로 전체적으로 밝은 적색을 띠었고, 야간 27°C 처리구의 송이에는 녹색 및 적색을 띠는 과립이 섞여있었다.
시기별 과피 착색을 정량화하기 위해 색차값을 조사한 결과, 야간 21°C 처리구의 과피를 기준으로 L*과 b*값은 만개 후 40일부터 100일까지 지속적으로 감소하는 경향이었고(Fig. 2A, 2C), 반대로 a*값은 만개 후 40일부터 80일까지 증가하다가 이후 수확기까지 유지되는 경향이었다(Fig. 2B). 야간 21°C 처리구 과피의 L*값과 b*값이 만개 후 60일부터 다른 처리구에 비해 빠르게 감소하며 과피색의 변화와 동일한 경향을 나타내었고, 이러한 경향이 수확기까지 유지되었다(Fig. 1, Fig. 2A, 2C). 야간 21°C 처리구 과피의 a*값 역시 만개 후 60일부터 빠르게 증가하였고, 만개 후 100일을 기준으로 야간 27°C 처리구보다는 높지만, 야간 24°C 처리구와는 차이가 없었다(Fig. 2B). 야간 24°C 처리구 과피의 L*값과 b*값은 만개 후 80일부터 야간 27°C 처리구에 비해 감소하기 시작하였고, 이러한 경향이 수확기까지 유지되었다(Fig. 2A, 2C). 야간 24°C 처리구 과피의 a*값 역시 만개 후 80일을 기준으로 야간 27°C 처리구에 비해 증가하기 시작하였고 수확기까지 높게 유지되었다(Fig. 2B).
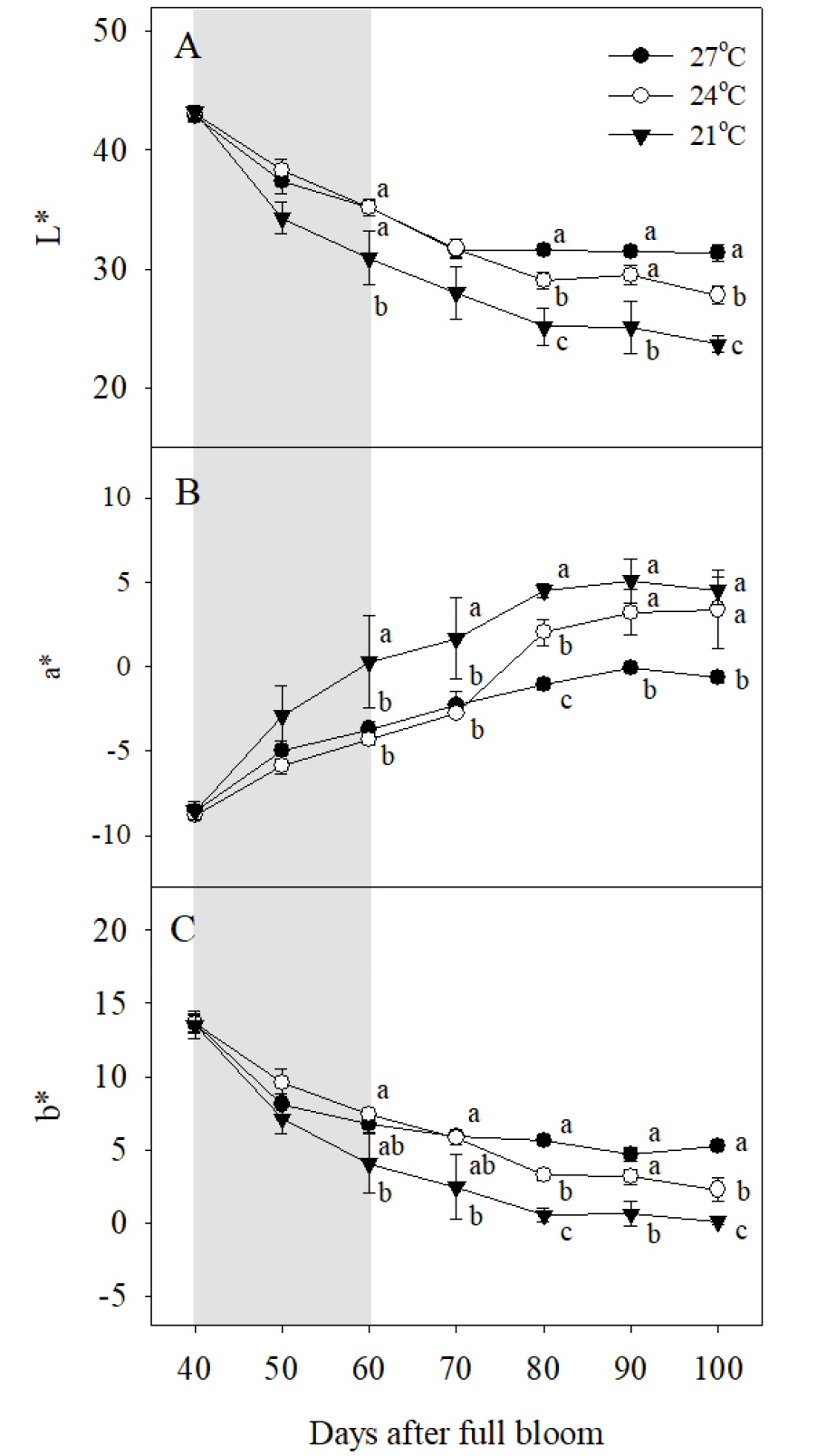
Fig. 2
Changes in (A) L*, (B) a*, and (C) b* values in berry skins during ripening in ‘Kyoho’ grapevines grown under different night temperature treatments. The grapevines were subjected to the same treatments as in Fig. 1. Values are means ± standard errors (n = 3), and different letters represent significant differences using LSD test at p < 0.05. Shaded areas represent the period of the night temperature treatments.
만개 후 100일에 칼라차트로 비교한 과피의 착색도는 야간 21°C 처리구가 7.9로 ‘거봉’ 고유의 정상적인 과피색을 나타내었고, 야간 24, 27°C 처리에 의해 각각 5.1, 3.8로 과피색이 불량하였다(Table 1). 과방중, 과립중, 당도는 야간 온도가 낮을수록 증가하였다. 과실의 산도는 야간 21°C 처리구가 야간 24, 27°C 처리구에 비해 낮았다.
Table 1.
Fruit quality at 100 days after full bloom of ‘Kyoho’ grape berries grown under different night temperature treatments.
| Treatment | Color chart |
Cluster weight (g) |
Berry weight (g) |
Soluble solids content (°Brix) |
Titratable acidity (%) |
| 27°C | 3.8 cz | 386.6 b | 10.2 c | 15.3 c | 0.7 a |
| 24°C | 5.1 b | 415.3 a | 11.4 b | 16.9 b | 0.7 a |
| 21°C | 7.9 a | 428.4 a | 12.4 a | 20.0 a | 0.6 b |
2. 안토시아닌 함량 변화
‘거봉’ 과피에서 Cya, Del, Peo, Pet, Mal 5종류의 안토시아닌이 검출되었고, Pel은 확인되지 않았다(Fig. 3). 수준별 야간 고온에 의해 과피의 총 안토시아닌 함량이 감소하였다. 야간 21°C 처리구 과피에서 만개 후 100일을 기준으로 Mal이 가장 높은 비율을 차지했으며(50.8%), Peo(20.3%), Del(15.0%), Pet(9.8%), Cya(4.2%) 순으로 많았다. 야간 21°C 처리구의 과피에서 만개 후 50일부터 총 안토시아닌이 증가하기 시작했고, 이후 만개 후 80일부터 수확기까지 비슷한 수준으로 유지되었다(Fig. 3). 하지만 Mal과 총 안토시아닌 함량은 만개 후 60일부터 수확기까지 지속적으로 증가하였다(Fig. 3E, 3F). 야간 27, 24°C 처리에 의해 수확기 총 안토시아닌 함량이 야간 21°C 처리구의 23.1, 48.1% 수준으로 각각 감소하였다(Fig. 3F). 안토시아닌의 종류별로 비교하면, 야간 27°C 처리에 의해 모든 종류의 안토시아닌이 야간 21°C 처리구에 비해 감소하였고, 야간 24°C 처리에 의해서는 Peo를 제외한 나머지 안토시아닌이 야간 21°C 처리구에 비해 감소하였다(Fig. 3C). 수확기의 총 안토시아닌 함량 및 Cya, Del, Mal은 야간 24°C 처리구와 27°C 처리구 간의 차이가 없었지만, Peo와 Pet은 야간 24°C 처리구의 과피에서 27°C 처리구에 비해 유의하게 높았다(Fig. 3C, 3D).
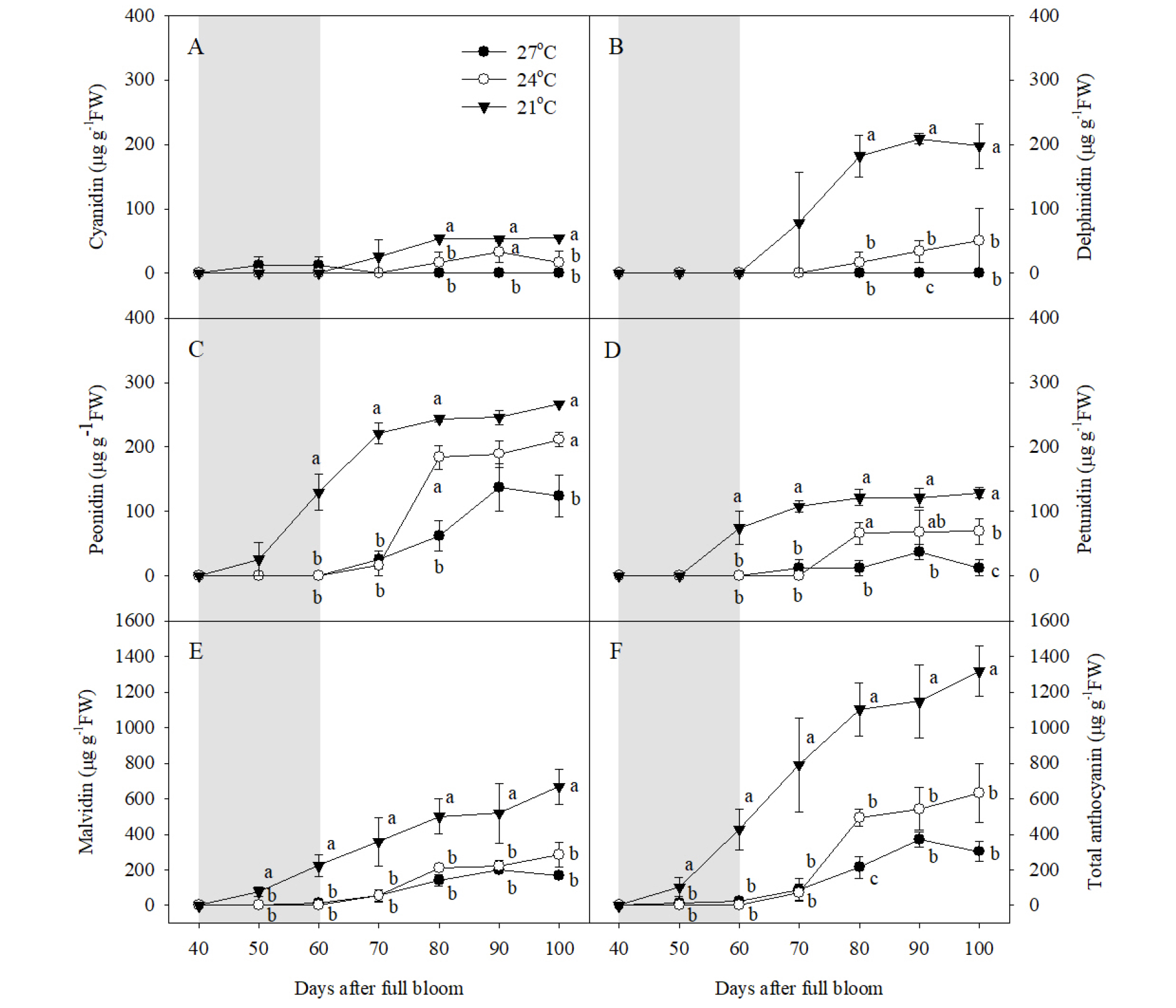
Fig. 3
Accumulation of (A) cyanidin, (B) delphinidin, (C) peonidin, (D) petunidin, (E) malvidin, and (F) total anthocyanin in berry skins during ripening in ‘Kyoho’ grapevines grown under different night temperature treatments. The grapevines were subjected to the same treatments as in Fig. 1. Values are means ± standard errors (n = 3), and different letters represent significant differences using LSD test at p < 0.05. Shaded areas represent the period of the temperature treatments.
3. ABA, GA 함량 변화
야간 고온에 의한 과피색 발현 영향을 평가하기 위해 과피 내 식물호르몬 ABA와 GA 함량을 분석하였다(Fig. 4). 야간 21°C 처리구의 과피를 기준으로 ABA는 만개 후 50일에 급격하게 증가하여 10일간 높은 함량으로 유지되다가 이후 수확기까지 지속적으로 감소하였다(Fig. 4A). 이러한 변색기의 급격한 ABA 함량의 증가는 야간 24, 27°C 처리에 의해 감소하는 경향을 보였다. GA 분석은 전체 활성형 GA 중에서 포도 과립에 가장 많이 존재하는 GA1의 함량을 분석하였다(Symons 등, 2006). GA는 만개 후 40일부터 60일까지 급격하게 감소하여 이후 수확기까지 낮게 유지되었으며, 야간 기온이 낮을수록 빠르게 감소하는 경향을 보였다(Fig. 4B). ABA/GA의 비율은 야간 21°C 처리구 과피에서 만개 후 60일까지 급격하게 증가한 뒤, 다시 수확기까지 감소하였다(Fig. 4C). 하지만 야간 24, 27°C 처리구의 과피에서는 ABA/GA 값이 만개 후 50일부터 70일까지 야간 21°C 처리구에 비해 낮게 유지되었으며, 야간 온도가 높을수록 더 큰 수준으로 감소하였다.
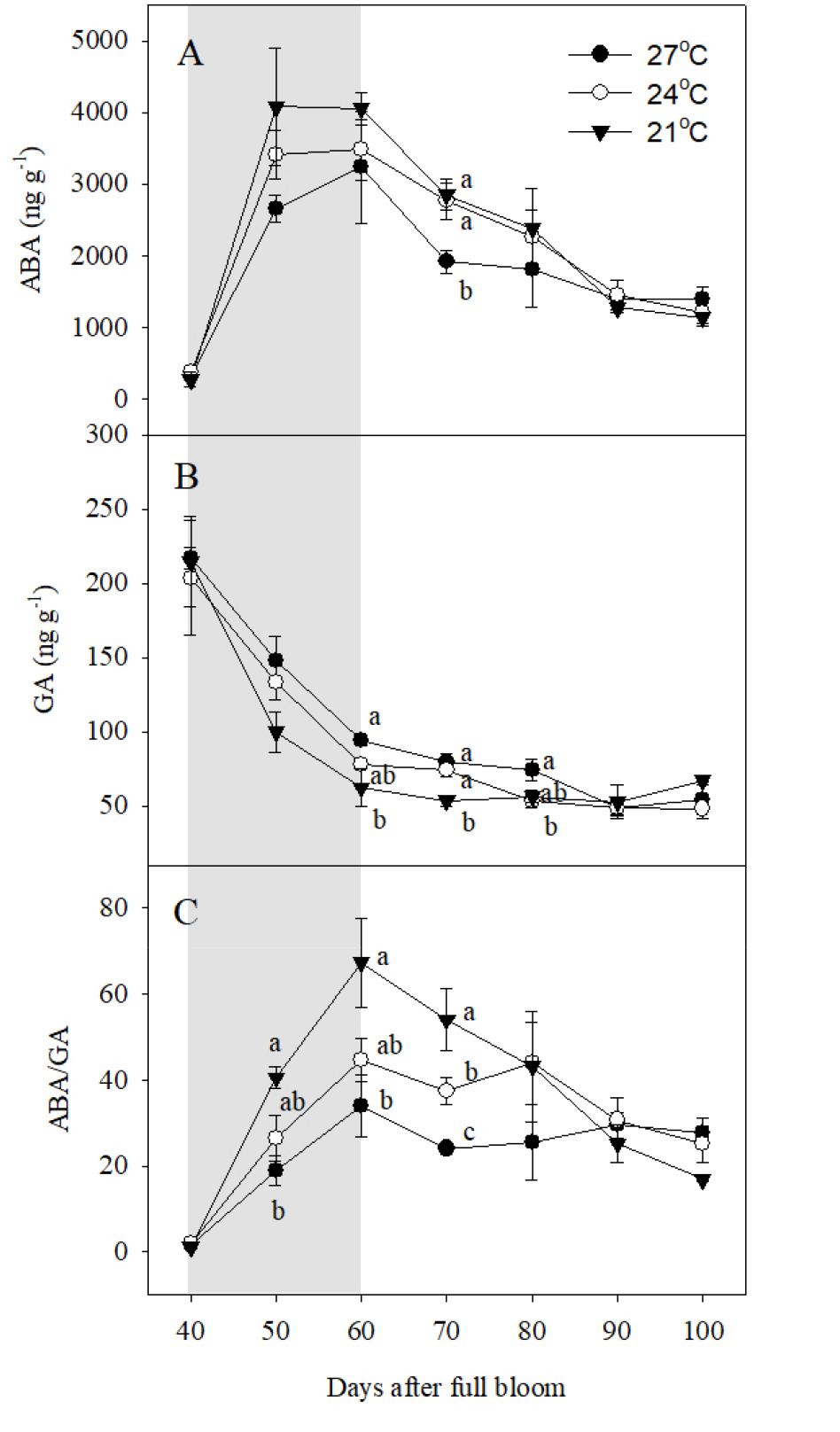
Fig. 4
Changes of (A) ABA and (B) GA contents, and (C) ABA/GA ratio in berry skins during ripening in ‘Kyoho’ grapevines grown under different night temperature treatments. The grapevines were subjected to the same treatments as in Fig. 1. Values are means ± standard errors (n = 3), and different letters represent significant differences using LSD test at p < 0.05. Shaded areas represent the period of the temperature treatments.
고 찰
1. 수준별 야간 고온에 의한 과피색 불량
변색기를 포함한 20일 동안의 야간 고온에 의해 ‘거봉’ 포도의 과피색 발현이 억제되었으며, 이는 과피의 안토시아닌 함량이 감소했기 때문이었다. 과피의 색차값 중 a*값은 최종적으로 야간 21, 24°C 처리구 간에 차이가 없었는데, 이는 ‘거봉’ 포도의 a*값이 성숙 초기에 붉은색으로 변하면서 증가하지만, 이후 성숙이 진행되면서 진한 자주색 혹은 청색 계열의 안토시아닌 함량이 높아지며 다시 감소하기 때문이다(Park 등, 2010). 야간 24°C 처리구의 과피는 21°C 처리구에 비해 총 안토시아닌이 불충분하게 축적되었으나 붉은색 계열의 Peo 함량에는 차이가 없었기 때문에 결과적으로 a*값에 차이가 없었던 것으로 판단된다.
포도의 과피색 불량을 유기하는 온도의 수준에 대해서는 ‘거봉’ 포도를 성숙기 주야간 27°C 이상의 온도에서 재배하는 경우 과피 안토시아닌 축적이 억제되었다고 보고되었으며(Mori 등, 2004; Shinomiya 등, 2015), ‘거봉’과 동일한 V. labruscana인 ‘Aki Queen’ 포도는 18-24°C 범위의 온도에서 안토시아닌 합성이 촉진된다고 알려져 있다(Yamane와 Shibayama, 2006). 본 연구에서 기존 문헌에 비해 더 낮은 24°C부터 과피색 발현이 억제된 이유는 야간 고온에 의해 과실의 당도가 감소했기 때문으로 판단된다. 기존의 연구에서 주야간 고온에 의해 포도의 과피색이 불량해지는 경우 과실의 당도가 증가하거나(Pastore 등, 2017; Shinomiya 등, 2015), 변화가 없었다(Koshita 등, 2015; Rienth 등, 2014; De Rosas 등, 2017). 따라서 야간의 고온은 과실로의 동화산물 축적을 억제하여(Mori 등, 2004) 당도를 감소시키기 때문에, 동일한 수준의 온도에서도 주야간 고온에 비해 과피색 발현이 더 억제된 것으로 판단되었다.
일반적으로 과피 안토시아닌 축적은 성숙기 야간 저온(15°C)에 의해 촉진되고, 야간 고온(30°C)에 의해 억제되지만(Mori 등, 2005b), 그 한계 온도에 대해서는 명확하게 밝혀지지 않았다. Kliewer와 Torres(1972)가 V. vinifera ‘Tokay’ 포도에 대해 동일한 주간 온도 조건에서 3수준 이상의 야간 온도를 처리하여 한계 온도를 탐색한 것이 유일한 결과로, 야간 15, 20°C에서는 과피색이 정상적으로 발현되었지만, 야간 30°C부터 발현이 억제되었다. ‘거봉’과 같은 V. labruscana는 ‘Cabernet Sauvignon’, ‘Merlot’, ‘Tokay’ 등의 V. vinifera에 비해 고온에 더 민감하게 반응하며 안토시아닌 축적이 감소하기 때문에(Mori 등, 2007b; Ryu 등, 2020; Tarara 등, 2008), 본 실험에서 더 낮은 온도인 야간 24°C에 의해 과피색 발현이 억제된 것으로 판단되었다.
2. 과피색 불량과 안토시아닌 조성
과피 내 안토시아닌 구성 비율은 Mal이 약 50%로 가장 많았고, 다음으로 Peo가 많아 기존의 Li 등(2013)과 Ryu 등(2018)의 결과와 일치하였다. 포도 과피의 안토시아닌은 기본 구조 flavilim 내 B-ring의 형태에 따라 고온 조건에서 서로 다른 축적 양상을 보인다. B-ring에 hydroxyl group이 2개 있는 di- hydroxylated 그룹(Cya, Peo)보다 3개 있는 tri-hydroxylated 그룹(Del, Pet, Mal)의 생합성이 고온에 의해 강하게 억제되며, 이는 flavonoid 3’5’-hydroxylase의 발현이 고온 조건에서 억제되기 때문이다(Mori 등, 2007a). 따라서, 붉은색 계열의 Peo는 야간 24°C 조건에서 비교적 적게 감소하였으며, 반대로 진한 자주색이나 푸른색을 띠는 Del, Pet, Mal 등의 축적이 크게 감소하였기 때문에 결과적으로 ‘거봉’ 고유의 진한 과피색으로 발달하지 못한 것으로 판단되었다. 야간 24°C 처리구의 과피색이 27°C 처리구에 비해 더 붉은색으로 착색이 이루어진 이유는 Mal 다음으로 많은 비율을 차지하는 Peo, Pet이 27°C 처리에 의해 더 크게 감소했기 때문으로 판단된다.
3. ABA, GA 함량과 과피색 변화
ABA는 포도 과피에서 변색기를 기준으로 가장 높게 증가했다가 감소하며(Wheeler 등, 2009), 포도, 블루베리, 체리 등의 호흡 비급등형 과실에서 성숙을 시작하는 신호전달 역할을 한다(Fortes 등, 2015; Jeong 등, 2004; Oh 등, 2018; Pilati 등, 2017; Shen 등, 2014). 성숙기 야간 고온은 과피 내 ABA 함량을 감소시키고(Koshita 등, 2007), 안토시아닌 생합성 유전자 발현 및 PAL, UFGT의 활성을 감소시켜 과피색 발현을 억제한다(Mori 등, 2005b). 본 연구에서도 야간 고온에 의해 ABA 함량이 감소하는 경향을 보였고, 이로 인해 최종적으로 안토시아닌 축적이 정상적으로 이루어지지 못했던 것으로 판단된다.
하지만 야간 21°C 처리구의 과피에서 만개 후 50일에 안토시아닌 축적이 시작된 것과 달리 ABA 함량은 처리구 간에 차이가 없었는데, 이는 안토시아닌 생합성을 위한 ABA의 신호 전달이 GA와 서로 길항적으로 조절되며(Alferez 등, 2021; Liu 등, 2016), GA가 당에 의한 안토시아닌 생합성을 억제하기 때문이다(Loreti 등, 2008). 사과, 포도 등의 과실에서 성숙기 과피 안토시아닌 축적은 GA 함량과 부의 상관관계를 나타내며(Li 등, 2018; Ryu 등, 2020), 실제 딸기 미숙 과실에 GA를 처리하면 PAL의 활성이 감소하면서 최종적으로 안토시아닌 축적이 억제된다(Martinez 등, 1996). 따라서, 변색기 야간 24, 27°C 처리에 의해 GA가 높게 유지되면서 만개 후 50일을 기준으로 ABA/GA의 비율이 감소하는 경향을 보였고, 이로 인해 안토시아닌 축적이 억제되었다고 판단되었다. 포도 성숙기 중 ABA의 신호 전달이 가장 활발하게 이루어지는 변색기의 ABA/GA 비율이 특정 수준에 도달하는지에 따라 향후 과피색 예측이 가능할 것으로 전망되며, 이는 고온 환경에서 과피색 증진을 위한 연구의 기초 자료로 활용될 수 있을 것으로 판단된다.
변색기 20일 동안의 야간 24, 27°C 온도에 의해 ‘거봉’ 포도의 과피색 발현이 억제되었고, 이는 안토시아닌 함량이 감소하고 조성이 달라졌기 때문이었다. 야간 고온에 의한 과피 내 ABA, GA 함량 변화 및 당도의 감소가 안토시아닌 축적을 억제했을 것으로 판단되었다. 따라서, 본 연구에서는 야간의 수준별 고온에 의한 과피색 발현의 영향을 분석하였고, 향후 과원 현장에서 열대야 발생에 대한 영향 평가 시 주간 및 야간 고온의 영향을 해석하는 기준으로 활용될 수 있을 것으로 판단된다. 여름철 이상 고온으로 인한 포도의 과피색 불량을 예측하기 위해서는 안토시아닌 축적을 억제하는 온도의 수준 및 노출기간에 따른 영향 평가 등의 후속 연구가 필요하다.





