서 론
재료 및 방법
1. 실험재료
2. 식물재배 및 재배환경
3. 생육조사 항목 및 측정방법
4. 수량 및 과실특성 조사방법
5. OJIP 측정 방법 및 지수
6. 통계분석
결과 및 고찰
서 론
우리나라의 토마토 전체 재배면적은 2020년 기준 5,521ha이고 이 중 582ha가 토마토 수경재배 면적으로(KOSIS, 2022) 나머지 4,939ha는 토경재배 면적으로 추정할 수 있다. 국내 토마토 수경재배 면적은 갈수록 증가 추세를 보이고 있으나(RDA, 2018) 토마토 전체 재배면적 중 대부분은 토경재배가 차지하고 있는 실정이다. 하지만 국내 토경재배 시설은 노후화되어 있는 경우가 많아 겨울철 저온과 같은 환경 스트레스를 받기 쉽다.
토마토는 아열대성 작물로 생육적온이 18-27℃이며(Ntatsi 등, 2017), 15℃ 이하가 되면 생육부진이 일어나고 10℃ 이하가 되면 생육이 정지한다(RDA, 2018). 저온은 토마토의 생육을 약화시켜 과실 총 수량이 감소하게 된다(Yang 등, 2021). 저온에 의해 지온이 낮아지면 지하부와 지상부 간의 식물 호르몬 신호전달경로에 이상이 생기고(Ntatsi 등, 2017), 뿌리 생육과 양수분 흡수율은 감소되어 작물의 세력 저하가 일어나기 때문에 저온기 근권부의 활력은 중요하다(Bristow 등, 2021). 이러한 낮은 지온 조건에서 대목은 저온에 저항성을 가져 양수분 흡수율이 높으며 이에 따라 접수의 저온 피해가 저감되고 생산량이 유지된다(Gálvez 등, 2021). 저온과 같은 비생물적 스트레스 이외에도 토경재배 시설의 토마토는 연작으로 인한 염류장해와 풋마름병과 같은 토양전염성 병원균의 피해를 입기 쉽다. 특히 토양전염성 병원균은 수년간 토양 내에서 생존 가능하기 때문에 생물학적 또는 화학적인 방제가 어려워 토마토 대목을 사용한 접목묘를 재배하는 것이 최선의 방법이다. 그리하여 생물적·비생물적 스트레스에 저항성을 가지며 육묘과정에 소요되는 종자값 등의 초기 투자 비용을 줄이기 위해 저렴한 가격으로 보급 가능한 국산 대목 품종의 개발이 필요하다.
대목의 뿌리는 양수분 흡수율이 높아 식물호르몬의 생성이 원활하여 병저항성이 높아지고 수량이 증가하는 효과가 있다(Latifah 등, 2021). 이러한 토마토 접목묘의 수량은 실생묘보다 높다고 알려져 있으나 대목과 접수 간의 접목 조합이 좋아야 양질의 토마토를 얻을 수 있다(Sharma 등, 2019). 접목 친화성이 높으면 뿌리와 잎의 형태학적 모양 발달과 식물호르몬의 생성 등의 복합적인 작물 성능이 높아지고, 저온 조건에서도 항산화효소의 활성이 높아 산화 스트레스를 일으키는 활성산소종이 제거되는 효과를 가진다(Schwarz 등, 2010; Ntatsi 등, 2017). 접목 친화성은 대목 선정에 있어서 중요한 요인이고(Leonardi와 Giuffrida, 2006), 토마토 대목 종류에 따라 접수의 생육과 수량이 달라지므로(Lee와 Oda, 2002) 여러 접목 조합의 생육과 수량을 비교 분석해보는 실험이 필요하다.
광합성 효율 분석은 각종 환경 스트레스 실험에 많이 사용되는데 그 이유는 광합성 기구가 환경 제약을 받아 민감하게 반응하기 때문이다(Kalaji 등, 2016). 저온장해를 받은 토마토는 전자전달능력과 루비스코 활성 및 탄소동화량이 감소하고, 세포막을 보호하기 위해 엽 내 자당과 전분의 농도가 증가하여 광합성이 저해된다(Suchoff 등, 2018). 이러한 저온에 따른 광합성 효율의 변화는 엽록소형광을 측정하여 객관적인 수치를 통해 분석할 수 있다. 엽록소형광 분석법은 생물적·비생물적 스트레스가 광합성에 미치는 영향을 대량으로 빠르게 비파괴적인 방법으로 분석할 수 있어 식물생장 연구에 다수 활용되고 있다(Oh와 Koh, 2005). 엽록소형광 기법에는 Kautsky effect, Quenching, JIP test 등이 있는데 이 중 JIP test(chlorophyll fluorescence induction curve)는 생육상태와 환경조건에 따라 달라지는 광계Ⅱ의 활성상태를 조사하는데 적합하다(Kalaji 등, 2011). JIP test는 엽록소형광 유발시점(Origin) 이후 최소 형광변동 지점(Jump)을 지나 형광 중간수준(Intermediate)에서 최대 형광유도량(Peak)을 나타내는 기법으로 OJIP(Origin Jump Intermediate Peak)라고 부른다(Govindjee, 1995; Yoo 등, 2013). OJIP를 측정하면 OJIP 유도곡선 그래프와 OJIP 단계별로 측정된 각종 엽록소형광 지수를 얻을 수 있는데, 엽록소형광 지수는 단독으로 측정되는 것보다 OJIP를 통해 얻어진 값이 광계Ⅱ의 활성상태를 더 정확하게 설명한다(Force 등, 2003; Živčák 등, 2008). OJIP를 통해 얻어진 엽록소형광 지수는 광계Ⅱ 전자전달의 흐름에 따라 정량화된 값이며(Baghbani 등, 2019), F0, FM, FV/FM, PIABS, ET0/RC, ABS/RC, TR0/RC 및 DI0/RC 등이 있다. OJIP 측정을 통해 대목 종류에 따른 광합성 효율을 분석하여 저온 내성을 가지는 접목 조합의 평가가 가능할 것으로 판단된다. 따라서 본 연구는 저온기 토경재배에서의 토마토 대목의 종류에 따라 나타나는 생육, 수량 및 광합성 효율의 차이를 비교 분석하고자 수행하였다.
재료 및 방법
1. 실험재료
본 실험에 사용한 대목은 품종 2종류와 계통 2종류로, 품종 2종류는 ‘Powerguard’(National Institute of Horticultural and Herbal Science, Korea)와 ‘B-blocking’(Takii, Japan)을 사용하였고 계통 2종류로 ‘IT173773’(National Institute of Horticultural and Herbal Science, Korea)과 ‘20LM’(Bunongseed, Korea)을 사용하였다. 토마토(Solanum lycopersicum L.) 접수 품종 1종류 ‘Red250’(Namnong, Korea)을 사용하여 접목 처리구 4개와 비접목 처리구 1개를 실험에 사용하였다. 접목할 대목과 접수 종자는 2020년 9월 3일에 파종하여 25일 후인 9월 26일에 합접법을 이용하여 접목하였다. 접목 직후 온도 26℃ 및 습도 80% 이상을 유지한 접목 활착실에 6일간 두었다. 실생묘는 접목묘와 같은 식물체 크기로 정식하기 위해 일주일 후인 9월 10일에 파종하였다.
2. 식물재배 및 재배환경
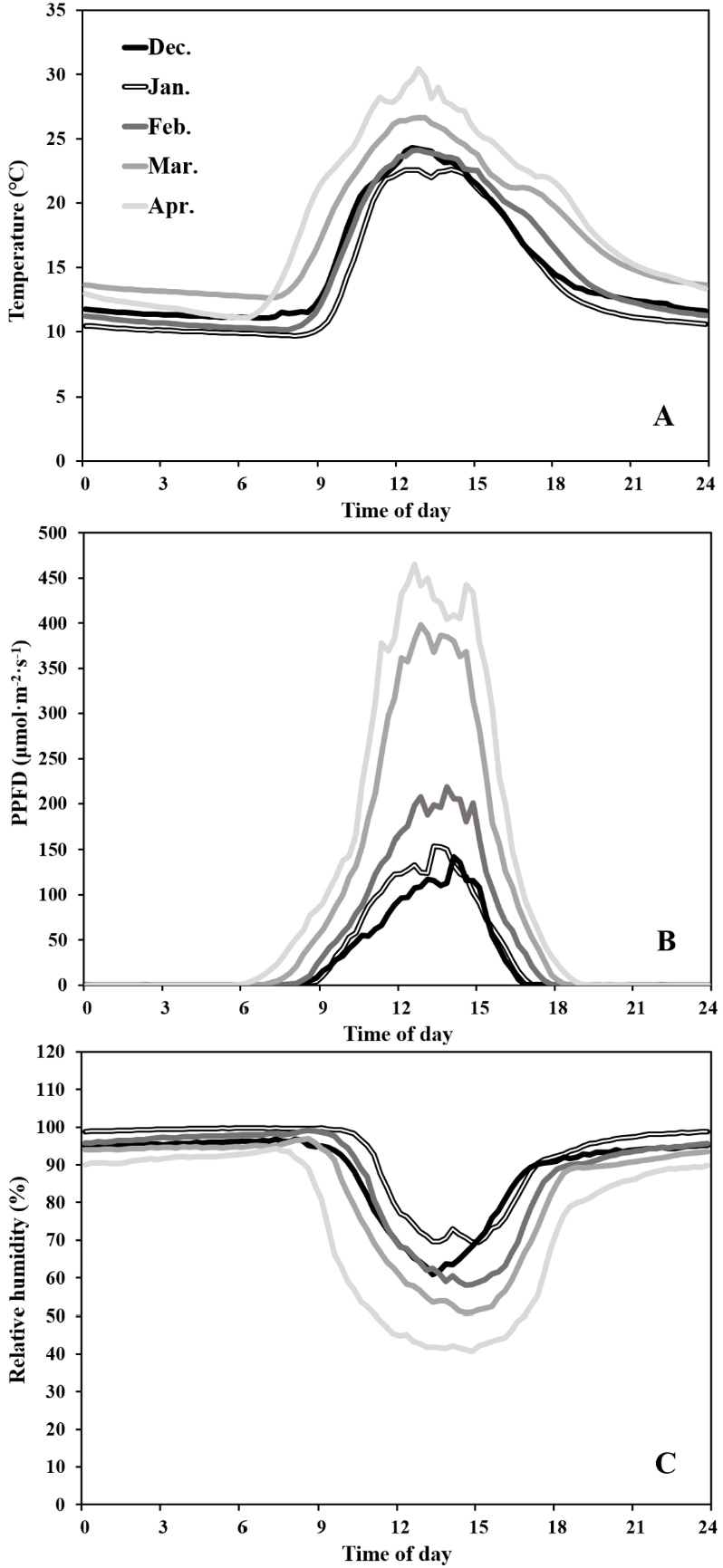
본 실험은 토경재배 연동형 비닐하우스(폭 7m, 길이 72m, 동고 5.5m; 전북 정읍 소재)에서 수행하였다. 2020년 10월 20일에 접목 처리구 4개와 비접목 처리구 1개를 난괴법 3반복으로 15주씩 재식거리 35cm × 60cm로 하여 정식하였다. 생육 초기인 10월과 11월에는 N-P-K:30-10-10의 액비를 1주일에 1회 관수하고 생육 중기인 12월과 1월에는 N-P-K:19-19-19의 액비를 2주일에 1회 관수하며 수확기인 2월, 3월 및 4월에는 N-P-K:10-10-30의 액비를 1주일에 1회 관수하였다. 식물체 관리는 정식 후 측지를 주기적으로 제거하고 화방 내 과실은 3개씩 적과하였으며 정식 후 100일에 5단에서 적심하였다. 온실 내부 온도, 광량 및 상대습도는 HOBO data logger(MX1104, Onset, USA)를 이용하여 수집하였다. 환경데이터 수집은 정식 후 43일(2020년 12월 1일)에 시작하여 정식 후 184일(2021년 4월 21일)까지 측정하였으며, 측정값은 월평균으로 계산하여 시간대 그래프로 나타내었다(Fig. 1). 광량은 lux 단위로 측정된 값을 환산계수 54로 나누어 PPFD(μmol·m-2·s-1) 단위로 나타내었다(Thimijan과 Heins, 1983).
3. 생육조사 항목 및 측정방법
토마토의 생육특성은 경경, 개화위치, 엽장 및 엽폭을 조사하였으며 적심 전 2020년 12월 17일(정식 후 59일)부터 2021년 1월 14일(정식 후 87일)까지 5주 동안 수행하였다. 경경은 유인줄에 조사 7일 전 생장점이 있던 위치를 표시하여 그 표시점에 위치해 있는 줄기직경을 측정하였으며 측정 부위가 마디에 있다면 마디 바로 아랫부분을 측정하였다(Kim 등, 2010). 개화위치는 꽃이 한 개라도 만개한 최상위 화방과 생장점 사이 기부 거리를 측정하였다. 엽장과 엽폭은 그 최상위 화방의 하부엽 전체 세로와 가로 길이를 측정하였다.
4. 수량 및 과실특성 조사방법
토마토 수량은 정식 후 137일(2021년 3월 12일)부터 정식 후 172일(4월 9일)까지 1주일 간격으로 처리당 15주를 조사하였다. 수확한 토마토는 개체별로 평균 과중, 개수, 과경 및 과폭을 측정하였다. 과중은 전자저울(KS-308, DRETEC, Japan)로 조사하였으며 과경 및 과폭은 디지털 버니어 캘리퍼스 300mm(IP67, FUTURO, Switzerland)를 이용하여 처리별로 과실 5개를 1회씩 조사하였다.
5. OJIP 측정 방법 및 지수
OJIP는 정식 후 80일과 172일에 엽록소형광 측정기(Fluorpen FP-110, Photon Systems Instruments, Czech Republic)를 이용하여 개화한 최상위 화방의 하부엽의 정단엽을 대상으로 측정하였다. 잎은 Leaf clip을 사용하여 1시간 암처리 후 처리별로 7개체를 1회씩 측정하였다. FluorPen(Photon Systems Instruments, 1.1.0.3 Version, Czech Republic) 프로그램을 통해 산출된 OJIP 지수 F0, FM, FV/FM, PIABS, ET0/RC, ABS/RC, TR0/RC 및 DI0/RC 등을 사용하였고 각 지수를 표에 정의하였다(Table 1).
Table 1.
Definitions of parameters obtained from the recorded chlorophyll fluorescence OJIP (Origin Jump Intermediate Peak) transients.
6. 통계분석
통계분석은 R 프로그램을 이용하여 평균 간 비교를 Duncan’s multiple range test(DMRT) 검정을 통해 95% 신뢰수준에서 차이를 확인하였다. OJIP 지수와 생육조사항목 간의 상관관계는 피어슨 상관계수(Pearson correlation coefficient)로 조사하였다(Healey, 1993).
결과 및 고찰
본 토경재배 온실 내부의 월평균 온도는 2020년 12월부터 2021년 2월까지 15℃ 이하였으며 특히 1월의 온도는 13.7℃로 낮았다(Fig. 1A). 12·1·2월 대비 3·4월에 광량은 152% 증가하였으며 이에 따라 온도도 상승하였다(Fig. 1B). 토마토 주당 총 수량은 접목 처리구 ‘Powerguard’가 1,615g으로 가장 많았고 ‘B-blocking’(1,527g), ‘20LM’(1,520g), ‘IT173773’ (1,429g) 순이었으며 비접목 처리구는 1,299g으로 가장 적었다(Fig. 2). 비접목 처리구는 수확 초기에 일부 접목 처리구보다 많은 수량을 보이다가 정식 후 151일(3화방)을 기점으로 수량이 감소하여 총 수량이 가장 적었다. 정식 후 165일 대비 172일의 접목 처리구의 수량은 32-42%의 증가율을 보였으나 비접목 처리구는 12%의 증가율을 보였다. 정식 후 172일에 ‘20LM’은 334g의 가장 많은 주당 수량을 가져 총 수량이 상업용 대목 품종인 ‘B-blocking’과 근접하게 기록되었다. ‘Powerguard’는 전체 수량 조사 기간에서 매주 가장 많은 누적 수량을 보였으며, 상업용 대목 품종인 ‘B-blocking’보다 주당 총 수량이 88g 많아 수량성이 높은 것으로 판단된다. ‘Powerguard’의 평균 과중은 106.2g으로 가장 높았고 비접목 처리구는 91.6g으로 가장 낮았다(Table 2). 정식 후 165일에 비접목 처리구의 과경과 과폭은 44.4mm와 59.9mm로 낮았다. 모든 화방을 동일한 개수로 적과하였기 때문에 처리 간 수량이 다른 이유는 과중의 차이인 것으로 판단된다. 토마토 대목의 뿌리는 양수분 흡수율이 높아 작물 세력을 생육 후기까지 유지하여 생산성을 높이는 효과가 있다(Latifah 등, 2021). 대목의 이러한 성능은 접수의 생장과 발달을 향상시켜(Schwarz 등, 2010) 본 실험에서 비접목 처리구보다 접목 처리구의 수량성이 높았던 것으로 판단된다. 접목 처리구 중 ‘Powerguard’의 수량이 가장 많아 ‘Powergaurd’는 다른 대목에 비해 뿌리활력이 강해 수확 후기까지 세력을 유지하여 많은 수량을 얻은 것으로 판단된다.
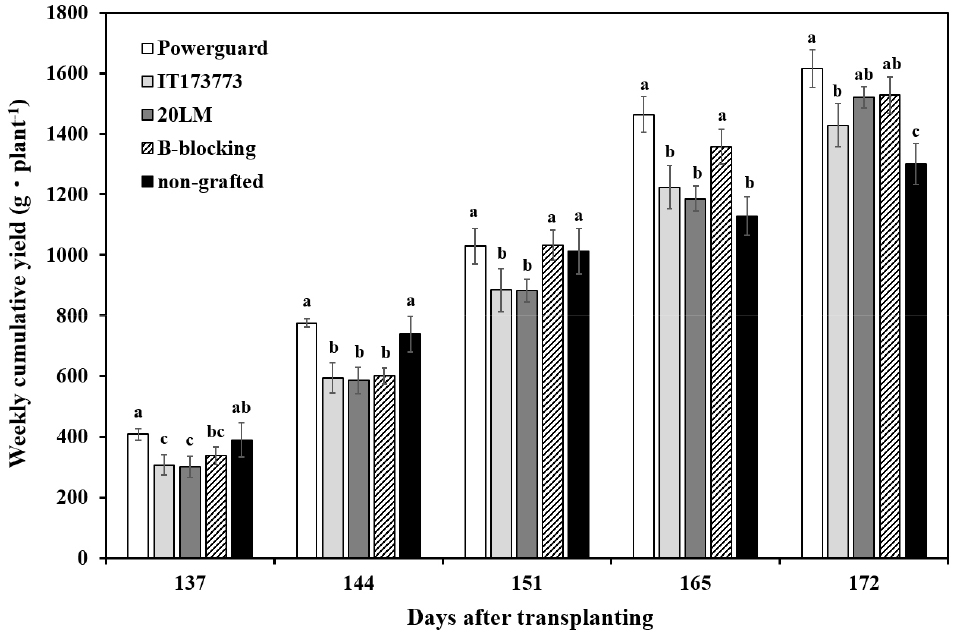
Fig. 2.
Weekly cumulative fruit yield of non-grafted and grafted tomatoes. Four tomato cultivars, ‘Powerguard’, ‘IT173773’, ‘20LM’, and ‘B-blocking’, were used as rootstocks in soil cultivation. Different letters above bars indicate significant differences by Duncan’s multiple range test at p ≤ 0.05.
Table 2.
Average fruit weight, the number of fruits per cluster, fruit length, and fruit diameter of non-grafted and grafted tomatoes at 165 days after transplanting in soil cultivation.
| Graft combination |
Fruit weight (g) |
No. of fruits per cluster |
Fruit length (mm) |
Fruit diameter (mm) | |
| Scion | Rootstock | ||||
| Red250 | Powerguard | 106.2 az | 3.0 a | 58.8 a | 72.9 a |
| Red250 | IT173773 | 99.3 abc | 2.9 a | 56.0 a | 69.2 ab |
| Red250 | 20LM | 103.4 ab | 2.9 a | 53.4 a | 68.9 ab |
| Red250 | B-blocking | 93.9 bc | 3.3 a | 52.1 a | 64.3 ab |
| Red250 | -y | 91.6 c | 2.8 a | 44.4 b | 59.9 b |
경경을 측정하면 작물의 힘이 강한지 약한지의 세력을 판단할 수 있다. 일반적으로 경경이 12mm보다 굵으면 세력이 강한 것이고 11mm보다 가늘면 세력이 약한 것으로 판단할 수 있다(Stradiot과 Battistel, 2003). 본 실험에서 정식 후 80일을 제외하고 모든 처리구의 경경은 12mm 이상으로 생육 초기에 강한 세력을 보였다(Table 3). 정식 후 80일에 비접목 처리구의 경경은 10.1mm로 접목 처리구에 비해 15% 낮았다. 정식 후 80일에 모든 처리구의 경경은 10-12mm로 정식 후 73일에 13-15mm의 값을 보인 것에 비해 상대적으로 얇은 경경을 보였다. 정식 후 80일에 급격히 경경 값이 감소한 이유는 일평균 온실 내부 온도가 9-14℃의 저온에 14일간 노출되었기 때문이다. 일평균 온실 내부 온도는 정식 후 64일에 10.3℃까지 떨어졌으며 정식 후 79일은 9.7℃까지 내려갔다(Fig. 1A). 토마토는 온실 내부 온도가 15℃ 이하가 되면 생육부진이 일어나고 10℃ 이하가 되면 생육이 정지한다(RDA, 2018). 그러나 저온으로 지온이 낮아도 토마토 접목묘는 실생묘에 비해 지상부와 지하부 간의 동화산물의 전류량과 뿌리 생장을 유지한다(Suchoff 등, 2018). 정식 후 80일에 모든 처리구의 경경이 급격히 감소한 이유는 저온에 장기간 노출되어 영양생장이 둔화되었기(Ploeg와 Heuvelink, 2005) 때문이며 저온 스트레스를 받았음에도 접목 처리구의 경경이 비접목 처리구에 비해 두꺼운 이유는 대목이 저온에 대해 저항성을 가져 생장이 유지되었기 때문으로 판단된다.
Table 3.
Changes in the stem diameter (mm) of non-grafted and grafted tomatoes grown in soil cultivation.
| Graft combination | Stem diameterz (mm) | |||||
| Scion | Rootstock | 66y | 73 | 80 | 87 | |
| Red250 | Powerguard | 13.5 ax | 15.5 a | 11.2 ab | 14.4 ab | |
| Red250 | IT173773 | 14.5 a | 14.7 a | 12.3 a | 15.4 a | |
| Red250 | 20LM | 14.3 a | 15.3 a | 11.1 ab | 14.4 ab | |
| Red250 | B-blocking | 14.3 a | 15.3 a | 12.0 a | 15.9 a | |
| Red250 | -w | 12.5 a | 13.9 a | 10.1 b | 13.3 b | |
zStem diameter was expressed as the average diameter of the stem. The stem diameter was measured at the place where the growing tip was at 7 days before measurements were taken.
개화위치를 측정하면 영양생장과 생식생장의 균형을 판단할 수 있다. 일반적으로 개화위치가 15cm보다 짧으면 생식생장상으로, 20cm보다 길면 영양생장상으로의 진행으로 판단할 수 있다(Stradiot과 Battistel, 2003). 본 실험에서 모든 처리구의 개화위치는 20cm 이상으로 영양생장상을 보였고, 그 중 ‘Powerguard’의 개화위치 값은 정식 후 66일에 41.5cm로 다른 대목을 사용한 처리구에 비해 11%, 비접목 처리구에 비해서는 35% 더 강한 영양생장상을 보였다(Table 4). ‘Powerguard’가 많은 수량을 보인 이유는 생육 초기에 영양생장이 활발해 그 세력이 생육 후기까지 이어졌기 때문으로 판단된다. 이는 대목을 사용하면 생육 초기 생장률이 증가한다는 보고와 일치한다(Suchoff 등, 2018). 대목과 접수의 접목 조합에 따라 토마토의 생육과 수량은 다르게 나타난다(Soe et al., 2018). 동일한 대목 ‘Powerguard’를 방울토마토 품종 ‘Nonari’와 접목하여 수경재배에서 재배한 결과는 생육 후기의 생육이 부진하고 총 수량이 낮은 반면(Lee et al., 2021), 완숙토마토 품종 ‘Gama’와 접목한 결과는 그 생육과 수량이 가장 우수하였다(Lee et al., 2020). 접목 친화성이 높으면 뿌리와 잎의 형태학적 모양 발달과 식물호르몬의 생성 등의 복합적인 작물 성능이 높아진다(Schwarz 등, 2010; Ntatsi 등, 2017). 본 실험에 사용한 대목 중 ‘Powerguard’는 ‘Red250’과 ‘Gama’ 등의 완숙토마토 접수 품종과 접목 친화성이 높아 생육이 발달하고 수량성이 높은 것으로 판단된다.
Table 4.
Changes in the flowering position (cm) of non-grafted and grafted tomatoes grown in soil cultivation.
| Graft combination | Flowering positionz (cm) | ||||||
| Scion | Rootstock | 59y | 66 | 73 | 80 | 87 | |
| Red250 | Powerguard | 28.8 ax | 41.5 a | 37.5 a | 30.6 a | 28.5 ab | |
| Red250 | IT173773 | 22.7 b | 37.9 a | 27.1 b | 37.4 a | 34.2 a | |
| Red250 | 20LM | 22.1 b | 35.5 a | 27.4 b | 30.9 a | 32.8 a | |
| Red250 | B-blocking | 24.7 ab | 37.8 a | 27.7 b | 30.6 a | 32.1 a | |
| Red250 | -w | 25.0 ab | 27.1 b | 37.1 a | 24.3 a | 24.7 b | |
정식 후 80일에 비접목 처리구의 엽장과 엽폭은 42.4cm와 41.8cm로 낮은 값을 보인 반면, 정식 후 87일에 “B-blocking’의 엽장과 엽폭은 48.2cm와 52.5cm로 높은 값을 보였다(Table 5). 정식 후 80일에 조사한 비접목 처리구의 엽 크기가 감소한 이유는 저온의 영향인 것으로 보인다. 생장의 주된 요인은 광과 CO2로(Stanghellini 등, 2019) 온실 내부 온도와 더불어 광량도 낮아(Fig. 1B) 생장이 둔화되어 엽장과 엽폭이 감소한 것으로 판단된다. 토마토 재배에 적합한 상대습도는 65-80%로(RDA, 2018) 다습조건에서는 증산량이 감소하여 생육이 저하되고 꽃가루의 비산이 나빠지는데(Harel 등, 2014) 정식 후 80일의 주간 평균 상대습도는 96%로 거의 포화상태에 이르러 칼슘 흡수력 등이 감소하여 생육에 영향을 미쳤을 것으로 판단된다. 본 실험을 수행한 포장은 실험 대목이 저온에 내성을 갖는지 평가하는데 적합한 환경조건으로 모든 처리구가 저온에 일정기간 노출되어 저온 스트레스를 받았고 비접목 처리구는 접목 처리구에 비해 저온에 내성이 없어 더 낮은 생육과 수량을 보인 것으로 판단된다. 접목 처리구 중 ‘Powerguard’와 ‘B-blocking’은 생육 초기 개화위치와 엽장 및 엽폭 등의 값이 높은 것으로 보아 생장이 활발하였고 생육 후기까지 세력을 유지하여 수량이 높았던 것으로 판단된다.
Table 5.
Changes in the leaf length and width (cm) of non-grafted and grafted tomatoes grown in soil cultivation.
| Graft combination | Leaf length and width (cm) | |||||||||||||||
| 59z | 66 | 73 | 80 | 87 | ||||||||||||
| Scion | Rootstock |
Leaf length |
Leaf width |
Leaf length |
Leaf width |
Leaf length |
Leaf width |
Leaf length |
Leaf width |
Leaf length |
Leaf width | |||||
| Red250 | Powerguard | 45.4 ay | 34.2 b | 45.8 a | 48.7 ab | 45.8 a | 49.0 a | 45.6 a | 55.2 a | 45.6 ab | 40.8 bc | |||||
| Red250 | IT173773 | 44.3 a | 34.7 b | 45.8 a | 44.6 ab | 46.3 a | 49.3 a | 47.0 a | 51.2 a | 44.3 ab | 45.8 ab | |||||
| Red250 | 20LM | 45.9 a | 36.2 ab | 46.4 a | 46.8 ab | 47.2 a | 50.7 a | 48.2 a | 49.0 ab | 43.3 b | 44.2 ab | |||||
| Red250 | B-blocking | 47.8 a | 41.3 ab | 47.3 a | 42.3 b | 49.0 a | 51.2 a | 48.2 a | 52.7 a | 48.2 a | 52.5 a | |||||
| Red250 | -x | 48.2 a | 43.5 a | 47.8 a | 50.8 a | 48.2 a | 56.3 a | 42.4 b | 41.8 b | 41.4 b | 35.6 c | |||||
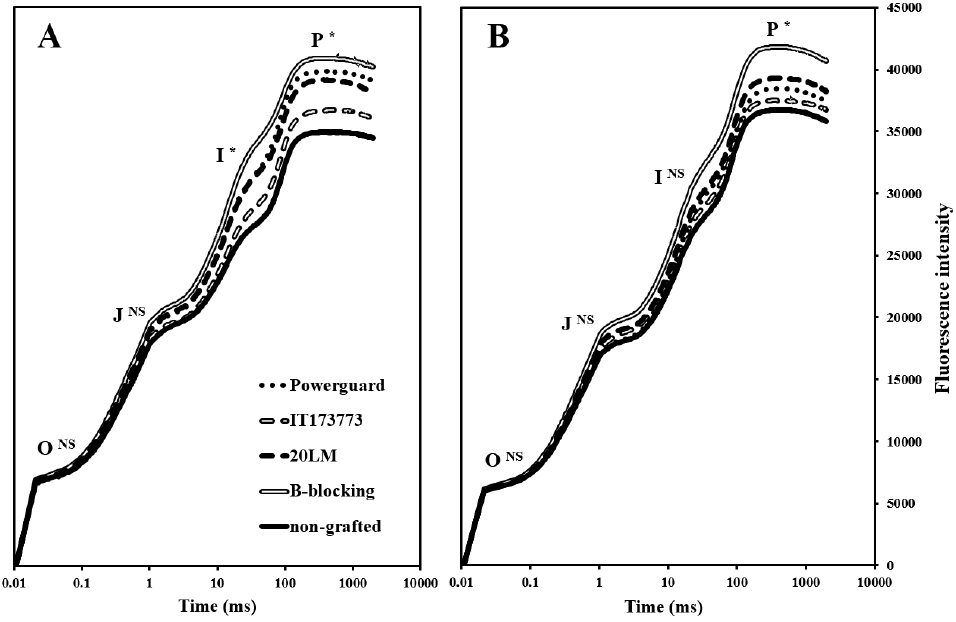
정식 후 80일에 OJIP의 P구간에서 ‘B-blocking’의 값이 40,725로 높고 비접목 처리구의 값이 34,754로 낮았다(Fig. 3A). P구간의 값은 엽록소형광 지수 FM과 동일한 값으로, 스트레스를 받은 식물은 광계Ⅱ 활성이 저하되어 FM이 감소한다(Bussotti 등, 2011). 저온에 의해 파괴된 세포막의 안정성과 기능을 보호하기 위해 수용성 당을 증가시켜 저온 저항성을 갖게 만들지만, 수용성 당의 축적은 광저해를 일으켜 결과적으로 광화학적 손상이 일어난다(Lee 등, 2016). 정식 후 80일에 비접목 처리구의 경경 값은 낮았는데(Table 3), 이는 저온에 의해 광합성 효율이 감소되고 생장이 지연 및 둔화된 것으로 판단된다. 정식 후 87일에 ‘B-blocking’의 엽장과 엽폭이 가장 커 광합성 활성이 높았고 이에 따라 최대 형광값인 FM 값이 높은 것으로 판단된다.
정식 후 80일에 ‘Powerguard’의 광계Ⅱ 최대 광화학적 효율인 FV/FM은 0.83으로 높고 비접목 처리구는 0.80으로 낮았다(Table 6). 정식 후 80일에 PIABS는 ‘Powerguard’가 3.73으로 높고 비접목 처리구가 2.62로 낮았다. 정식 후 172일의 PIABS는 정식 후 80일보다 모든 처리구의 값이 컸다. PIABS는 광계Ⅱ의 광에너지 흡수 능력, 전자전달효율 및 전자고정효율의 세 가지 광합성 활성 정도를 통합적으로 나타낸 지수이다(Thach 등, 2007). PIABS는 엽록소형광 지수 중 스트레스에 가장 민감하여(Živčák 등, 2008) 저온 스트레스를 받은 정식 후 80일의 값이 정식 후 172일의 값보다 낮은 것으로 판단된다. 정식 후 80일에 ‘B-blocking’의 ET0/RC는 0.99로 높았고 비접목 처리구는 0.90으로 낮았다. 정식 후 172일에 ET0/RC는 ‘Powerguard’가 0.99로 가장 높았다. ET0/RC는 광계Ⅱ의 전자전달효율을 나타내는 지수로 스트레스를 받으면 값이 감소한다(Yoo 등, 2013). ABS/RC와 TR0/RC는 처리구 간 유의적 차이는 없었지만 모든 처리구의 정식 후 80일의 값이 정식 후 172일의 값보다 높았다. ABS/RC는 광계Ⅱ 반응중심의 활성화 정도를 나타내는 지수이고 TR0/RC는 흡수된 광자의 고정효율을 뜻하며 스트레스를 받으면 두 지수는 증가하는데(Ajigboye 등, 2016), 이는 전자전달을 할 수 없는 QA와 PQ가 반응중심에 축적되기 때문이다(Thach et al., 2007). 정식 후 80일은 저온에 의해 광계Ⅱ 반응중심의 활성화 정도가 낮아 ABS/RC와 TR0/RC 값이 높게 산출된 것으로 판단된다. 정식 후 80일에 DI0/RC는 ‘IT173773’과 비접목 처리구가 각각 0.39와 0.41로 높았으며 정식 후 172일은 비접목 처리구가 0.32로 높았다. DI0/RC는 흡수된 빛에너지가 광합성에 사용되지 못하고 열로 소실됨을 뜻하는 지수이다(Thwe와 Kasemsap, 2014). 전자전달의 감소로 에너지를 사용하지 못해 작물 자체의 보호기작을 발동시키는 것으로, DI0/RC의 증가는 열로 소실되는 에너지가 많음을 의미한다(Baghbani 등, 2019). 접목 처리구 중 저온기인 정식 후 80일에 ‘IT173773’의 DI0/RC는 비접목 처리구와 같이 값이 높아 저온 내성 대목으로써의 성능이 낮은 것으로 판단된다. 접목묘는 실생묘에 비해 엽면적과 탄소동화율, 그리고 FV/FM이 증가하고(Suchoff 등, 2018), 저온 스트레스를 받은 작물은 FV/FM이 감소한다(Aazami 등, 2021). 정식 후 80일에 비접목 처리구는 경경과 FM, FV/FM, PIABS 및 ET0/RC의 값이 낮은 것으로 보아 저온 피해를 받아 생육과 광합성 효율이 감소한 것으로 판단된다. 반면, ‘Powerguard’와 ‘B-blocking’은 저온기에도 생육과 광합성 효율을 유지하여 총 수량이 증가하는데 기여한 것으로 판단된다.
Table 6.
Minimal fluorescence yield (F0), maximal fluorescence yield (FM), maximum quantum yield (FV/FM), performance index (PIABS), electron transport flux (ET0/RC), average absorbed photon flux (ABS/RC), maximum trapped exciton flux (TR0/RC), and dissipated energy flux (DI0/RC) measured at 80 and 172 days after transplanting in non-grafted and grafted tomatoes in soil cultivation.
| Graft combination | F0 | FM | FV/FM | PIABS | ET0/RC | ABS/RC | TR0/RC | DI0/RC | |||||||||||||||||
| Scion | Rootstock | 80z | 172 | 80 | 172 | 80 | 172 | 80 | 172 | 80 | 172 | 80 | 172 | 80 | 172 | 80 | 172 | ||||||||
| Red250 | Powerguard | 6,911 ay | 6,296 a | 39,631 a | 38,314 ab | 0.83 a | 0.83 a | 3.73 a | 4.73 ab | 0.95 ab | 0.99 a | 1.93 a | 1.87 a | 1.59 a | 1.56 a | 0.34 b | 0.31 ab | ||||||||
| Red250 | IT173773 | 7,030 a | 6,270 a | 36,526 ab | 37,397 b | 0.81 ab | 0.83 a | 2.95 ab | 4.26 b | 0.95 ab | 0.91 b | 2.02 a | 1.81 a | 1.63 a | 1.51 a | 0.39 a | 0.30 ab | ||||||||
| Red250 | 20LM | 7,152 a | 6,358 a | 38,948 ab | 39,176 ab | 0.82 ab | 0.84 a | 3.31 ab | 4.52 ab | 0.97 ab | 0.97 ab | 2.01 a | 1.87 a | 1.64 a | 1.56 a | 0.37 ab | 0.31 ab | ||||||||
| Red250 | B-blocking | 7,304 a | 6,463 a | 40,725 a | 41,672 a | 0.82 a | 0.85 a | 3.42 ab | 4.98 a | 0.99 a | 0.97 ab | 2.01 a | 1.84 a | 1.65 a | 1.55 a | 0.36 ab | 0.29 b | ||||||||
| Red250 | -x | 6,989 a | 6,264 a | 34,754 b | 36,602 b | 0.80 b | 0.83 a | 2.62 b | 4.22 b | 0.90 b | 0.96 ab | 2.00 a | 1.88 a | 1.59 a | 1.56 a | 0.41 a | 0.32 a | ||||||||
생육지표 중 경경은 FM, FV/FM 및 PIABS와 정의 상관관계를 나타내었고, F0 및 DI0/RC와는 부의 상관관계를 나타내었다(Table 7). 경경과 PIABS, 경경과 DI0/RC 간의 상관계수는 각각 0.70과 -0.74로 고도의 유의성을 보였다. 엽장과 엽폭은 PIABS와 정의 상관관계를 가지고 DI0/RC와 부의 상관관계를 가졌다. Zhang 등(2014)의 연구 결과에 따르면 염류 농도가 높아짐에 따라 FV/FM와 PIABS은 부의 상관관계를, DI0/RC는 정의 상관관계를 나타내었다. F0는 광계Ⅱ 반응중심으로 전달되기 전 엽록소 분자들이 방출하는 에너지 정도를 나타낸 지수로, 불활성 상태의 엽록소 분자가 많아지면 에너지 포획능력이 감소하여 값이 증가한다(Baker와 Rosenqvist, 2004). 이렇게 작물이 스트레스를 받으면 FM과 FV/FM은 감소하고 F0는 증가한다(Baker와 Rosenqvist, 2004). 본 실험의 토마토는 저온 스트레스를 받아 광합성 효율과 생육이 감소하여 최대 형광 값을 나타내는 FM, 광계Ⅱ 최대 광화학적 효율을 나타내는 FV/FM, 그리고 작물의 전반적인 활력도를 나타내는 PIABS 수치는 감소하였고, 불활성 상태의 엽록소 분자가 많아지면 값이 증가하는 F0와 빛에너지가 열로 소실되는 정도를 나타내는 DI0/RC는 증가한 것으로 보인다. 이와 같이 다양한 OJIP 지수의 의미를 파악하고 객관적인 수치를 이용한 광합성 효율의 분석을 통해 대목 종류에 따른 토마토의 저온 내성 평가가 가능한 것으로 판단된다.