서 론
재료 및 방법
1. 식물재료 및 재배환경
2. 마이크로버블 처리 및 양액 특성 조사
3. 생육조사
4. 통계분석
결과 및 고찰
1. 양액 특성 변화
2. 상추와 배초향의 생육
3. 결론
서 론
엽채류는 쌈채소, 샐러드, 겉절이 등 다양한 형태로 소비된다. 최근 건강에 관한 관심이 높아지면서 채소 소비량이 증가하여 엽채류의 생산량이 2019년 2,448톤에서 2020년 2,807톤으로 증가하는 추세이다(MAFRA, 2021). 채소의 수요가 증가함에 따라 고품질 엽채류를 연중 생산하기 위해 정밀 환경조절이 가능한 밀폐형 식물공장에서의 수경재배가 주목받아 이에 관한 다양한 연구가 이루어지고 있다(Uoon 등, 2017). 토경재배의 경우 토양에 내재된 유해 중금속으로 인한 식물체 오염이 문제시되고 있으며(Jung 등, 2002), 염류집적과 토양 병해충, 그리고 연작으로 인한 수량 감소와 품질 저하 등의 이유로 연중 생산에 어려움이 있다(Pervaiz 등, 2020). 반면 수경재배는 토양을 이용하지 않고 배지를 사용하거나 순수수경의 형태로 이루어져 토양병해나 연작장해가 발생하지 않아 식물공장에서 안정적으로 고품질 채소를 생산할 수 있다(Choi와 Lee, 2003; Park과 Kim, 2017).
상추(Lactuca sativa L.)는 국화과(Asteraceae)의 1년생 초본으로 수요가 많고 재배기간이 짧아 식물공장에서 재배하기에 적합한 식물로 알려져 있다(Choi와 Lee, 2003). 배초향(Agastache rugosa Kuntze)은 동아시아 지역에 분포하는 꿀풀과(Lamiaccac)의 다년생 초본으로 지상부는 곽향이라고 불리어 감기, 두통, 구토 및 복통 등에 대한 약재로 사용되며, 정유 성분을 구성하는 monoterpene과 sesquiterpene을 함유하고 있어 향이 강한 어린잎을 쌈채소 및 향신료로 사용하기도 한다(Park 등, 2000; RDA, 2018). 그러나 배초향은 기후 영향을 많이 받는 작물로 재배지역과 수확시기에 따른 품질 차이가 커 일정한 품질의 배초향을 연중생산하기 위한 연구가 필요하다(Hong 등, 2020).
담액수경(deep flow technique, DFT)은 수경재배의 일종으로 고형배지를 사용하지 않고 식물의 뿌리를 양액에 담가 양분을 공급하는 형태의 재배법이다(RDA, 2021). DFT 방식은 식물체의 뿌리가 항상 양액에 잠겨 있기 때문에 뿌리의 원활한 호흡을 위해서 양액 내 적정 용존 산소량(dissolved oxygen, DO)을 유지하기 위한 산소 공급 시스템이 필수적으로 요구된다(Morimoto 등, 1989). DFT는 에어펌프로 수중에 기포를 발생시켜 양액에 산소를 공급하지만, 양액 내에 기포가 유지되는 시간이 짧아 DO를 일정 수준 유지하기 힘든 문제점을 지니고 있다(Ikeura 등, 2018). DO가 부족하여 뿌리에 산소가 결핍되면 양분 흡수가 억제되어 단백질, 엽록소 합성과 같은 생장에 필요한 대사 활동에 문제가 발생할 수 있다(Morimoto 등, 1989).
마이크로버블(Microbubble, MB)은 직경이 50µm 이하인 기포로 물속에서 부상할 때 내부의 압력과 주변 액체의 압력 차가 적어 천천히 부상하면서 양액 내 DO를 식물 생장에 충분한 수준으로 유지할 수 있다(Ikeura 등, 2018; Takahashi, 2009; Zhang 등, 2007). Park과 Kurata(2009)는 에어펌프와 MB생성장치를 각각 사용하여 DFT 방식으로 상추를 재배하였을 때 MB처리구의 DO가 더 높게 유지되었으며 지상부의 생체중과 건물중이 유의하게 향상되었다고 보고하였다. 이는 표면에 음전하를 띠는 MB가 뿌리에 부착되면서 양이온을 끌어당겨 양분 흡수를 촉진한 것에 기인하였다고 하였다(Ohnari 등, 2006; Park과 Kurata, 2009; Takahashi, 2005). 이러한 점에서 MB는 양액 내 DO와 식물체의 생육을 증가시킬 수 있을 것으로 판단된다. 또한, MB는 기포가 붕괴하면서 hydroxyl radical을 생성한다(Lu 등, 2023; Takahashi 등, 2007). Hydroxyl radical은 자유라디칼로 활동하는 활성산소(reactive oxygen species, ROS)의 일종으로 높은 반응성을 지녀 살균 및 산화 스트레스를 발생시킨다(Turrens, 2003; Valko 등, 2007). Bok 등(2019)은 DFT에서 MB를 처리하였을 때, hydroxyl radical에 의한 산화 스트레스로 물냉이의 생육이 대조구와 비교하여 감소하였으나 2차 대사산물 중 하나인 glucosinolate의 함량은 증가하였다 보고하였다(Bok 등, 2019; Ikeura 등, 2017).
수경재배에서 MB처리를 작물 재배에 적용하기 위한 다양한 연구들이 보고되었으나 DFT에서 MB처리에 따른 식물체의 생육 변화에 관한 연구는 부족하다. 따라서 본 연구는 밀폐형 식물생산시스템에서 DFT 재배방식으로 상추와 배초향을 재배할 때 MB처리가 두 작물의 생육에 미치는 영향을 조사하고, 재배기간 중의 양액 특성 변화를 조사하여 DFT 재배 시스템에서 MB생성 시스템을 실용화하기 위한 기초자료를 확보하고자 수행되었다.
재료 및 방법
1. 식물재료 및 재배환경
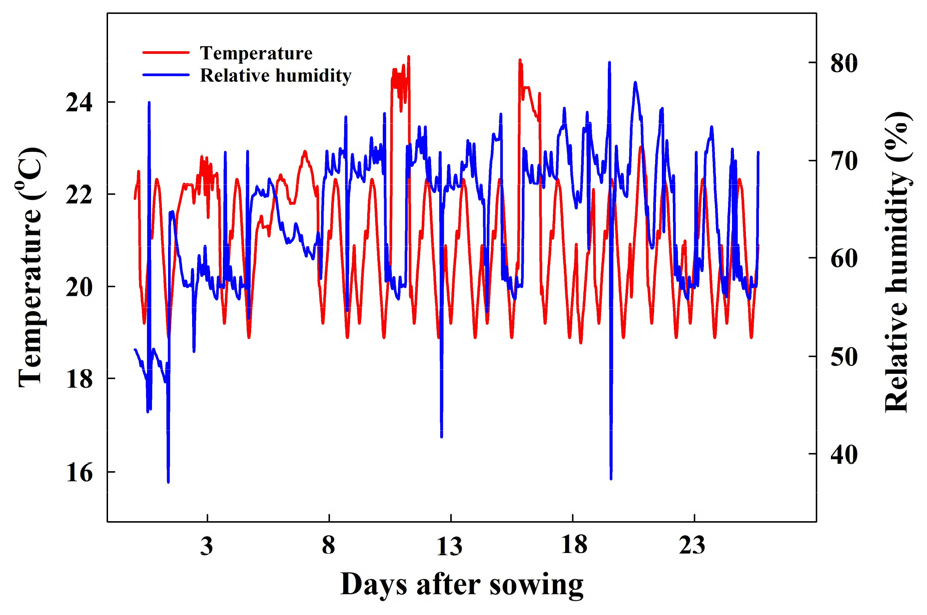
상추(Lactuca sativa L. ‘Dduksumjeokchukmyeon’, Kyoungshin Co., Ltd., Korea)와 배초향 재배 농가에서 자가채종한 배초향(Agastache rugosa Kuntze)의 종자를 페트리디쉬(DH.W30015, Daihan Sci Co., Ltd., Wonju, Korea)에 치상하고 밀폐형 식물생산시스템(C1200H3, FC Poibe Co., Ltd., Seoul, Korea)에서 24시간 동안 최아시켰다. 최아한 식물체는 우레탄 스펀지(W×L×H: 30mm×30mm×40mm, Gafatec Co., Ltd., Jeongeup, Korea)를 충진한 105구 플러그 트레이(54×28×5cm, Bumnong Co., Ltd., Jeongeup, Korea)에 이식하여 7일간 재배하였다. 수분 공급은 2-3일 간격으로 Hoagland 양액(Hoagland와 Arnon, 1950)을 EC 0.3dS·m-1, pH 6.5로 조제하여 저면관수 하였다. 파종 7일 후 본엽이 2매 출현한 상추와 배초향을 동일한 환경의 순환식 DFT 시스템에 정식하고 EC 0.8dS·m-1, pH 6.5로 조제한 Hoagland 양액을 공급하여 16일간 재배하였다. 온습도 로거(TR-74Ui, T&D Co., Ltd., Matsumoto, Japan)로 측정한 밀폐형 식물생산시스템 내부의 온도와 상대습도는 각각 22±3℃, 60±20%였다(Fig. 1). 밀폐형 식물생산시스템 내 광환경은 광도 200µmol·m-2·s-1 photosynthetic photon flux density(PPFD)와 광주기 12/12h(명기/암기)로 설정하였으며 RGB LEDs(red:green:blue = 7:1:2, ES LEDs Co., Ltd., Seoul, Korea)를 광원으로 사용하였다. 광도는 광도계(HD2101.2, Delta Ohm SrL., Caselle, Italy)를 이용하여 측정하였으며, 광파장은 분광복사계(ILT950, International Light Co., Ltd., MA, USA)를 이용하여 측정하였다.
2. 마이크로버블 처리 및 양액 특성 조사
DFT 베드(W×L×H: 120cm×52cm×5cm, FC Poibe Co., Ltd., Seoul, Korea)에 선회식 MB 발생 장치(ADBS07, AdTech Co., Inc., Gyeongsan, Korea)를 이용하여 재배기간 동안 하루에 4시간 간격으로 3번씩 9시, 13시, 17시에 5분 동안 MB를 공급한 양액을 관수하였다. 해수용 열교환기(DBC-200, Daeil Co., Ltd., Busan, Korea)를 사용하여 공급되는 양액의 수온을 22±1℃로 유지하였다(Fig. 2D). MB처리에 따른 양액의 특성 변화를 조사하기 위해 하루에 3번씩 MB처리 5분 후에 EC/pH meter(8200M, EZDO Inc., Lyon, France)를 이용하여 양액의 수온, EC, pH를 측정하였고, DO meter(OE-270AA, DKK-TOA Co., Ltd., Tokyo, Japan)를 이용하여 양액의 DO를 측정한 다음 일일 평균치를 산출하였다.
3. 생육조사
생육조사는 MB처리 16일차에 엽장, 엽폭, 엽수, SPAD, 엽면적, 지상부와 지하부의 생체중 및 건물중을 측정하였으며 상추는 잎의 색도를, 배초향은 초장과 경경을 측정하였다. SPAD값은 엽록소 측정기(SPAD-502, Konica Minolta Inc., Tokyo, Japan)를 이용하여 완전히 전개된 3개의 잎을 측정하고 평균값을 산출하였다. 경경은 버니어캘리퍼스(CD-20CPX, Mitutoyo Co., Ltd., Kawasaki, Japan)를 이용하여 측정하였다. 엽면적은 엽면적 측정기(LI-3000, LICOR Inc., Lincoln, NE, USA)를 이용하여 측정하였고, 생체중과 건물중은 전자저울(EW220-3NM, Kern&Sohn GmbH., Balingen, Germany)을 이용하여 측정하였다. 건물중은 식물체를 70℃ 항온 건조기(Venticell-222, MMM Medcenter Einrichtungen GmbH., Planegg, Germany)에서 72시간 동안 건조한 후 측정하였다. 색도는 상추의 가장 큰 잎의 엽맥을 제외한 부위를 색차계(CM-3500d, Minolta Co., Ltd., Tokyo, Japan)를 사용하여 Hunter L, a, b 값을 측정한 뒤 평균값으로 나타내었다. ‘L’ 값은 0(black)-100(white), ‘a’ 값은 −800(greenness)-100(redness), ‘b’ 값은 −70(blueness)−70(yellowness)으로 수치화하였다. 뿌리 이미지 스캐너(Expression 12000XL, EPSON Co., Ltd., Seoul, Korea)를 이용하여 뿌리를 스캔하고 뿌리 이미지 형태 분석 시스템(WinRHIZO Pro 2007a)을 이용하여 총 뿌리길이, 뿌리 표면적, 평균 직경, 근단 수를 분석하였다.
4. 통계분석
실험은 처리 당 11개체씩 3반복으로 배치하였으며 처리 당 균일한 9개체를 채취하여 조사하였다. 통계분석은 SAS 프로그램(SAS 9.4, SAS Institute Inc., Cary, NC, USA)을 이용하여 분산분석(ANOVA)을 실시하였고, 짝지어진 처리 간의 평균값 비교를 위해 독립 표본 t검정(independent t-test)을 하여 유의성을 검증하였다. 그래프는 SigmaPlot 12.5(Systat Software, San Jose, CA, USA)을 이용하여 나타내었다.
결과 및 고찰
1. 양액 특성 변화
재배기간 중 순환식 수경재배 시스템 내 양액의 EC와 DO는 처리 9일 차 이후 대조구에서 상대적으로 낮은 경향을 보였으며 pH는 처리 9일차 이후 MB처리구에서 비교적 낮게 나타났다(Fig. 2). 수온은 21±1℃로 일정하게 유지되었다. Choi 등(2005)과 Kim 등(2014)은 오이, 청경채, 케일 등의 생장기간이 증가함에 따라 공급 EC 대비 배액의 EC가 지속적으로 감소한다고 보고하였으며, 이는 영양생장기간 동안 각 작물의 양분 요구도가 점진적으로 증가하기 때문이라고 하였다. 본 연구에서는 MB처리구 대비 대조구의 생육이 촉진되는 모습을 보였으며(Fig. 3), 대조구에서 비교적 영양생장이 활발하여 양분 요구도가 증가했기 때문에 EC가 감소하는 경향이 나타난 것으로 판단된다. DO는 이전의 연구에서 MB가 일반적인 기포에 비해 내부 압력이 낮기 때문에 수면으로 상승하는 속도가 느려 양액 내 DO의 유지에 효과적이라고 보고된 바 있다(Ikeura 등, 2018; Takahashi, 2009; Zhang 등, 2007). 그러나 본 연구에 사용된 DFT 베드의 수위는 5cm로 낮아 MB가 양액 내 DO를 유의적인 수준으로 증가시킬 수 있는 만큼의 깊이에 도달하지 않은 것으로 판단되며, 대조구의 생육이 비교적 활발하여 호흡량 또한 증대되었기에 처리 9일차 이후 DO가 상대적으로 낮게 나타난 것으로 판단된다. pH의 경우 표면이 전기적으로 음전하를 띠는 MB는 기포 주변으로 양이온을 끌어당겨 MB 표면에 구형으로 둘러진 형태의 전기 이중층을 형성한다(Takahashi, 2005). 그리고 기포 크기가 매우 작아 뿌리에 미세하게 분산된 MB는 식물체가 MB에 흡착된 양이온을 효율적으로 흡수하도록 돕는다(Ohnari 등, 2006; Park과 Kurata, 2009). 상대적으로 많은 양의 양이온을 흡수하게 된 식물체는 체내 이온 균형을 유지하고 원활한 양분 흡수를 위해 양이온 펌프가 작동되어 뿌리를 통해 수소이온(H+)을 배출한다(Byeon 등, 2017). MB처리구에서 pH가 감소한 결과는 MB처리로 인해 식물체의 양이온 흡수가 촉진되었고, 체내 이온 균형을 유지하기 위해 양이온 펌프가 작동하여 H+가 배출되었기 때문에 양액의 pH가 감소한 것으로 판단된다.
2. 상추와 배초향의 생육
정식 16일 후 상추와 배초향의 생육은 MB처리에서 대조구에 비해 저조한 경향을 보였다(Fig. 3). MB처리구 상추와 배초향의 엽장과 엽폭은 대조구에 비해 유의적으로 짧았으며 엽면적도 좁았다(Table 1과 2). 배초향의 경우 전반적인 생육이 억제되며 엽채류 재배에 있어 중요한 잎의 발달이 저조하여 엽수가 대조구의 41.1% 수준으로 확인되었다. 두 작목의 생체중과 건물중 또한 감소하여 처리 간에 유의적인 차이를 확인할 수 있었다. 상추 잎의 색도는 명도(L)와 황색도(b)가 대조구에서 각각 47.82와 31.09, MB처리구에서 39.30, 18.07로 감소하였고 적색도(a)는 대조구에서 −15.40에서 4.28로 유의성 있게 향상되어 MB처리구에서 엽색이 더 붉은 경향을 보였다. 상추와 배초향의 지하부 분석 결과, 두 작물 모두 MB처리구에서 총 뿌리길이, 표면적, 그리고 근단 수가 대조구에 비해 유의적으로 감소하였다(Fig. 4와 5). 평균 뿌리 직경의 경우 상추에서는 처리 간 유의적인 차이가 나타나지 않았으나 배초향은 MB처리하였을 때 29.7% 향상되어 통계적인 유의성을 확인하였다. MB는 붕괴하면서 강한 반응성과 산화력을 지닌 ROS인 hydroxyl radical을 발생시킨다고 보고되었으며(Lu 등, 2023; Takahashi 등, 2007), hydroxyl radical은 강한 반응성으로 인해 단백질, 지질 등과 반응하여 세포를 손상시킨다(Turrens, 2003; Valko 등, 2007). Hydroxyl radical은 MB를 이용한 수경재배에서 식물체의 생육을 억제하는 요소 중 하나로 작용할 수 있을 것으로 판단된다. Ikeura 등(2018)은 재배기간 중 MB를 공급하는 DFT 재배 방식으로 소송채를 3주간 재배하였을 때 뿌리 세포에서 원형질분리가 발생하여 뿌리를 통한 양분 흡수에 문제가 발생하였다고 보고하였으며, 이에 대한 원인으로 고밀도의 MB에 의한 삼투 스트레스를 지목하였다. 삼투 스트레스는 세포 내의 수분이 외부로 배출되도록 하는 요인으로 식물체의 수분 스트레스를 야기한다(Byeon 등, 2017). 뿌리의 발달은 수분과 밀접한 관계에 있으며 삼투 스트레스에 의한 수분 부족은 뿌리 발달을 크게 억제한다고 보고된 바 있다(Akhiyarova 등, 2023; Xiang 등, 2023). 본 연구에서도 앞선 연구들과 유사하게 MB에 의한 산화 및 삼투 스트레스로 인해 뿌리의 총길이와 잔뿌리가 감소되었으며, 정상적인 양분 흡수에 어려움이 있어 두 작목 모두 MB처리구에서 대조구에 비해 전체적인 생육이 저조한 것으로 판단된다. 상추 잎의 적색도는 잎의 안토시아닌의 함량에 의해 결정되며(Lee 등, 2010; Poei-langston과 Wrolstad, 1981; Wrolstad, 2004), 식물체가 비생물적 스트레스를 받을 경우 체내에서 발생하는 활성산소에 의한 자극으로 안토시아닌 생합성이 상향조정된다고 보고된 바 있다(Chalker-Scott, 1999; Naing과 Kim, 2021). MB처리구의 상추는 hydroxyl radical에 의한 산화 스트레스와 고밀도의 MB로 인한 삼투 스트레스를 포함한 비생물적 스트레스를 받아 생육이 억제되고 안토시아닌 생합성이 촉진되어 적색도가 증가한 것으로 추정되며, 이러한 결과는 Bok 등(2019)이 MB를 이용한 DFT 방식으로 물냉이 재배 시 무처리구에 비해 생육이 감소하였으나 2차대사산물인 glucosinolate 함량이 증가한 것과 유사하였다. 따라서 MB처리구의 상추와 배초향은 MB가 붕괴하며 발생한 hydroxyl radical에 의한 산화 스트레스와 삼투 스트레스에 의해 생육이 저해될 정도의 강한 스트레스를 받은 것으로 판단된다.
Table 1.
Growth characteristics of Lactuca sativa L. at 16 days after treatment as affected by non-microbubbles and microbubbles conditions (n = 9).
| Treatment |
Leaf length (cm) |
Leaf width (cm) |
No. of leaves | SPAD | Lz | ay | bx |
Leaf area (cm2/plant) | Shoot | Root | |||
|
Fresh weight (g/plant) |
Dry weight (g/plant) |
Fresh weight (g/plant) |
Dry weight (g/plant) | ||||||||||
| Control | 17.06 | 15.34 | 10.56 | 22.30 | 47.82 | ‒15.40 | 31.09 | 854.61 | 55.55 | 1.86 | 9.17 | 0.27 | |
| Microbubble | 9.97 | 8.98 | 9.00 | 19.99 | 39.30 | ‒4.28 | 18.07 | 238.62 | 17.77 | 1.07 | 2.16 | 0.20 | |
| T-value | 5.68*** | 7.53*** | 1.98NS | 0.68NS | 4.29*** | ‒9.43*** | 5.76*** | 3.62** | 4.53** | 2.35* | 5.16*** | 1.63NS | |
Table 2.
Growth characteristics of Agastache rugosa Kuntze at 16 days after treatment as affected by non-microbubbles and microbubbles conditions (n = 9).
| Treatment |
Plant height (cm) |
Leaf length (cm) |
Leaf width (cm) |
No. of leaves | SPAD |
Stem diameter (mm) |
Leaf area (cm2/plant) | Shoot | Root | |||
|
Fresh weight (g/plant) |
Dry weight (g/plant) |
Fresh weight (g/plant) |
Dry weight (g/plant) | |||||||||
| Control | 25.99 | 5.98 | 4.68 | 67.56 | 40.46 | 3.49 | 334.44 | 10.57 | 1.55 | 4.76 | 0.26 | |
| Microbubble | 19.58 | 3.91 | 3.34 | 27.78 | 30.88 | 2.55 | 98.90 | 3.95 | 0.70 | 0.78 | 0.08 | |
| T-value | 2.57* | 4.37*** | 5.29*** | 4.54*** | 3.41** | 5.23*** | 6.25*** | 4.46*** | 5.14*** | 7.70*** | 6.50*** | |

Fig. 4.
The root growth characteristics of Lactuca sativa L. at 16 days after treatment as affected by non-microbubbles and microbubbles conditions. Total root length (A), root surface area (B), average root diameter (C), and number of root tips (D). NS, ***: Non-significant or significant at p ≤ 0.001, respectively, by independent t-test (n = 9).
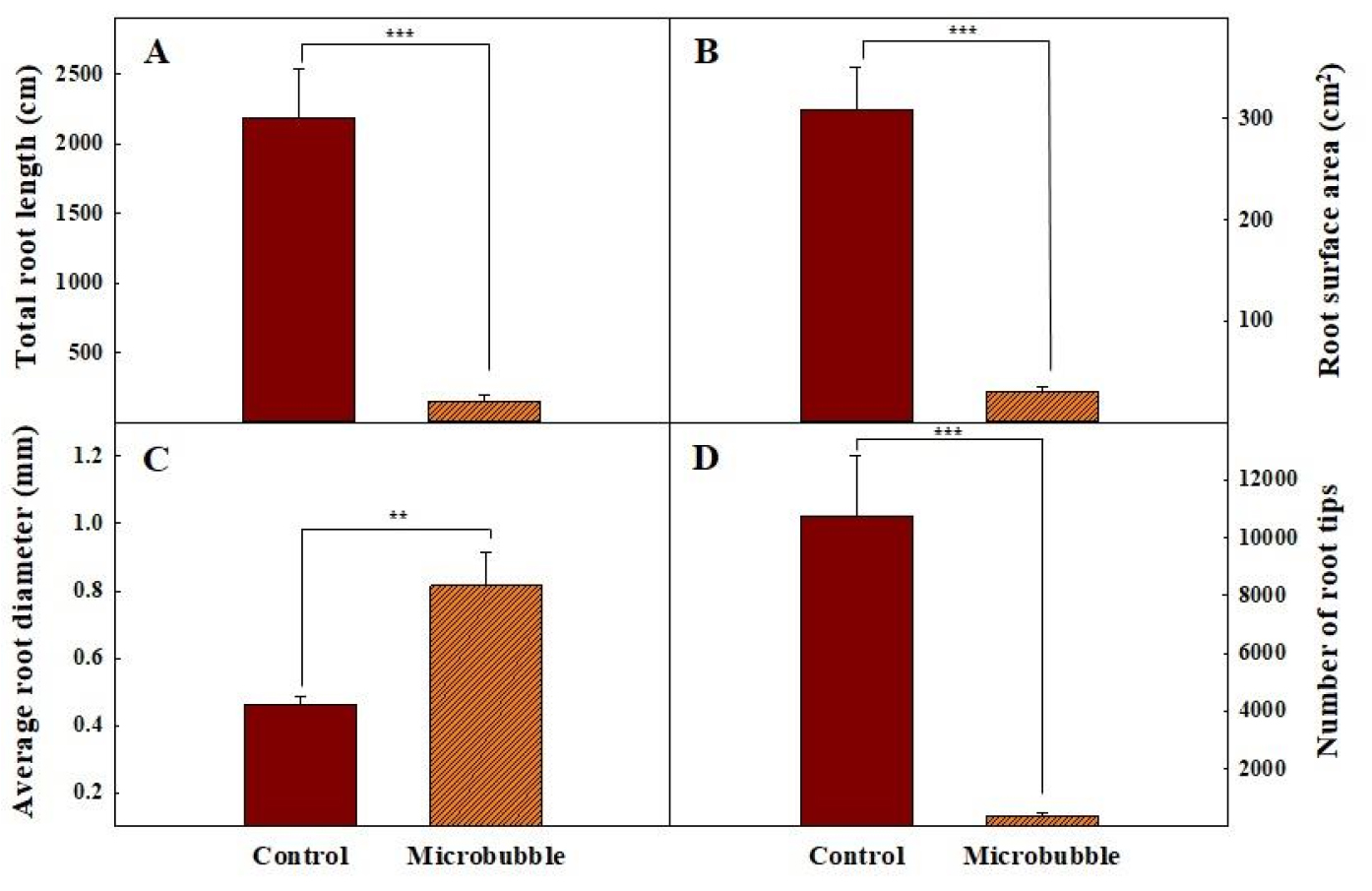
Fig. 5.
The root growth characteristics of Agastache rugosa Kuntze at 16 days after treatment as affected by non-microbubbles and microbubbles conditions. Total root length (A), root surface area (B), average root diameter (C), and number of root tips (D). **, ***: significant at p ≤ 0.01, or 0.001, respectively, by independent t-test (n = 9).
3. 결론
위의 결과를 종합하였을 때, 상추와 배초향을 DFT 방식으로 재배 시 MB처리는 양액 내에서 발생한 것으로 추정되는 hydroxyl radical과 고밀도의 MB에 의한 삼투 스트레스에 의해 뿌리를 손상시키고 작물의 전체적인 생육을 감소시키는 것으로 판단된다. 또한 낮은 높이의 DFT 베드 이용 시 MB의 DO 유지 효과를 확인하기 어려웠다. MB의 공급 수준을 조절하고 식물체의 지하부에 적절한 스트레스를 준다면 안토시아닌과 같은 2차 대사산물의 함량 증대를 도모할 수 있을 것으로 기대되며 MB의 적정 처리농도, 처리 횟수, 처리 방법에 대한 추가적인 연구가 필요할 것으로 판단된다.