서 론
재료 및 방법
1. 실험재료 및 재배 환경조건
2. 염류 스트레스 처리 방법
3. 엽록소형광 측정
4. 지상부 생체중 조사
5. 엽록소 함량 분석
6. 프롤린 함량 분석
7. 통계 분석
결과 및 고찰
1. 염류 스트레스에 따른 유전자원의 생체중, 엽록소 및 프롤린 분석
2. 염류 스트레스에 따른 유전자원 별 엽록소형광 매개변수 변화
서 론
최근 파괴적인 식물체 분석 방법 이외에 비파괴적으로 식물의 생리 특성 및 스트레스 수준을 분석 및 평가할 수 있는 다양한 기법들이 개발되고 있으며, 이 중 엽록소형광(Chlorophyll Fluorescence; CF) 측정 기법을 이용해 광합성 과정 중 광에너지 효율, 열 및 형광을 측정할 수 있다(Cen 등, 2017). 엽록소형광 측정 기법은 일반적으로 광합성 과정이 비생물적 및 생물적 스트레스 영향에 의해 민감하게 반응하는 것에 기인하며, 식물의 광에너지 이용 효율을 다양한 엽록소형광 매개변수로 표현할 수 있다(Maxwell과 Johnson, 2000). 식물의 스트레스 요인에는 박테리아, 곰팡이 및 해충 등에 의한 생물적 요인과 염류, 온도, 건조 및 중금속 등에 의한 비생물적 요인으로 구분할 수 있다(Pérez-Bueno 등, 2019). 엽록소형광 기법을 이용한 생물적 스트레스의 평가에는 Fv/Fm(maximum quantum yield of PSⅡ), ΦPSⅡ(effective quantum yield of PSⅡ), qP(photochemical quenching), NPQ(non-photochemical quenching)의 매개변수가 주로 이용되며, 비생물적 스트레스의 평가에는 Fo(minimum chlorophyll fluorescence), Fm (maximum chlorophyll fluorescence), ΦPSⅡ(effective quantum yield of PSⅡ)의 매개변수들이 주로 이용된다(Strauss 등, 2006; Baker, 2008; Streb 등, 2008).
비생물적 스트레스 요인의 하나인 염류 스트레스는 식물체의 삼투 기능 불균형을 일으키며 엽록소 함량을 감소시킨다고 알려져 있다(Taїbi 등, 2016). 이러한 염류 스트레스를 완화시키기 위해 식물은 세포 내에 프롤린을 축적하여 세포질 내 삼투 기능을 유지시켜 수분 흡수를 촉진한다(Heidari, 2010). 시설 및 토경 재배를 통해 생산되는 토마토는 장기재배의 특성상 근권부에 연속적인 양분 공급과 동일 토양 내 연작으로 인하여 지속적인 염류 스트레스를 받으며, 이는 안정적인 과실 생산과 정상적인 생육 발달에 영향을 미치기 때문에(Bacha 등, 2017), 토마토와 같은 장기재배 특성의 작물에서 염류 내성을 보유하고 있는 대목 계통의 선발과 육성이 필요하다(Colla 등, 2010). 또한 이러한 품종 육종 과정에서 다양한 유전자원의 염류 스트레스 내성 평가를 위한 객관적 평가 시스템의 개발이 지속적으로 요구되고 있으며 염류 스트레스를 포함한 다양한 환경 스트레스의 수준을 정량화할 수 있는 기법으로 엽록소형광의 원리가 다양하게 연구되고 있다.
토마토에 NaCl을 처리한 경우 일부 엽록소형광 매개변수가 생육단계에 따라 변화하는데, 생육 초기보다는 후기에 Y(PSII), qP 및 NPQ의 변화가 나타나며(Zribi 등, 2009). 시금치, 옥수수, 유채 및 밀에서도 염류 스트레스 처리 시, 광계Ⅱ의 효율을 나타내는 Y(PSII), qP 및 NPQ의 감소가 확인된다(Mehta 등, 2010). 이와 같이, 작물의 광합성 효율을 간접적으로 판단할 수 있는 엽록소형광 매개변수를 활용하면 비파괴적으로 대량 유전자원 간의 염류 스트레스 내성의 차이를 구분할 수 있으며, 이를 염류 스트레스 저항성 유전자원에 대한 객관적 선발 평가 방법에 활용할 수 있을 것으로 판단된다. 더불어 일부 염류 스트레스 내성 평가 연구에서는 다양한 농도별 염류 스트레스 처리 결과가 큰 차이를 보이지 않았기 때문에, 본 연구에서는 염류 스트레스에 강한 유전자원 선발을 위해 고농도의 염류 스트레스 처리가 필요하다(Stevens 등, 2006; Zribi 등, 2009; Shin 등, 2020b). 따라서 본 연구는 토마토 유전자원 49점을 대상으로 일정 범위의 염류 스트레스를 처리하고, 폐쇄형 식물공장 내 인공광 조건에서 염류 스트레스 수준 평가를 위한 엽록소형광 매개변수를 선발하고자 수행하였다.
재료 및 방법
1. 실험재료 및 재배 환경조건
본 연구는 농촌진흥청 국립원예특작과학원 채소과에서 분양받은 토마토 유전자원 49점을 이용하였다. 토마토의 육묘를 위해 50공 플러그 트레이에 원예용 상토 2호 초록이(Nongwoobio Co Ltd., Suwon, Korea)를 충진하고 0.5cm 깊이에 1립씩 파종하였으며 버미큘라이트로 일정하게 복토하였다. 균일하게 파종한 유전자원은 토마토 전문 육묘업체 관리 하에 연동형 플라스틱 온실에서 재배되었다. 토마토 유전자원의 염류 스트레스 저항성 수준 평가를 위해 다른 비생물적 스트레스(온도, 광 및 건조 등) 요인의 노출을 최소화하기 위하여, 다단형 인공광이 설치되어 있는 폐쇄형 식물공장 내에서 처리 기간 동안 실험이 진행되었다. 염류 스트레스 처리 기간 내 폐쇄형 식물공장의 환경은 온도 24/18℃(주/야), 일장 14/10h(주/야), 습도 60 ± 3%로 유지하였다. 인공 광원은 식물재배용 형광등(TLD 32W/865RS, Philips, Amsterdam, Netherlands)을 사용하였으며, 광도는 SpectraPen(LM500, PSI, Drasov, Czech)를 이용하여 생장점 기준 200 ± 10µmol·m-2·s-1로 유지하여 실험 종료 시점까지 재배하였다. 전문 육묘 관리 하에 재배된 18일차의 유묘를 운반하여 염류 스트레스 처리 기간 내 동일한 재배환경에서 3일 동안 적응시킨 후 균일한 생육 수준을 보이는 식물체를 선발하였다. 이후 선발된 식물체는 대조구(비염류 스트레스 처리)와 염류 스트레스 처리구(400mM)를 설정하고 처리구별로 각각 3반복하여 실험에 이용하였다.
2. 염류 스트레스 처리 방법
본 연구에 앞서 수행된 연구에서는 토마토 상용품종을 대상으로 일정 기간 동안 염류 스트레스 농도별 엽록소형광 매개변수의 변화를 모니터링하였다(Shin 등, 2020b). 본 연구는 앞서 수행된 연구를 바탕으로 보다 단기간 내 염류 저항성 및 감수성 유전자원 선발을 위하여 고농도의 염류 스트레스 NaCl 400mM 선정하고 이를 염류 스트레스 내성 평가를 위한 엽록소형광 매개변수를 선발하고자 하였다. 더불어 선행연구에서 고농도 염류 스트레스의 경우 7일 이내에 외형적으로 염류 스트레스 영향에 따른 변화를 확인할 수 있었으므로, 본 연구에서는 염류 스트레스 처리 기간을 5일 동안으로 한정하여 실험을 수행하였다. 이후 토마토 유전자원에 대하여 염류 스트레스를 처리하기 위해 NaCl(Sodium chloride, Daejung Chemicals & Metals Co., Ltd, Korea) 400mM(EC 33dS·m-1) 용액을 총 5일 동안 매일 오전 1회 20분간 저면관수의 형태로 공급하였다. 염류 스트레스 처리 시점을 기준으로, D0(염류 스트레스 처리 0일차, 0h), D1(염류 스트레스 처리 1일차, 24h), D2(염류 스트레스 처리 2일차, 48h), D3(염류 스트레스 처리 3일차, 72h), 및 D4(염류 스트레스 처리 4일차, 96h)의 5단계로 염류 스트레스 처리 시점을 기준으로 구분하였다. 염류 스트레스 처리 후 날짜별 토마토 유전자원의 유묘를 식물 개체별로 3반복하여 선정하여 엽록소형광 측정에 이용하였다.
3. 엽록소형광 측정
엽록소형광의 측정에는 엽록소형광 이미지 장치(Chlorophyll fluorescence imaging; Closed Fluorcam FC 800-C, PSI, Drasov, Czech)를 이용하였다. 염류 스트레스에 민감하게 반응하는 엽록소형광 매개변수의 선발을 위해 Quenching act 2 프로토콜을 사용하여 103개의 엽록소형광 매개변수를 모니터링하였으며, 이들 획득된 다수의 매개변수 중 염류 스트레스 평가 연구(Tsai 등, 2019; Zhao 등, 2019; Shin 등, 2020a; Shin 등, 2020b)에 이용된 대표적이라고 판단되는 12개의 엽록소형광 매개변수를 선발하여 분석하였다(Table 1). 카메라와 식물체 생장점과의 거리는 18-20cm으로 유지하였으며, 식물체는 20분간 암적응시킨 후 전체적인 잎의 형광 발생 범위를 1200-1300 수준으로 균일하게 분포되도록 Act 2 light, Super light, Sensitivity 및 Shutter를 설정하였다. 엽록소형광 측정 기준은 염류 스트레스 평가 기간 내 동일하게 유지되었으며, 유전자원별 초장을 고려하여 식물체와 카메라 간 거리를 일정하게 조정하여 측정하였다.
Table 1.
Information of chlorophyll fluorescence parameters used in this study.
4. 지상부 생체중 조사
토마토 유전자원 49점의 비교를 위해 염류 스트레스 처리 4일차(D4)에 전자저울(UX420H, Shimadzu Co., Kyoto, Japan)을 이용하여 유묘의 지상부 생체중을 측정하였다. 또한 염류 스트레스 영향을 정량적으로 판단하기 위해 엽록소 및 프롤린 함량 분석을 실시하였다. 각 유전자원 49점의 지상부를 동결건조기(FD5508, IlShinBioBase Co., Lrd., Korea)를 이용하여 동결건조하였으며, 막자사발로 균일하게 마쇄한 후 –20℃에서 보관하여 분석에 이용하였다.
5. 엽록소 함량 분석
엽록소 a와 b는 Warren(2008)의 방법을 변형하여 분석하였다. 균일하게 마쇄한 지상부의 샘플시료 50mg과 100% methanol 10mL를 15mL tube에 넣고 실온에서 4시간동안 추출하였다. 이후 추출액은 2400×g에서 10분간 원심분리한 후 상층액만을 분리하여 분석에 이용하였다. 96플레이트에 200µL씩 분주하고, 분광광도계(Multiskan Go; Thermo Fisher Scientific Oy., Vantaa., Finland)를 이용하여 흡광도 652와 665nm에서 측정하였다.
6. 프롤린 함량 분석
프롤린 함량은 Bates 등(1973)의 방법을 수정하여 분석하였다. 균일하게 마쇄한 지상부의 샘플시료 50mg과 3% sulfosalicyclic acid 3mL를 15mL tube에 넣고 균질화하여 실온에서 30분 동안 추출하였다. 추출액은 원심분리기(1736R; Labogene Co., Ltd., Korea)를 이용하여 3500rpm에서 10분 동안 원심분리하였으며, 이후 상층액을 0.45µm 실린지 필터로 여과하였다. 여과된 상층액 500µL, acetic acid 500µL 및 acid ninhydrin acid ninhydrin를 15mL tube에 넣고 혼합하여 95℃의 항온수조에서 1시간 동안 150rpm으로 유지한 뒤 얼음물을 이용하여 빠르게 냉각하였다. 충분히 냉각된 혼합액에 toluene 1mL을 혼합하고 균질화하였다. 이어서 분리된 상층 toluene을 200µL 씩 96 플레이트에 분주하고, 분광광도계를 이용하여 흡광도 520nm에서 측정하였다. 계상은 L-proline(Sigma-Aldrich Co., Inc., USA)을 이용하여 표준곡선을 사용하여 정량화하였다.
7. 통계 분석
엽록소형광 매개변수, 엽록소 및 프롤린의 분석 결과는 3 반복의 평균 ± 표준오차(SE)로 산출하였다. 본 연구결과 그래프 작성에는 SigmaPlot(SigmaPlot 12.5, Systat Software Inc., San Jose, CA, USA)을 이용하였다.
결과 및 고찰
1. 염류 스트레스에 따른 유전자원의 생체중, 엽록소 및 프롤린 분석
토마토 유전자원 49점에 염류 스트레스 400mM 수준으로 처리하고 최종적으로 지상부 생체중, 엽록소 및 프롤린 함량을 분석하여 스트레스 수준을 비교하였다. 염류 스트레스를 처리한 대부분의 유전자원은 대조구에 비해 지상부 생체중과 총 엽록소 함량이 감소하였으며, 프롤린 함량이 급격하게 증가하였다. 49점의 유전자원 중 염류 스트레스에 내성이 있다고 판단되는 염류 저항성 유전자원 19TRS13, 중도 저항성을 보인 19TRS04와 감수성 유전자원 19TRS07을 선발하고 비교하였다(Fig. 1). 염류 저항성 유전자원인 19TRS13과 중도 저항성으로 판단되는 19TRS04의 생체중 감소율은 각각 38.1%, 38.8%로 유사하였으나, 상대적으로 감수성 유전자원인 19TRS07은 감소율이 50.8%로 가장 큰 것으로 나타났다(Fig. 1A). 이때, 염류 스트레스에 중도 저항성으로 판단되는 유전자원 19TRS04의 프롤린 함량 편차가 가장 크게 확인되었다. 염류 저항성, 중도 저항성 및 감수성 유전자원에서 프롤린 함량이 대조구에 비해 98% 이상의 높은 증가율을 확인하였다(Fig. 1B). 각 유전자원의 프롤린함량 증가율은 유사하였으며, 염류 스트레스 수준에 따라 염류 저항성, 중도 저항성 및 감수성 유전자원 순의 함량 차이를 보였다. 유전자원 내 프롤린 함량 간의 차이는 확인하였으나, 대조구에 비해 모든 유전자원에서 유사한 수준의 증가율로 나타났다. 중도 저항성 및 감수성 유전자원에서 엽록소 a와 b의 감소가 나타났다. 중도 저항성 유전자원 19TRS04와 감수성 유전자원 19TRS07의 엽록소 a의 감소율은 각각 32.4%, 37.8%로 나타났으며, 엽록소 b의 경우 각각 21%, 27.8%로 확인되었다(Fig. 1C와 D). 염류 저항성 유전자원인 19TRS13의 엽록소 a의 함량이 상대적으로 증가하였다. 본 연구에서 활용된 유전자원별 총 엽록소 및 프롤린 함량의 차이는 식물체 내 염류 스트레스에 따른 대응 기작 때문으로 판단된다. 유묘가 염류 스트레스에 노출되는 시간이 길어질수록 외형 변화가 심하게 나타났다. 염류 스트레스 처리 후 D2부터는 엽의 끝 부분이 안쪽으로 점차 말려들어가 지상부가 위축되었으며, 엽색의 경우 대조구에 비해 염 스트레스 처리 후에는 엽색이 급격하게 황화되는 경향을 확인하였다. 토마토는 비교적 염류 스트레스에 강한 작물로 알려져 있으나, 지속적이며 강한 염류 스트레스에 노출되었을 경우 삼투압 현상으로 식물체내 수분 감소를 보이며 광합성 기능이 감소하게 된다(Bacha 등, 2017). 또한 극심한 염류 스트레스에 노출된 식물은 체내 생리기작의 저하로 세포 내 엽록소가 파괴된다(Al-Saady 등, 2012). 따라서 식물은 이러한 삼투압 및 광합성 기능 정상화를 위하여 체내에서 스트레스 피해를 저감시키는 역할로 프롤린을 생성한다고 알려져 있다(Reddy 등, 2015). 지상부 위축과 엽색의 황화 증상은 염류 스트레스에 노출된 다른 작물에서의 반응과 동일하였으며, 이러한 프롤린 함량의 축적 및 엽록소 함량의 감소는 유전자원에 따라 다르다는 연구 결과와 유사하였다(Agami, 2013; Gharsallah 등, 2016).
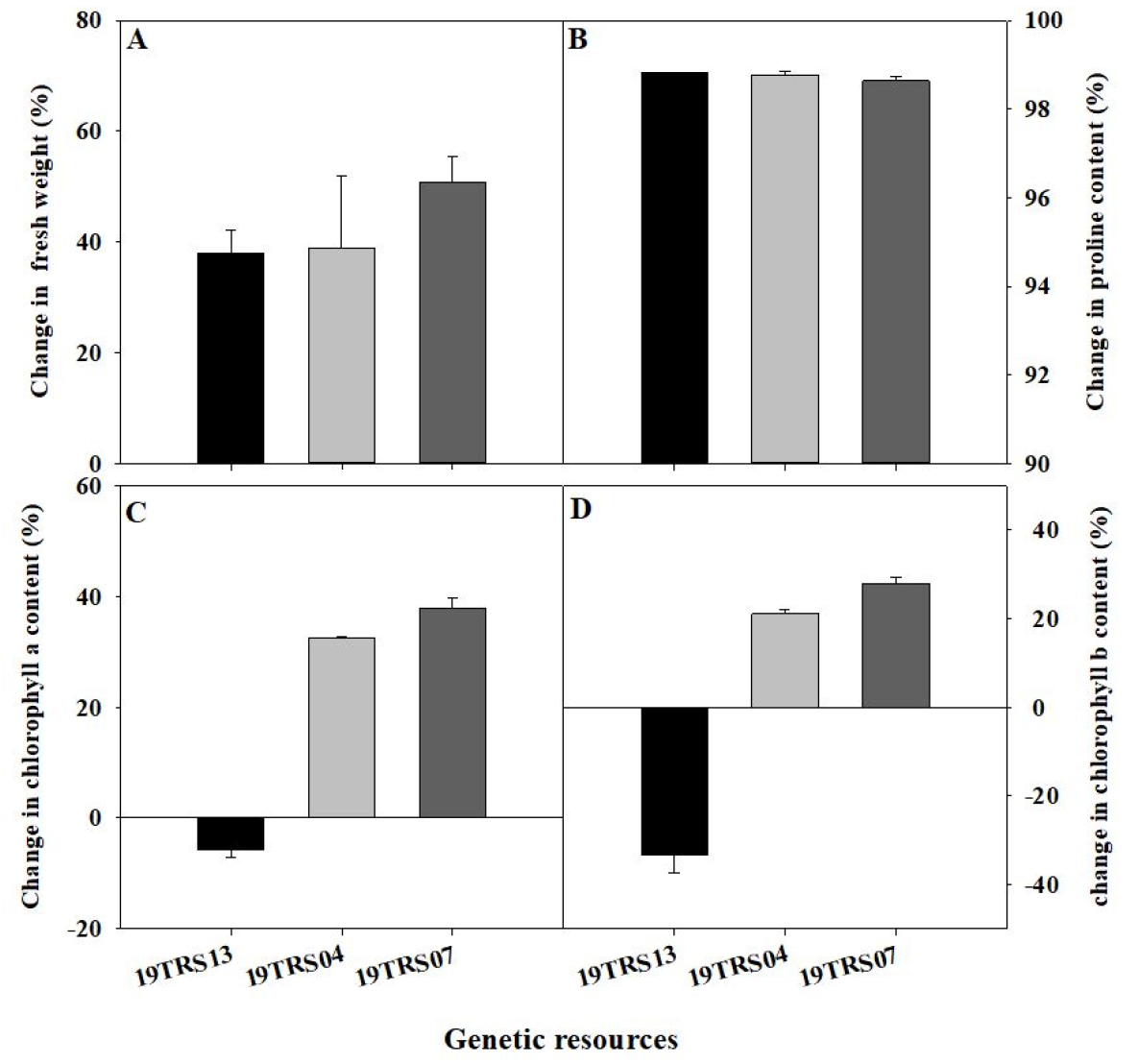
Fig. 1
Effect of salinity stress (400 mM NaCl) in shoot fresh weight (A), proline content (B), chlorophyll a content (C), and chlorophyll b content (D) in the seedlings of the susceptible (19TRS13), moderately resistant (19TRS04) and resistant (19TRS07) tomato genetic resources. Each value was calculated by using [(control-salinity stress)/control] × 100%. Each value represents the mean ± SE of three replications.
2. 염류 스트레스에 따른 유전자원 별 엽록소형광 매개변수 변화
토마토 유전자원 49점의 염류 스트레스 수준을 평가하기 위해 Quenching Act 2 프로토콜을 이용하여 엽록소형광을 측정하였으며, 내염성 평가에 효과적인 엽록소형광 매개변수의 선발을 위하여 염류 저항성 자원인 19TRS13, 중도 저항성 자원인 19TRS04 및 감수성 자원 19TRS07을 각각 대표 자원으로 선정하였다(Fig. 2). 염류 스트레스를 처리한 49점의 유전자원에 대해서 12개 엽록소형광 매개변수의 수준 차이를 확인하였다. 염류 스트레스 조건에서 중도 저항성 및 감수성 유전자원의 Fo(암적응 시 최소 형광)는 증가하고, Fm(암적응 시 최대 형광)는 감소하였으며, 염류저항성 유전자원은 변화가 없는 것으로 나타났다. Fv/Fm 및 Fv/Fm_Lss는 감수성인 19TRS04와 19TRS07 자원에서 염류 스트레스 처리된 D2부터 감소하는 경향을 보였으며, 19TRS04의 Fo는 D3부터 증가하였다. Fm은 암적응시 광계Ⅱ의 반응 중심의 폐쇄 상태에서 얻어지는 최대 형광 값으로 광계Ⅱ의 전자 전달 수준을 반영하며, 비생물적 및 생물적 스트레스를 받을 경우 민감하게 반응하는 매개변수이다(Baker, 2008; Fujii 등, 2016). 염류 스트레스를 처리한 모든 유전자원에서 Fm의 감소를 확인하였으며, 이는 광계Ⅱ의 전자 전달 수송 능력의 감소 때문으로 판단된다(Ranjbarfordoei 등, 2006). Fv/Fm은 가장 널리 사용하는 엽록소형광 매개변수로써 암적응을 거친 식물체의 1차 광화학 최대 양자 수율을 나타낸다(Baker, 2008). Shin 등(2020)에서는 NaCl 200mM 이하에서 Fv/Fm의 변화가 나타나지 않았으나, 고농도 염류 스트레스 연구에서는 Fv/Fm의 유의한 감소를 확인하였다(Qiu와 Lu, 2003).
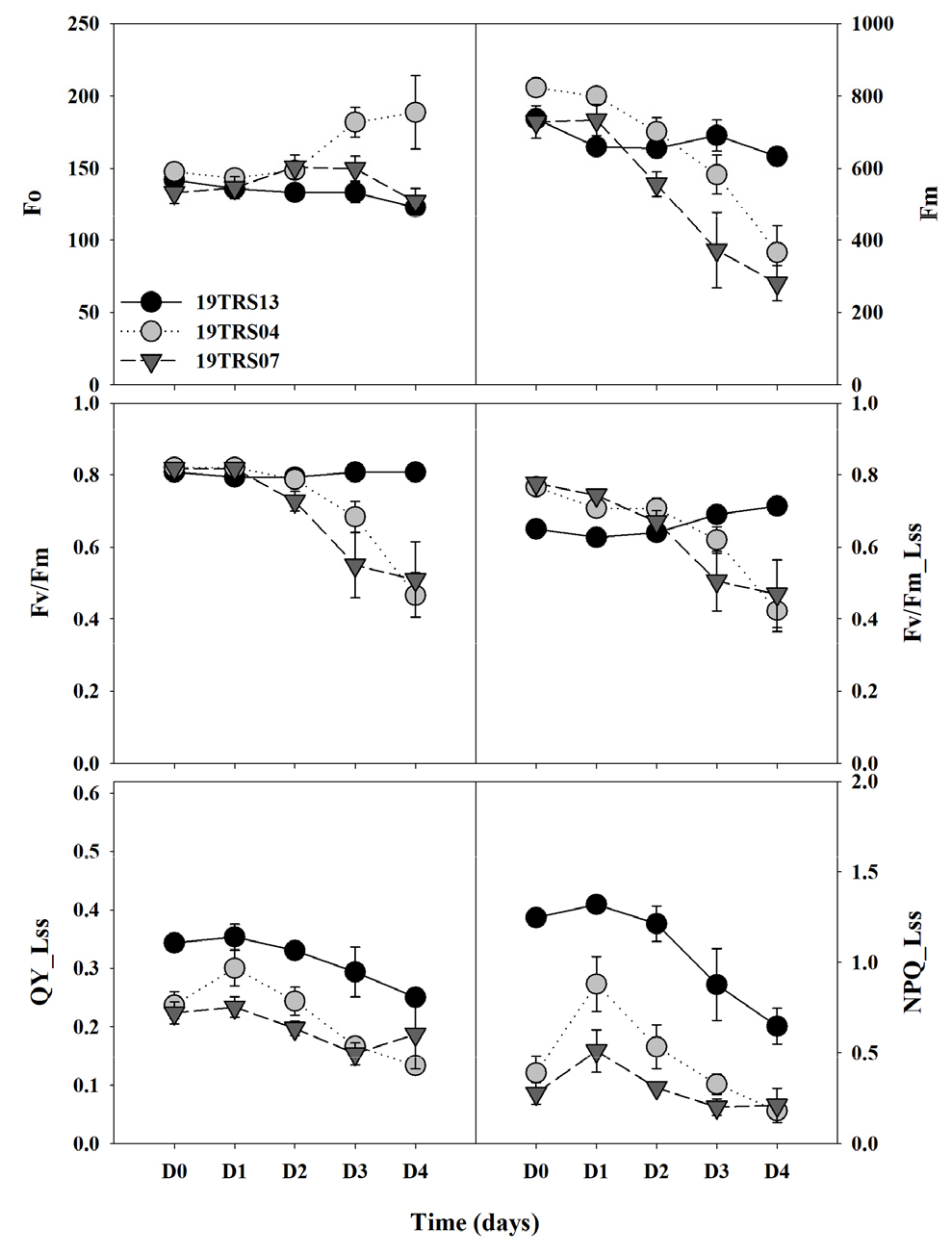
Fig. 2
Changes in the chlorophyll fluorescence (CF) parameters of tomato genetic resources during the different stress time. Description of each CF parameter is presented in table 1. D0, D1, D2, D3, and D4 represent the 0, 1, 2, 3, and 4 days after the salinity stress treatment, respectively. Each value represents the mean ± SE of three biological replications.
식물은 광합성에 이용되는 빛에너지 외에 잔여 에너지는 형광과 열로 방출된다고 알려져 있다(Ruban, 2016). 특히 염류, 건조 등 다양한 스트레스에 노출될 경우 광합성 기구의 보호기능(비광화학적 형광소멸, NPQ)이 작동한다고 알려져 있다(Murchie와 Lawson, 2013). 일반적으로 NPQ는 스트레스에 노출될 경우, 증가한다고 알려져 있으나 본 실험에서는 고농도의 염류 스트레스(NaCl 400mM)로 인해 NPQ가 지속적으로 감소됨을 확인하였다. NPQ의 감소는 상대적으로 단기간 동안 대량 유전자원의 염류 스트레스 수준을 평가하기 위해 고농도의 염류 스트레스 처리에 따른 영향으로 판단되며, 이는 오이, 토마토를 대상으로 염류 스트레스를 부여한 연구 결과, 고농도의 염류 스트레스는 광합성 기능에 피해를 주었기 때문으로 판단되며 본 연구 결과와도 유사한 것을 확인하였다(Shin 등, 2020a; Shin 등, 2020b; Zhu 등, 2019).
염류 스트레스에 영향을 받은 유전자원의 qN_Lss, qP_Lss, qL_Lss 및 Rfd_Lss를 통해 염류 저항성과 감수성 유전자원 간의 차이를 구분할 수 있었으나, 중도저항성 유전자원과 감수성 유전자원 간의 차이를 구분하기 어려운 것으로 나타났다(Fig. 3). qP_Lss는 광합성 시 광계Ⅱ의 가변 형광의 광화학 소광 수준을 나타내며, 일반적으로 광계Ⅱ의 전자전달 수송 활성과 QA의 환원 상태를 반영한다(Backhausen 등, 2005). 즉, 빛에 노출된 식물체의 광계Ⅱ 내 반응센터의 빛에너지 활용 수준을 나타내며, 실제 빛에너지 이용 효율을 나타낸다(Prinzenberg 등, 2018). 이러한 결과는 염류 스트레스에 의해 QA의 산화능력과 광계Ⅱ의 전자전달 활성이 감소된 연구결과와 일치하였다(Nan 등, 2018).
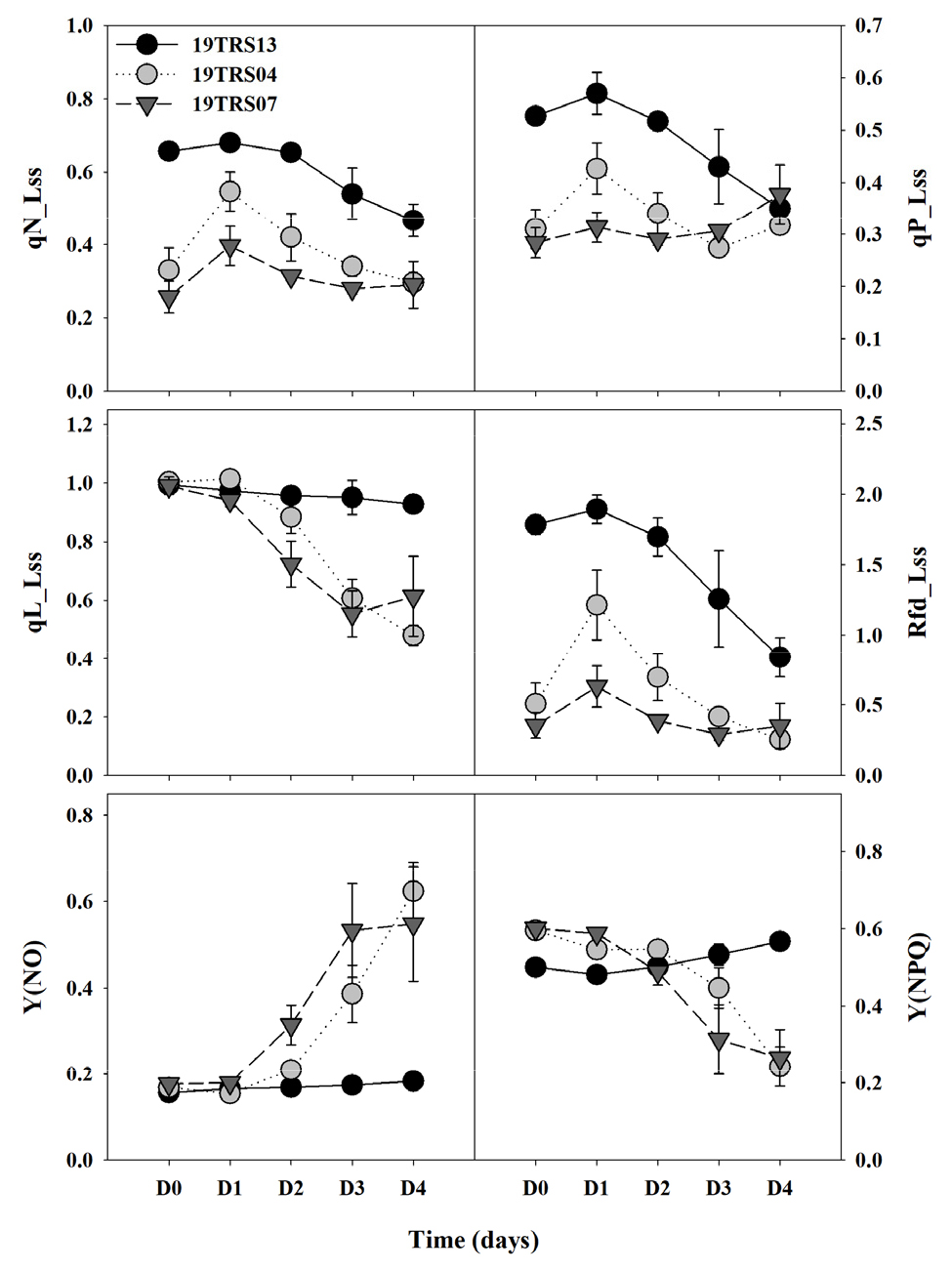
Fig. 3
Changes in the chlorophyll fluorescence (CF) parameters of tomato genetic resources during the different stress time. Description of each CF parameter is presented in table 1. D0, D1, D2, D3, and D4 represent the 0, 1, 2, 3, and 4 days after the salinity stress treatment, respectively. Each value represents the mean ± SE of three biological replications.
Rfd_Lss(엽록소 형광 감소비율, the fluorescence decrease ratio)는 광합성 활성 상태를 확인할 수 있으며, 수분 스트레스 탐지, 광합성 수준에 관한 연구에 적용할 수 있다(Lichtenthaler 등, 2007). 염류 스트레스로 인해 각각의 유전자원의 qN_Lss, qP_Lss 및 Rfd_Lss는 감소하는 경향을 보였으며, 이는 다른 작물 대상으로 염류 스트레스 평가한 연구결과와 유사하였다(Kalhor 등, 2018; Adhikari 등, 2019). 본 연구결과를 통해 염류 스트레스의 영향으로 일부 매개변수의 감소를 확인하였으나, 유전자원 간의 염류 스트레스 내성 차이의 명확한 평가에는 활용이 어려울 것으로 판단된다. 본 연구결과에서 해당 매개변수의 감소는 염류 스트레스 영향에 따른 광합성 기능 비활성화로 인한 것으로 선행 연구결과와 유사하였으며, 이러한 엽록소형광 매개변수의 차이는 각각의 엽록소형광 매개변수 반응, 작물 및 스트레스 유형에 따라 광계Ⅱ의 최대 효율이 다르기 때문으로 판단된다(Lu와 Zhang, 2000; Prinzenberg 등, 2018; Nan 등, 2018; Najar 등, 2019).
qL_Lss는 lake 모델을 기반으로 광계II 반응 센터의 광화학 효율을 나타내며, 개방 상태에서의 광계II의 비율을 반영하기 때문에 Y(PSII) 매개변수와 높은 상관 관계가 있는 대표적인 매개변수이며, 염류 스트레스 하에 감소한다고 알려져 있다(Tsai 등, 2019). 연구결과를 통해 qL_Lss와 Y(NO)는 반대되는 경향을 보였으며, 염류 감수성 유전자원은 Y(NO)와 동일하게 염류 스트레스 처리 D2에서 감소하였다. 이러한 결과는 광계II의 광에너지 효율을 나타내는 qL_Lss, Y(NO) 및 Y (PSII)와의 상관관계에 따른 연관성으로 판단된다. 본 연구결과를 통해 qL_Lss와 Y(NO)를 토마토 유전자원의 염류 스트레스 수준을 평가할 수 있는 엽록소형광 매개변수로 판단되나, 이전 선행연구 결과를 바탕으로 연관성이 보다 높은 Y(NO)를 선발하였다.
일반적으로 Y(NO)는 광합성 반응 센터 내의 총 에너지 분포를 나타낸다(Tsai 등, 2019). 염류 스트레스 처리 기간 동안 내에 염류 스트레스의 저항성 유전자원으로 판단되는 19TRS13의 Y(NO)는 일정하게 유지되었으며, 상대적으로 염류 스트레스에 약하다고 판단되는 19TRS04와 19TRS07의 Y(NO)는 2일차부터 유의적으로 증가하였다. 또한 육안판단이 정확하게 이루어지지 않은 D2 시점에 염류 스트레스에 감수성 19TRS07과 염류 저항성으로 판단되는 19TRS13이 Y(NO) 지수의 변화에 의해 유의적으로 구분됨을 확인하였다. 일반적으로 스트레스에 노출된 식물체의 Y(NO)는 증가하며, 이는 광계Ⅱ의 광화학 효율 및 기능이 저하되고, 또한 염류 스트레스에 노출될 경우 증가한다는 기존의 연구결과와 일치하였다(Sánchez-Moreiras 등, 2020; Shin 등, 2020).
본 연구에서 집중적으로 평가한 12개의 엽록소형광 매개변수 중 토마토 유묘의 염류 스트레스 수준의 판별이 가능했던 광계Ⅱ의 비조절 에너지 소산 양자 수율[Y(NO)]에 대해서 49점 유전자원간 차이를 분석하였다(Fig. 4). 대부분의 유전자원은 염류 스트레스 처리 초기 단계인 D1 시점에 Y(NO) 매개변수의 변화가 없었으며, D2 시점에는 일부 염류스트레스에 민감한 유전자원에서 Y(NO)가 증가하였다. 염류 스트레스 처리 후 D2 시점부터 49점의 유전자원 중 염류 스트레스에 저항성이 있다고 판단되는 19TRS11, 19TRS19 및 19TRS20 등은 Y(NO)의 변화가 없었으며, 상대적으로 염류 스트레스에 감수성 유전자원인 19TRS07, 19TRS06 및 19TRS08은 증가하였다. 이러한 Y(NO)의 유전자원별 반응 차이는 기존 염류 스트레스에 따른 엽록소형광 매개변수 측정 연구결과와 유사하였다(Shin 등, 2020a; Shin 등, 2020b). 따라서 Y(NO)는 염류 스트레스 처리 후 D2 시점에 다른 엽록소형광 매개변수에 비해 명확하게 유전자원 간의 염류 스트레스 수준을 평가 할 수 있는 매개변수로 판단되며, 향후 qL_Lss 매개변수에 대해서 추가적인 연구가 필요하다.
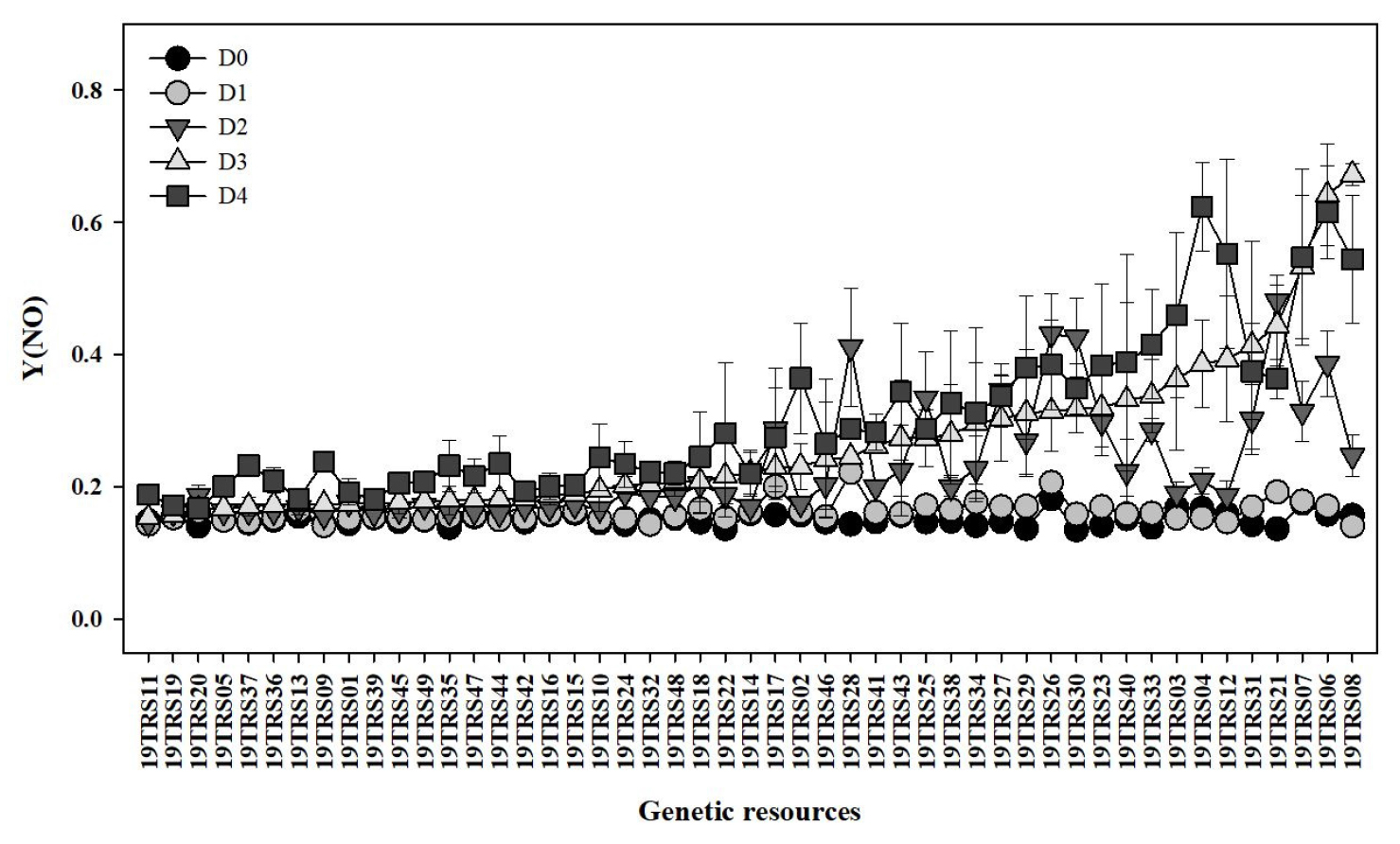
Fig. 4
Changes in the quantum yield of non-regulated energy dissipation in PSII [Y(NO)] of tomato genetic resources during the different stress time. D0, D1, D2, D3, and D4 represent the 0, 1, 2, 3, and 4 days after the salinity stress treatment, respectively. Each value represents the mean ± SE of three biological replications.
본 연구결과로, 토마토 유전자원의 유묘 단계에서의 염류 스트레스 수준을 보완적으로 평가할 수 있을 것으로 판단되는 매개변수로서 Y(NO)를 선발하였다. 광합성 반응 센터 내의 총에너지 분포를 나타내는 Y(NO)는 염류 스트레스 처리 후 초기 단계에서 염류 스트레스에 저항성을 지닌 유전자원과 저항성이 없는 감수성 유전자원 간의 차이를 객관적으로 확인할 수 있었다. 본 연구는 토마토 유전자원의 유묘 단계에서의 염류 스트레스 수준 평가를 위한 엽록소형광 매개변수 선발의 선도적인 연구로 판단된다. 향후 다양한 비생물적 스트레스의 수준을 판별할 수 있는 엽록소형광 매개변수의 선발 관련 연구가 추가적으로 필요할 것으로 판단된다.




