서 론
재료 및 방법
1. 재배 및 재배환경
2. 실험 처리
3. 수질 분석
4. 광합성 특성
5. 엽록소 형광 반응 특성
6. 생육 특성
7. 통계 분석
결과 및 고찰
1. 사육수 및 배양액 pH 및 EC 변화
2. 사육수 및 배양액 무기이온 변화
3. 광합성 및 엽록소 형광반응 특성
4. 생육 특성
서 론
아쿠아포닉스(Aquaponics)는 물고기 사육 수조의 영양분이 식물재배에 필요한 영양소를 공급함으로써 양어(Aquaculture)와 수경(Hydroponics)이 병합된 재배 방식으로 자연 생태계와 흡사한 영양 순환 시스템이며, 지속 가능한 농업 시스템의 하나이다(Francis 등, 2003). 아쿠아포닉스 사육수로 식물과 물고기를 동시에 재배할 경우 물 소비량을 감소시키고 식물 영양소로 공급하는 화학비료를 사용하지 않아 환경오염을 감소시킬 수 있다(Rakocy 등, 2006). 국내외 가정이나 학교에서 취미나 교육용으로 활용되어왔던 아쿠아포닉스는 최근 도심에서 식량 생산을 가능하게 하는 기술로 인식되어 유럽서 ‘우리 삶을 바꿀 수 있는 10가지 기술’ 중 하나로 선택되었으며(Van Woensel 등, 2015), 지속 가능한 안전한 먹거리 생산 농법에 대한 소비자의 관심이 높아지면서 상업적으로 발전하고 있다. 최근 소득수준의 향상과 건강에 대한 소비자들의 관심도가 증가함에 따라 건강에 좋은 웰빙 식품 중 하나로 산채에 대한 선호현상이 나타나고 있다(Byun과 Seok, 2019). 국내에서 산채 재배면적규모는 2020년 기준 노지는 35,947ha, 시설은 1,477ha이며(Kosis, 2021), 생산액은 2017년 기준 약 4천억원으로 생산량 및 생산액은 꾸준히 증가하고 있다. 소비자 조사 결과 산채를 구입할 때, 신선도와 원산지, 안전성 등을 중요하게 고려한다는 결과가 나왔다(Byun과 Seok, 2019).
갯기름(Peucedanum japonicum T.)은 미나리과(Umbelliferae)의 다년초이며, 뿌리를 식방풍, 해방풍이라 하여 한약재로 이용되며, 잎은 새싹·쌈채, 건나물, 분말, 장아찌, 차 등으로 다양하게 활용되고 있다. 지금까지 갯기름에 대한 연구는 노지재배 갯기름의 성분 및 화합물(Kim 등, 2008), 피복에 따른 연구(Kim 등, 2001; Park 등, 1995), 차광과 부엽토 처리에 따른 생육(Song 등, 2016), 식물 공장 내 인공 광원 재배(Heo 등, 2013)등으로 아쿠아포닉스라는 새로운 친환경적 농법에 관한 연구는 없는 실정이다. 국내외에서 아쿠아포닉스 연구는 주로 상추(Lee 등, 2020), 청경채(Zou 등, 2016) 바질(Filep 등, 2016), 토마토(Yang과 Kim, 2020)등으로 그 대상이 주로 엽채류 또는 과채류로 채소 작물로 국한되어 있고 산에서 나는 나물류인 산채에 대한 아쿠아포닉스 연구자료는 없는 실정이다. 식물공장형 아쿠아포닉스로 재배하는 경우 일반 수경재배나 토양재배에서 사용하는 화학비료가 아닌 물고기에서 발생되는 유기물이 다양한 미생물 작용에 의해 무기화된 영양분으로 공급되고 이상기후나 황사 등의 외부 환경과 차단된 공간 내에서 작물에 적합한 생육환경조건을 제공하여 계절에 관계없이 연중 안전하게 생산할 수 있다. 실내 식물공장 시스템에서 환경제어를 위해 소요되는 에너지 소비량은 크지만 물 사용량과 재배 면적과 같은 자원 사용의 측면에서는 일반 온실보다 생산성이 높으며(Graamans 등, 2018), 도심 아쿠아포닉스 농장의 경우 도시에서 사용하지 않는 건물이나 공간 등을 재활용하는 경우 비용을 절감할 수 있다. 따라서 본 연구는 안전한 먹거리뿐 아니라 환경문제에 대한 대안으로 연중 생산이 가능한 식물공장형 아쿠아포닉 시스템에서 수질변화에 내성이 강한 비단잉어와 갯기름을 재배하여 수경재배 시스템에서 재배된 갯기름과 광합성 및 생육 특성을 비교함으로써 화학비료를 사용하는 수경재배를 대체할 가능성 알아보고자 하였다.
재료 및 방법
1. 재배 및 재배환경
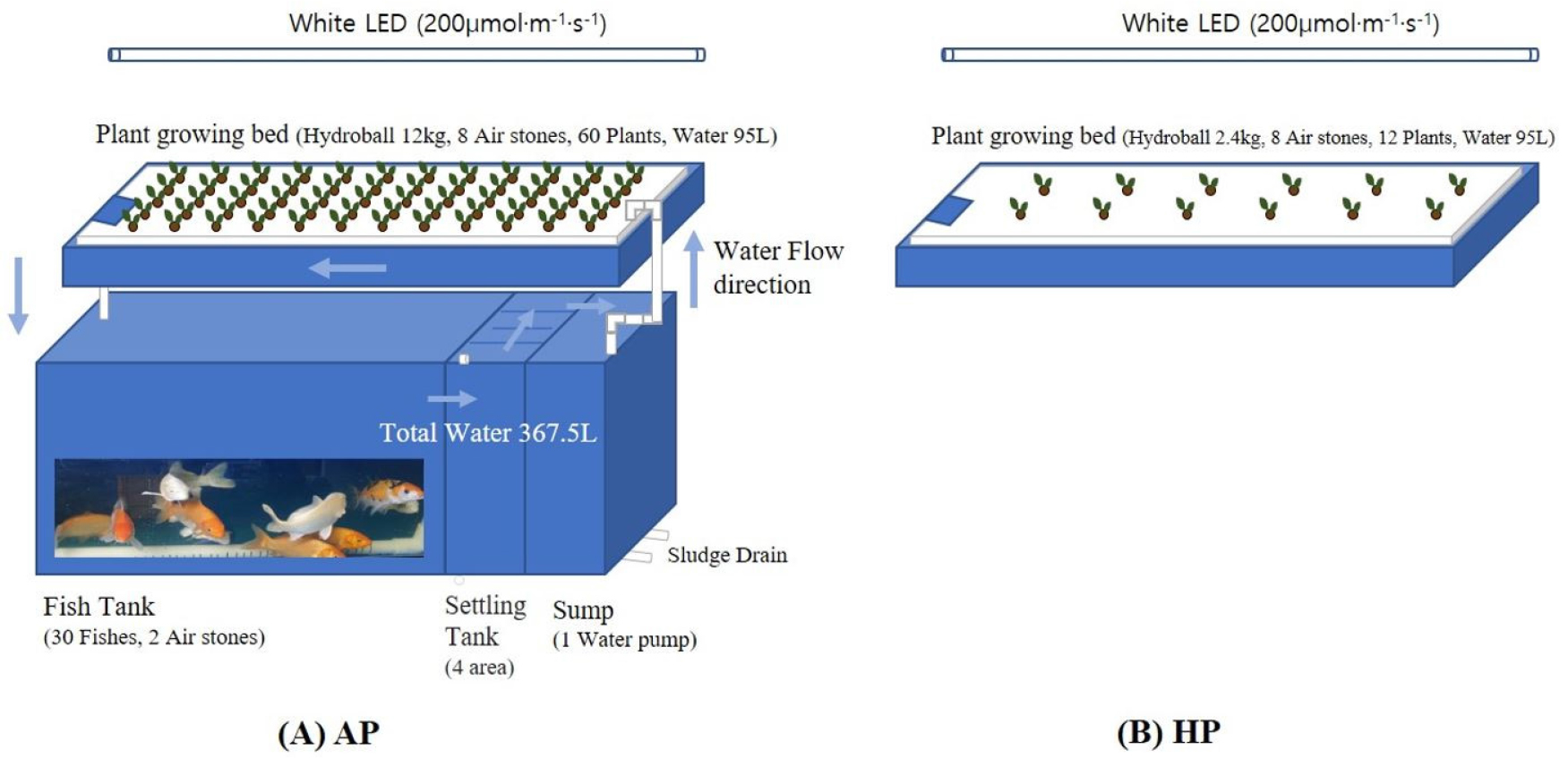
본 실험은 2021년 4월 26일부터 8월 30일까지 파종부터 재배까지 전과정을 온도 20 ± 1℃, 상대습도(Relative Humidity, RH) 50 ± 5%가 유지되는 한국방송통신대학교 농학과 항온항습실에서 수행하였다. 공시재료는 강원도 산채연구소에서 분양 받은 갯기름(Peucedanum japonicum T.) 종자를 사용하였다. 종자는 파종 전 70% 알코올에 1분간 소독 후 흐르는 물에 24시간 침지 후 물기를 제거하여 4℃에 14일 이상 습윤 저온 처리하였다. 육묘는 온·습도가 제어되는 항온항습실 내에서 128구 트레이에 질석(Han Areum, Shinseong Mineral Co. Ltd., Korea)을 충진 후 최아된 종자를 1셀에 1립씩 파종한 후 White LED(180μmol·m-2·s-1) 광조건에서 광주기 12H/ 12H(명기/암기)로 설정하여 수행하였다. 관수는 파종 후 10일 동안은 수돗물을 공급하였고 이후 시판되는 배양액(Mulpure, Daeyu Co.LTD, Korea; A액: N 5.5%, K 4.5%, Ca 2%, B 0.00014%, Fe 0.03%, Zn 0.0001%, Mo 0.0002%, B액: N 2.5%, P 2.2%, K 5.3%, 고토 1%, Mo 0.007%, B 0.05%, Zn 0.003%, Cu 0.0007%)의 pH와 EC를 각각 pH 6.5, 0.8dS·m-1 수준으로 조정하여 공급하였다. 정식은 파종 33일 후, 아쿠아포닉스의 식물 재배조(0.7m(W) × 1.5m(L) × 0.22m(H), 95L)에 하이드로볼(De joheun hwangtoball, Junghan green Tech Co. Ltd., Korea) 200g 충진한 네트포트(Hydroponic Net pot, Sein Co. Ltd., China, 10 × 6.8 × 7cm)에 하였으며 정식 후 측정된 초장은 5.58 ± 0.7cm, 엽병장은 3.92 ± 0.5cm, 엽장은 1.66 ± 0.3cm, 엽폭은 1.32 ± 0.1cm, 엽수는 2 ± 0개였다.
정식 후 온도와 습도는 각각 20 ± 1℃, 50 ± 5%로 설정하였고 광도는 White LED로 200μmol·m-2·s-1, 광주기는 정식 후 7일까지 12H/12H(명기/암기)로 설정하였고 이후에는 16H/8H로 하였다. 산소 공급은 저압 분산기를 식물 재배조에 8개씩, 사육조에 2개씩을 에어펌프(LP-60A, Kosung Valve Co., LTD, Korea)에 연결하여 24시간 공급하여 전 재배기간 동안 포화용존산소량이 9-12mg·L-1을 유지되도록 하였다. 모든 실험 기간 증발산으로 인해 손실된 물 또는 양액은 보충되었다. 아쿠아포닉스 재배구는 24시간 이상 받아 둔 수돗물로 주1회 감소된 물량을 측정 후 보충되었고, 수경 재배구는 배양액(EC 1.3dS·m-1, pH 6.5)을 보충하였다. 물고기는 수온 및 pH 등 수질변화에 내성이 강하여 다른 관상어에 비해 재배하기가 용이한 것으로 보고되고 있는(Kim과 Lee, 2015) 비단잉어(Cyprinus carpio L.) 30마리(총 어체중 4.45kg)을 수원시 소재 도매상에서 구입하였다. 사료(Premium 1C, Woosung Inc., Seoul, Korea)는 1일 2회 어체중의 1%를 공급하면서 10.6 kg·m-3 밀도로 사육하였다. 사료 성분은 수분 8.8% 이하, 조단백질 47.21%, 조지방 6.82%, 조섬유 1.21%, 조회분 10.93%, Ca 2.62%, P 1.91%, Mg 0.22%, K 0.08%, Fe 0.04%이며 동물성 단백질류(어분, 어즙흡착사료) 배합비율은 64%이상, 식물성 단백질류(대두박, 옥수수글루텐) 20%이상, 곡류(소백분) 10%이하, 보조사료(비타민(C, E), 염화콜린, 유화제) 5%이하, 유지류(어유) 1.0%이상으로 구성되었다. 물고기를 입어 후 수조액 EC 농도가 수경 재배구와 같은 1.3dS·m-1 수준이 될 동안 사육한 후 식물을 정식하였다. 실험 기간 중 수온은 최대 24.7℃, 최저 18.6℃ 범위에서 식물과 물고기를 재배하였다(자료 미제출).
2. 실험 처리
실험 처리는 아쿠아포닉 시스템(AP)과 비교하기 위한 대조구로 수경 재배구(HP)를 설정하였다. AP 시스템은 367.5L의 사육조((0.7m(W) × 1.5m(L) × 0.4m(H))에 비단잉어 30마리(총어체중, 4.45kg)로 10.6kg·m-3 밀도로 사육하였으며 시스템 상단의 식물 재배 베드(0.7m(W) × 1.5m(L) × 0.22m(H))에 스티로폼 정식판(140 × 60, Ø7 5줄)을 설치하고 갯기름 60개체를 정식하였다. 수조액은 섬프 탱크(SUMP TANK)에 볼탑으로 수위가 제어되는 수중모터(GSP-100G, GMPUMP Co., LTD, Korea)를 사용하여 식물 재배 베드로 순환되도록 하였다. 수경 재배구(HP)는 아쿠아포닉 시스템과 같은 식물 재배 베드(0.7m(W) × 1.5m(L) × 0.22m(H))에 수경 배양액(Mulpure, Daeyu Co. LTD, Korea)을 EC 1.3dS·m-1, pH 6.5로 조성하여 채우고 스티로폼 정식판(1.4m × 0.6m, Ø7 5줄)에 같은 재식 간격으로 갯기름 12개체를 정식하였다(Fig. 1).
3. 수질 분석
사육수 및 배양액 pH, EC는 매일 1회 Multiparameter(PC Tester 35, Oakton, IL, USA)로 측정하였고, 무기 성분(NH4-N, NO2-N, NO3-N, PO4-P, K, Ca, Mg)은 무기 이온 측정기(Auto CG200, Cleangrow, UK)로 3일 또는 4일 간격으로 측정하였다.
4. 광합성 특성
광합성은 정식 후 33일, 38일째 광합성이 활발한 오전 10–12시 사이에 광합성 측정기(LI-6400XT, Li-COR, Lincoln, NE, USA)를 이용하여 처리별로 생장점에서 아래로 3번째 잎을 6개체에서 선택하여 6반복으로 간주하고 측정하였다. 본 실험이 수행된 항온항습실의 온도는 20 ± 1℃, RH는 50 ± 5%, 아쿠아포닉스 시스템의 광은 White LED 180μmol·m-2·s-1 조건으로 광합성 측정도 같은 항온항습실에서 진행되어 광합성을 측정하기 위해 다음과 같이 설정하였다. 광량은 인공광원(red and blue light emitting diodes, LED)을 이용하여 PAR 200µmol·m-2·s-1로 조절하였고, CO2 농도는 400µmol·mol-1, 온도는 20°C로 설정하였으며, 상대습도는 별도로 세팅하지 않았지만 측정 시간 동안 50-60%를 유지하였다. 기공전도도(Stomatal conductivity, Cond), 세포내 이산화탄소농도 (Intercellular carbon dioxide concentration, Ci), 증산률 (Transpiration rate, Trmmol), 잎과 대기의수증기압차(Leaf to air vapor pressure deficit, VpdL)를 측정하였고 이 값을 이용해 광합성에 대한 수분이용효율(Water Use Efficiency: WUE = μmolCO2/mmol H2O = net photosynthesis rate (Pn)/transpiration rate (E))이 계산되었다(Ashraf 등, 1994).
5. 엽록소 형광 반응 특성
엽록소 형광 반응은 엽록소 형광 측정기(FP110/D, Photon System Instruments, Czech Republic)을 이용하여 생장점에서 3번째 잎에 Leaf clip을 장착하여 30분간 암 처리 후 5초간 청색 470nm LED를 조사하여 측정하였다(Stirbet & Govindjee, 2011; Oh 등, 2014). 측정 시기는 정식 후 34일, 정식 후 74일에 처리별 3반복으로 측정하였다.
6. 생육 특성
생육 특성은 정식후 4, 34, 54, 74일에 초장, 엽장, 엽폭, 엽수, SPAD(SPAD-502 meter, Konica Minolta, Japan)를 측정하였고, 정식일과 최종 수확일(정식 후 74일)에는 두처리 모두, 정식 후 23일, 33일은 AP처리의 지상부 및 지하부 생체중 및 건물중, 엽면적(LI-3100 area meter, LI-COR inc. USA)을 측정하였다. 생체중은 수확 후 지상부와 지하부로 분리하여 전자 저울(HS410A, Yousheng, Shanghai, China)로 측정하였고, 생체중 측정 후 건물중은 65℃ 건조기(HB-504F-0, Hanbaek Science Inc., Bucheon, Korea)에 72시간 동안 건조 후 무게를 측정하였다. S/R율(Shoot/root ratio, S/R), 엽면적율(Leaf area ratio, LAR(cm2 ·g−1) = 엽면적(cm2)/줄기와 잎의 총건물중(g)), 함수율(Moisture content (%) = ((식물체 총생체중–식물체 총건물중)/총생체중) × 100)을 계산하였다. 상대생장률(Relative Growth Rate, RGR)은 정식 후 74일까지의 생장율을 6개체에 대해 지상부 및 지하부 건물중을 다음 식에 대입하여 계산하였다. RGR = Ln(W2) - Ln(W1)/t2-t1. (W2: 정식 후 74일째 식물체 건물중(g), W1: 정식 시 식물체 건물중(g), t2: 74일, t1: 0일) (Hoffmann과 Pooter, 2002)
7. 통계 분석
생육 및 광합성은 각 처리마다 6 반복한 평균값으로, 엽록소 형광 반응은 각 처리마다 3 반복한 평균값으로 각 처리간 통계적 유의성 검정은 SAS(Statistical Analysis System, V9.4, Cry, NC, USA)프로그램을 이용하여 t-test로 검증하였다.
결과 및 고찰
1. 사육수 및 배양액 pH 및 EC 변화
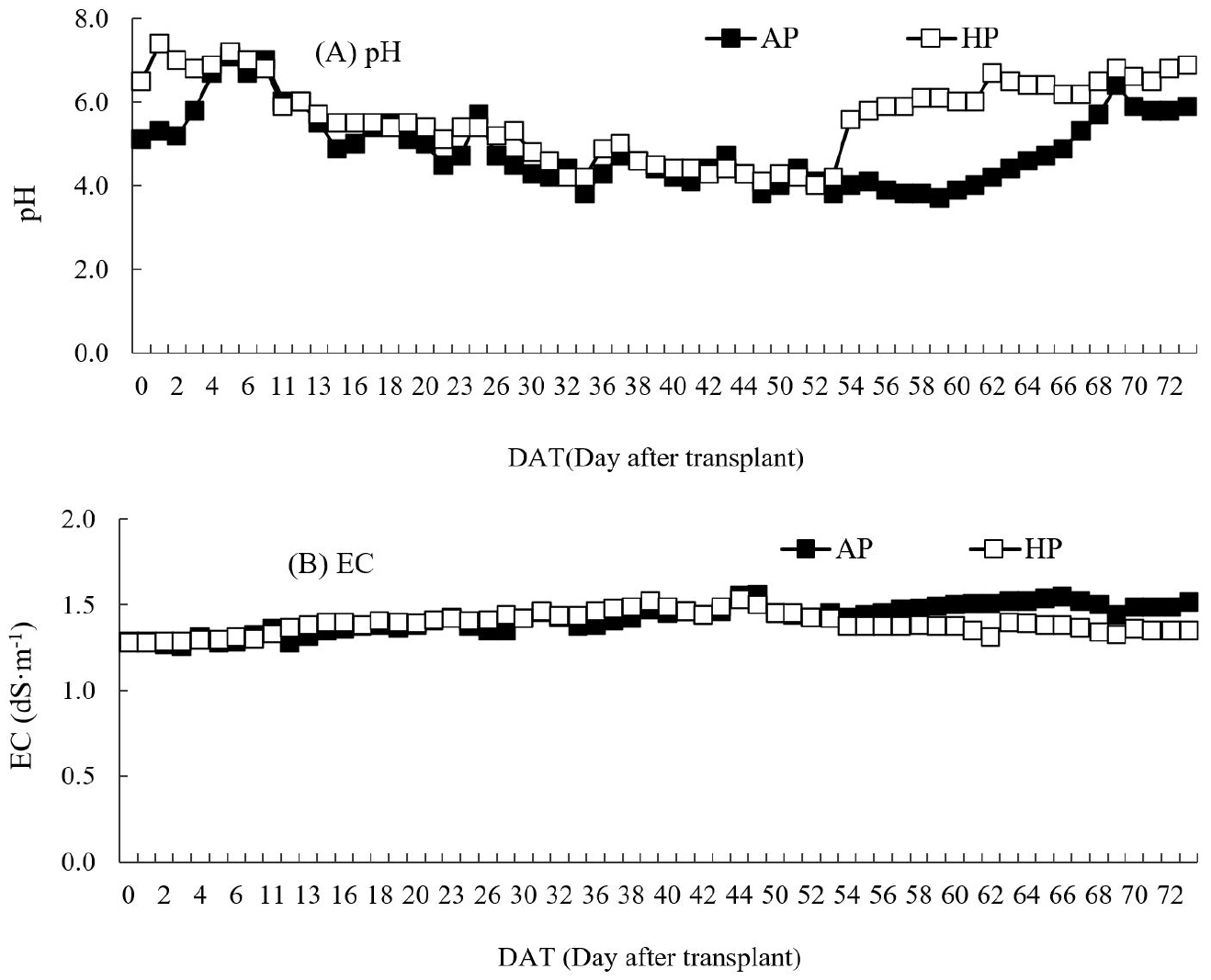
전 재배기간 동안 pH는 AP의 경우 pH 4.0-7.1, HP는 pH 4.0-7.4 수준을 보였다(Fig. 2A). 일반적으로 아쿠아포닉스에서 질산화 박테리아 활동을 위한 적정 pH는 7.5-9.0 수준이나(Hochheimer과 Wheaton, 1998) 물고기 배설물의 유기태질소가 질산화균에 의해 질산태질소(NO3-N)로 전환되는 질산화과정(nitrification)에 따른 H+ 이온 축적과 무기화과정에서 CO2 축적으로(Schreier 등, 2010) pH가 낮아진다. AP 재배구의 pH는 NO3-N의 증가에 따라 감소하기 시작하여 pH 5.5 이하는 정식 후 15-67일 동안 지속되었다. HP의 경우 KOH로 pH를 보정해주지 않았던 정식 후 20-53일 동안 pH 5.5 이하로 유지되었다. 일반적으로 아쿠아포닉스에서 pH는 질산화과정으로 시간이 지남에 따라 자연적으로 내려가지만, 화학적으로 조절하고 조정하는 수경재배와는 다르고 화학적 조절로 인한 갑작스러운 변화는 물고기에 피해를 줄 수 있어서 본 실험에서는 자연적 변화를 보정하지 않았다. AP 재배구에서 암모늄태 질소(NH4-N)는 정식 후 30일 이후 증가를 보여(Fig. 3A) pH가 낮은 조건에서도 수조 내 암모니아(NH3)가 암모늄태 질소(NH4-N)로 전환된 것으로 보이고 비단잉어가 사료를 지속적으로 섭취하고 활발하게 생존한 것으로 보아 NH3 독소가 축적되지 않은 것으로 판단된다(Purwono 등, 2017). 갯기름의 서식지는 해안사구 사토로 pH는 7.4-9.0 범위로 평균 8.4의 약알칼리성 토양에서 자생한다고 보고하였는데(Kang 등, 2017), 본 실험에서는 정식 후 13-64일 동안, pH 4.0 내외의 낮은 수준으로 재배되었다. 뿌리 세포의 효소 활성은 H+의 농도에 따라 영향을 받으며, pH가 낮아짐에 따라 옥신(Auxin)의 활성이 낮아 발근이나 뿌리의 신장이 저해된다고 하였다(Inoue 등, 2016). 하지만, 본 실험에서 AP 재배구에서 자란 갯기름의 뿌리 신장 발달에 부정적 영향이 관찰되지 않았는데(Fig. 5), 이 결과는 재배 시작 시점부터 pH가 낮은 것이 아니라 시간이 경과함에 따라 점차 낮아진 것과 관련이 있는 것으로 보인다. Tyson 등(2008)도 아쿠아포닉스에서 pH는 7.5-8.0 수준이 필요하지만 오이재배 실험에서 pH를 5.0까지 낮춰도 수량 차이가 없었다고 하였다. 양어에서 pH를 높이기 위해 NaHCO3, NaOH 또는 CaCO3, Ca(OH)2, CaO 등이 사용되나 Na+나 Ca2+이 축적되는 단점이 있다(Masser 등, 1992). Lee(2021)는 비단잉어를 대상으로 하는 엽채류 아쿠아포닉스 재배에서 pH가 6.0 이하로 하강함에 따라 굴패각으로 가공된 패화석 비료 10kg을 60L 물에 24h 동안 우려내어 각 수조당 1.5 L씩 첨가하여 pH 6.0 내외 범위를 유지하였다고 하였다. 앞으로 물고기 종류에 따른 적정 알칼리 물질 농도 구명도 필요할 것으로 보인다.
EC(Electrical conductivity)는 AP의 경우는 사육수를 보충하는 시점에 잠시 하락하는 것을 제외하고 정식 후 49일에 1.56dS·m-1 농도를 보이고 실험 종료일까지 1.53dS·m-1 유지하였으며 HP는 44DAT에 1.53dS·m-1 수준까지 높아지고, 그 이후 1.35dS·m-1로 유지되었다(Fig. 2A).
2. 사육수 및 배양액 무기이온 변화
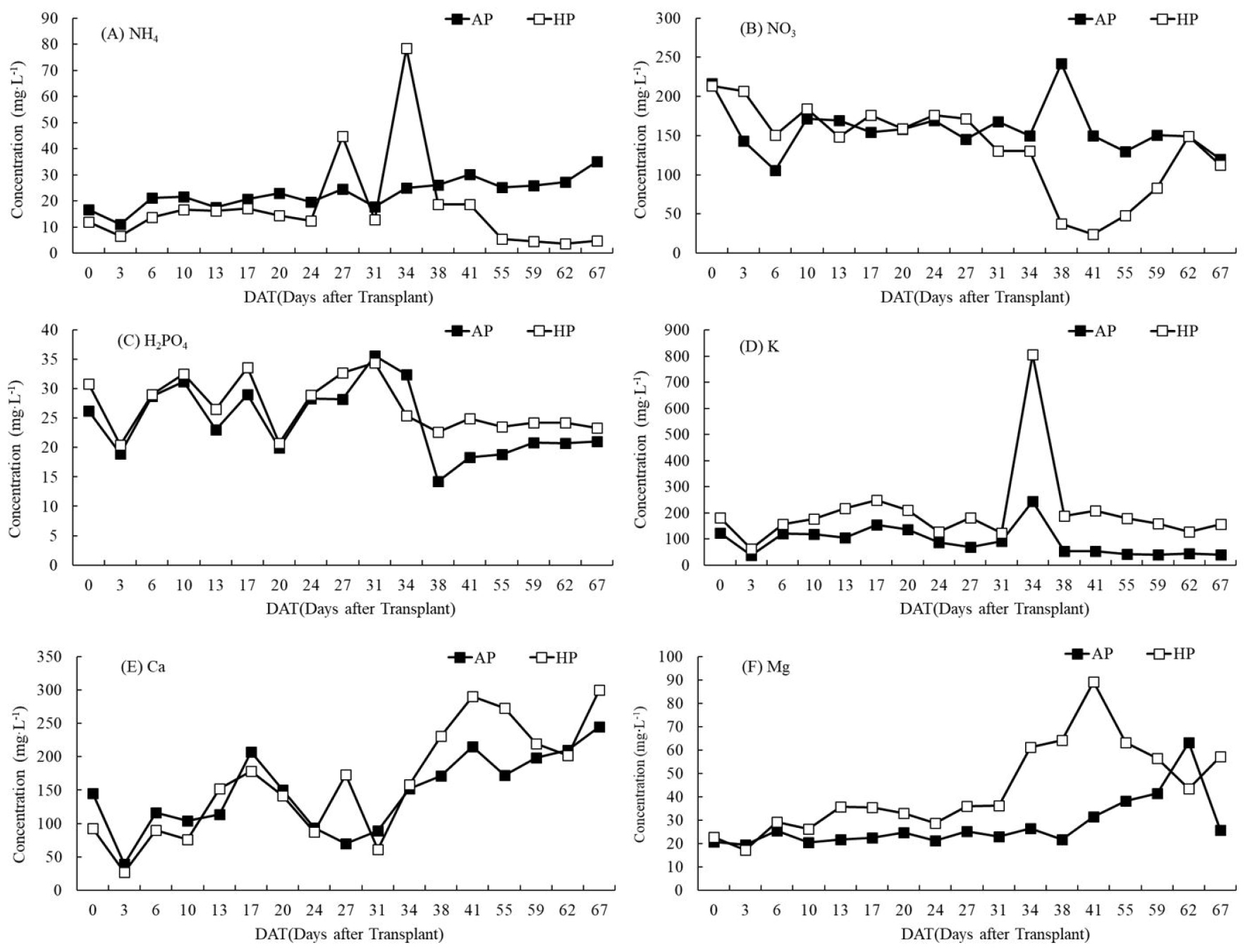
AP 재배구에서 NH4-N는 17에서 35mg·L-1, NO3-N은 120에서 242mg·L-1, 인산염(PO4-P)은 14.22 에서 35.65mg·L-1, K은 39.95에서 244mg·L-1, Ca은 69.65에서 245mg·L-1, Mg은 19.60에서 63.08mg·L-1 값을 나타냈다(Fig. 3). 정식 직후, AP 재배구의 무기이온 농도가 HP 재배구보다 농도가 높거나 비슷한 이유는 물고기를 입어 후 수조액 EC 농도가 수경 재배구와 같은 1.3dS·m-1 수준이 될 동안 사육한 후 식물을 정식하였기 때문이다. AP 재배구에서 NH4-N은 정식 후 30일 이후 증가를 보였고, NO3-N은 정식 초기에는 감소하였으나 그 후엔 증가하여 평균 160mg·L-1 값을 유지하였으며 PO4-P은 정식 후 31일까지 지속적으로 증감을 보였으나 그 후부터 평균 20.9mg·L-1 값을 유지하였다. Ca은 정식 후 24-31일에 70-94mg·L-1 값으로 감소되었으나 다시 증가되었다. 일반적으로 엽채류 수경재배 양액의 무기이온 표준 농도는 NO3-N는 123, PO4-P은 24, K은 117, Ca은 100, Mg은 18, Fe은 2.0mg·L-1로(Lee 등, 2015), 본 실험의 사육수 이온 농도가 더 높은 것으로 나타났다. Pineda-Pineda 등(2017)은 틸라피아를 25kg·m-3밀도로 사육하면서 상추를 m2당 25포기 재배하였을 때 정식 후 60일에 NO3-N, Ca, Mg 농도가 각각 105, 38.5, 38mg·L-1에 도달하였고, PO4-P와 K 농도는 정식 후 21-35일에 각각 최고 수준(15-14mg·L-1)에 도달하였으며 수경재배 배양액(Steiner Universal Nutrient Solution) 농도에 비해 NO3-N은 62%, PO4-P은 48%, K는 5%, Ca은 21%, Mg은 79% 수준이라고 하였다. 그러나 K, Ca, Cu를 제외하고 엽내 무기이온 함량이 정상 수준이었고 잎에 결핍 증상이 관찰되지 않았다고 하였다. 본 실험의 사육밀도는 10kg·m-3였는데 수조 내 무기이온 농도가 K와 Mg을 제외하고 수경재배 양액 농도보다 높았던 것은 비단잉어의 사료배합 및 배설량과 관련이 있을 것으로 보여 물고기 종류에 따른 식물 재배에 필요한 적정 사육밀도 구명이 필요할 것으로 보인다.
HP 재배구에서 NH4-N는 3.56에서 78.45mg·L-1, NO3-N은 24에서 214 mg·L-1, PO4-P은 20.40에서 34.45mg·L-1, K은 61.15에서 805mg·L-1, Ca은 27.30에서 300mg·L-1, Mg은 17.15에서 89.05 mg·L-1 값을 나타냈다(Fig. 3). AP 재배구와 비교하여 HP 양액 내 K과 Mg 농도는 높았으나 NO3-N은 오히려 낮았는데 이는 AP 재배구는 물고기 배설물의 분해에 의한 NO3-N이 지속적으로 공급된 반면 HP의 경우 감소된 배양액만 보충하여 이온 불균형이 일어난 것으로 보인다. HP 양액 내 K의 일시적 증가는 pH를 조정하기 위해 사용한 KOH와 관련이 있는 것으로 보인다.
3. 광합성 및 엽록소 형광반응 특성
정식 후 33일(7월 15일)과 38일(7월 20일)에 측정된 광합성 특성은 AP와 HP 처리간 유의차가 없었다(Table 1). 형광매개변수의 통계분석 결과(Table 2) Fv/Fm, ABS/RC, TRo/RC, ETo/RC, DIo/RC는 처리간 차이가 없었다. 광계 Ⅱ의 최대 양자수득률을 나타내는 Fv/Fm(적정범위: 0.78-0.84)은 두 처리 모두 0.84 또는 0.85의 값을 나타냈다(Table 2). Demmig과 Björkman(1987)은 스트레스를 받지 않는 잎에서는 0.83, 스트레스를 받을 경우 그 보다 낮은 값으로 광계 Ⅱ의 손상을 입었거나 불활성 상태라고 하였다. 본 실험의 결과 0.83보다 낮은 값을 보이지 않는 것으로 모두 스트레스를 받지 않는 상태인 것으로 판단된다. 하지만 광계 II 광화학지수인 PIABS가 AP 재배구에서 HP에 비해 34DAT에는 30.4%, 74DAT에는 12.0% 낮았다. 이 결과는 아쿠아포닉스 수조액의 NO3-N 농도가 지속적으로 적정 농도보다 높아진 것과 pH가 생육 적정 수준보다 낮았던 것과 관련이 있는 것으로 보인다. 아쿠아포닉스에서는 질산화세균의 작용으로 NO3-N이 꾸준히 공급된다(Wongkiew 등, 2017). 수조액의 NO3-N이 과도한 수준이 된다는 것은 박테리아에 의해 생성되는 NO3-N을 모두 흡수할 만큼 식물의 흡수 효율이 높지 않거나 물고기 재배 밀도가 높다는 것을 의미한다(Yang과 Kim, 2020). 지나치게 높은 NO3-N 수치를 조절하기 위해 재배 식물 종류에 따른 NO3-N 흡수율(uptake rate) 및 적합한 최적 농도 구명이 필요할 것으로 보인다.
Table 1.
Photosynthetic Characteristics of treatment at 33 and 38 days after transplant (DAT).
| DAT | Treatment |
Photosynthesis (μmol·CO2·m-2·s-1) |
Stomatal conductance (mol·H2O·m-2·s-1) |
Internal CO2 (μmol·CO2·m-2·s-1) |
Transpiration rate (mol·H2O·m-2·s-1) | Water Use Efficiencyy |
| 33 | AP | 8.19z | 0.62 | 355 | 4.78 | 0.172 |
| HP | 8.52 | 0.61 | 352 | 4.73 | 0.180 | |
| 38 | AP | 7.95 | 0.46 | 345 | 5.15 | 0.161 |
| HP | 7.48 | 0.62 | 355 | 6.32 | 0.118 |
Table 2.
selected parameters quantifying the behavior of PS Ⅱ by time, leaf of Peucedanum japonicum T. on 34, 74 days after transplant (DAT).
| DAT | Treatment | Fv/Fmy | PIABSx | ABS/RCw | TRo/RCv | ETo/RCu | DIo/RCt |
| 34 | AP | 0.84 | 8.7 | 1.45 | 1.22 | 0.85 | 0.23 |
| HP | 0.86 | 12.5* | 1.28 | 1.10 | 0.80 | 0.18 | |
| 74 | AP | 0.85 | 8.7 | 1.34 | 1.14 | 0.76 | 0.20 |
| HP | 0.84 | 9.9*z | 1.29 | 1.09 | 0.77 | 0.21 |
4. 생육 특성
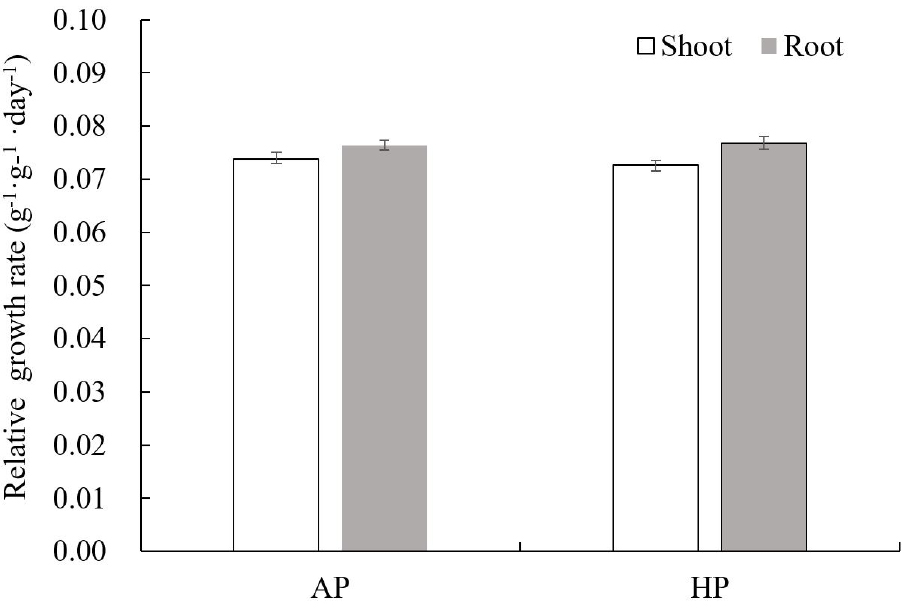
정식 후 20일 간격으로 생육 특성을 측정한 결과 두 처리간 초장, 엽장, 엽폭, 엽수 SPAD는 유의적으로 차이가 없었으나 엽병 길이가 AP 재배구에서 HP에 비해 56% 긴 것으로 나타났다(Table 3). 지상부 및 지하부 상대생장율(Relative Growth Rate, RGR)은 두 재배구에서 유의차가 없었는데 이 결과는 RGR은 건물중 값으로 얻어진 결과로 건물중이 유의차가 없었다(Fig. 4, Table 4). 다만, 엽면적율(Leaf Area Rate, LAR)만 AP 재배구에서 HP에 비해 36.43% 높았다(Table 4). 엽면적은 수광면적으로 광합성과 생육을 증가시키기 때문에 식물 생육의 중요한 동적 변수(driving variable)이다(Stanghellini 등, 2019). 재배된 갯기름의 모습은 AP 재배구에서 생육이 좋은 것으로 보였는데(Fig. 5), RGR 결과와는 일치되지 않았으나 엽면적율과 엽병 길이가 AP 재배구에서 높았던 것으로 설명될 수 있다. 일반적으로 증발산이 높은 경우 식물 전체에서 엽면적이 줄고 수분부족도 엽생장에 영향을 준다(Patane, 2011). AP 재배구에서 HP 재배구와 비교하여 통계적으로는 유의차가 없었지만, 평균 기공전도도는 더 낮았고 평균 수분이용효율은 더 높았던 결과(Table 1)와 LAR이 더 높았던 결과는 연관성이 있는 것으로 보인다. 실제 수조에 줄어든 수분을 채워주면서 측정한 수분소모량은 AP 재배구에서 더 적었다(자료 미제출). AP 재배구에서 기공전도도와 증산율이 낮아 수분소모가 적었던 결과가 LAR을 높인 것으로 보인다. AP 재배구에서 생육 적정 수준보다 낮은 수조액 pH가 기공전도도와 증산율에 영향을 주었을 가능성도 있다. Zhang 등(2014)은 pH 3.0 수준에서 순광합성율, 증산율, 엽록소 형광반응의 변수인 quantum yield of the photosystem II (PSII) electron transport(ΦPSII)이 감소되었다고 하였다. 또한, 아쿠아포닉스에서 작물 생육은 작물의 영양분 요구량과 물고기 수조에서 생산되는 영양분의 일치(Bosma 등, 2017)와 수조내의 영양분 가용성과 흡수 용이성과 관련이 있다고 하였는데(Liang과 Chien, 2015), AP 재배구에서 NO3-N 농도가 높았던 것도 관련 있는 것으로 보인다.
Table 3.
The plant height, petiole length, leaf length, leaf width, leaf number and chlorophyll content measured by a SPAD meter at 4, 34, 54, 74 days after transplant (DAT).
| DAT |
Treatment (A) |
Plant height (cm) |
Petiole length (cm) |
Leaf length (cm) |
Leaf width (cm) |
Leaf number (ea) |
SPAD (values) |
| 4 | AP | 7.62 | 4.48 | 3.14 | 3.14 | 2.4 | - |
| HP | 7.08 | 4.00 | 3.08 | 3.08 | 2.0 | - | |
| 34 | AP | 18.82 | 11.20 | 7.62 | 13.36 | 6.7 | 48.16 |
| HP | 16.22 | 9.00 | 7.30 | 12.80 | 6.2 | 46.72 | |
| 54 | AP | 30.60 | 15.34 | 15.26 | 19.06 | 12.0 | 51.90*z |
| HP | 26.77 | 11.45 | 15.32 | 22.20 | 8.7 | 46.03 | |
| 74 | AP | 40.93 | 20.78* | 10.08 | 15.56 | 9.2 | 46.57 |
| HP | 33.2 | 13.32 | 9.73 | 14.37 | 9.5 | 47.77 |
Table 4.
The leaf area, fresh and dry weights of shoot and root at 74 days after transplant (Aug. 25th, 2021).
| Treat-ment |
Leaf area (cm2) | Fresh weight (g/plant) | Dry weight (g/plant) | S/R ratio |
LAR (cm2·dw·g-1) |
Moisture content (%) | |||
| Shoot | Root | Shoot | Root | ||||||
| AP | 2,152y | 91.69 | 61.07 | 11.87 | 2.97 | 4.00 | 175*z | 87.17 | |
| HP | 1,721 | 78.82 | 50.80 | 10.66 | 3.10 | 3.44 | 128 | 86.68 | |
연구결과를 종합하여 볼 때, 적정 물고기 재배밀도와 pH 수준에서 갯기름 생육과 수량은 아쿠아포닉스와 수경재배 방식 간에 차이가 없는 것으로 보이고, 아쿠아포닉스는 농업 부산물의 자원순환으로 안전한 먹거리를 생산할 수 있는 지속가능한 농업기술로 판단된다.