서 론
재료 및 방법
1. 실험 재료 및 처리
2. 광합성, 기공전도도 측정
3. 엽록소 및 전분 함량 분석
4. 기공 밀도 변화 검경
5. 수체생육 및 과실품질 조사
결과 및 고찰
1. 광합성률 및 CO2 포화점 변화
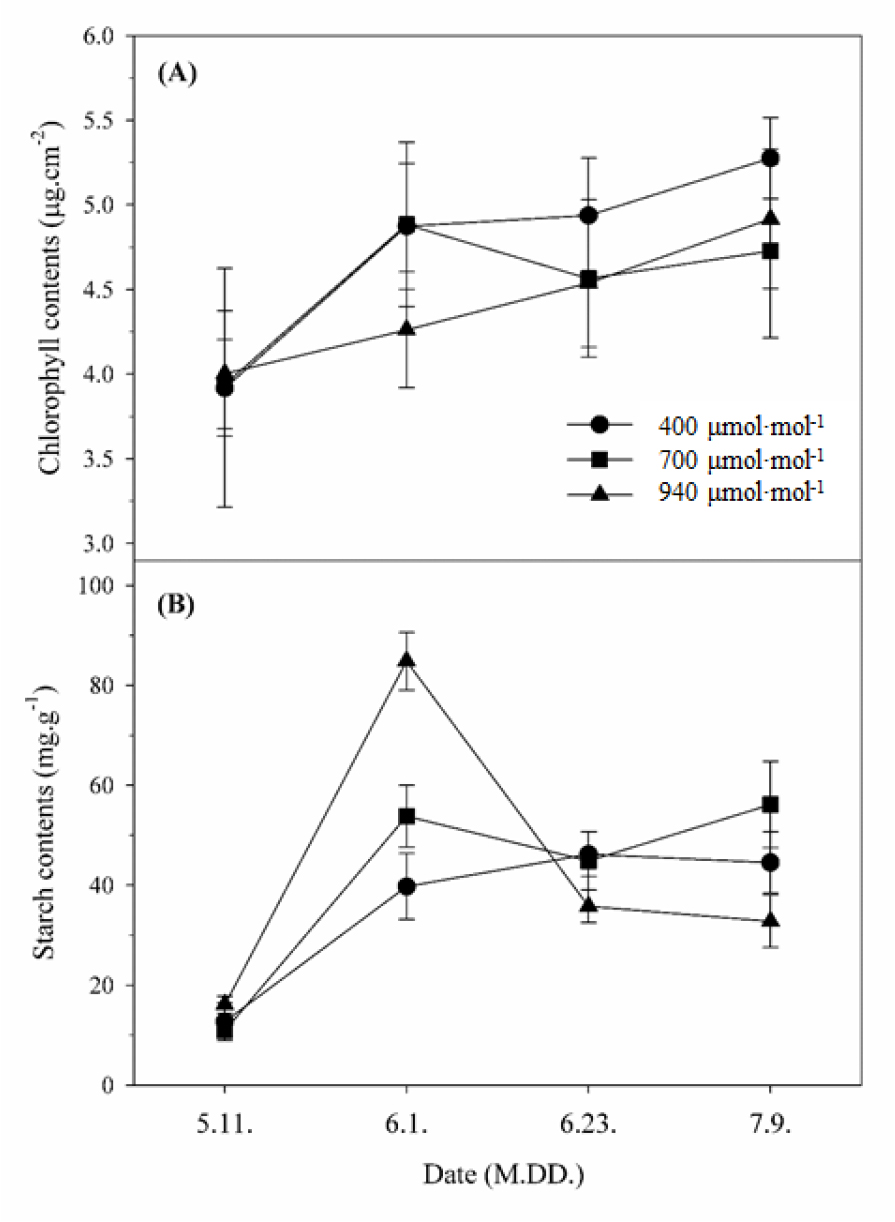
2. 엽록소 및 전분 함량
3. 기공 밀도 변화
4. 수체 생육 및 과실 품질
서 론
전지구적으로 대기 중 CO2 농도는 증가하고 있으며, 기후변화 시나리오 RCP 4.5와 8.5에 따르면 2100년경 CO2 농도는 각각 540µmol·mol-1 및 940µmol·mol-1으로 증가할 것으로 전망하고 있다(KMA, 2012). 2019년 기준 한반도의 CO2 농도는 418µmol·mol-1으로 1999년의 371µmol·mol-1 대비 47µmol·mol-1 증가하였고, 평균기온도 지난 30년(’81-’10) 동안 1.2℃ 상승하여 한반도의 기후변화가 가속화되고 있다(KMA, 2018; KMA, 2021). 이러한 기후변화는 작물에 있어 생화학적, 생리적, 세포학적 수준에서 영향을 미치며(Rogers와 Dahlman, 1993), 작물의 생물계절, 재배적지 및 생산성 변동 등 재배에 직접적인 영향을 미친다(Li 등, 2016).
CO2는 재배 환경 요인 중 광합성과 같은 식물 생리 반응에 영향을 미치는 중요한 요인으로, CO2 농도가 증가하면 식물의 생장과 광합성, 수분이용효율이 증대되고(Pritchard 등, 1999; Centritto, 2002), 배와 포도에서 과중, 가용성 고형물 함량, 착색을 증진시킨다고 보고되었다(Han 등, 2012; Son 등, 2014). 또한 시설 재배에서는 수량 증대를 위하여 2-3시간 이내로 이산화탄소를 시비하기도 한다(Chae 등, 2006; Kim 등, 2009). 그러나 농도나 조건에 따라 오히려 부정적인 영향이 나타날 수 있으며, CO2 시용으로 토마토는 과실이 커지면서 상대적으로 당도가 저하되고, 오이는 생육 후반에 잎의 노화가 빨리 진행된다(Chae 등, 2006). 또한 대기 중의 CO2 농도가 2배로 상승하면 식물체의 삼투 스트레스에 의하여 기공전도도가 낮아진다(Leymarie 등, 1999; Kweon 등, 2013). CO2 농도에 따라 잎의 형태도 변화하며, 토마토, 콩, 복숭아 등의 작물에서는 CO2 농도 상승에 따라 엽 두께 증가와 비엽면적이 감소한다고 보고하였다(Centritto, 2002; Qian 등, 2012).
CO2 단일 상승에 따른 수체 생육 및 생리 반응에 관한 연구는 수목류, 식량작물, 과채류에서 활발하게 연구가 되어왔지만, 과수에서는 온도와 CO2 상승에 의한 복합적인 생리 반응에 대한 연구가 한정적으로 수행되었다(Han 등, 2012; Kweon 등, 2013; Son 등, 2014). 따라서 본 연구는 RCP 8.5를 기반으로 CO2 상승 처리를 하여 복숭아 ‘미홍’ 품종의 광합성 및 잎의 형태학적 변화를 분석하고, 수체의 생육과 과실 품질에 미치는 영향을 구명하고자 수행하였다.
재료 및 방법
1. 실험 재료 및 처리
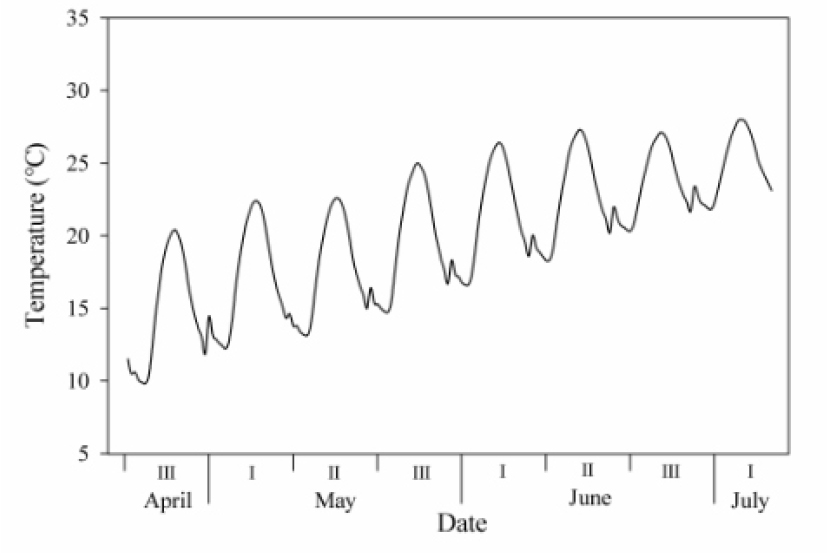
실험 재료는 80L 화분에 식재된 복숭아 조생종 ‘미홍’ [Prunus persica(L.) Batsch] 3년생을 처리 별로 6개씩 사용하였다. 실험 처리는 국립원예특작과학원(전라북도 완주군) 내 온도 및 CO2 제어가 가능한 자연광 온실(W4.5m × D4.4m × H3-5m)에서 2020년 4월 22일부터 7월 6일까지 수행하였다. CO2 농도는 기후변화 시나리오 RCP 8.5를 적용하여 대조구 400µmol·mol-1(현재), CO2 상승구 700µmol·mol-1(21C 중반기) 및 940µmol·mol-1(21C 후반기)으로 처리하였다. 온도 변화 구현은 전주 평년(1981-2010, 30년) 온도를 순별로 각 시간대별 평균온도를 적용하여 하루 24회의 변화를 주었다(Fig. 1).
2. 광합성, 기공전도도 측정
광합성 및 기공전도도 측정은 광합성 측정기(Li-6400, Li-COR, USA)를 사용하여 광합성이 활발한 오전 중에 측정하였다. 광 포화 곡선 작성을 위하여 CO2 400µmol·mol-1의 조건에서 광도별(0, 100, 200, 400, 800, 1,200, 1,600, 2,000 µmol∙m-2∙s-1)로 광합성률을 측정하였고, 이산화탄소 포화 곡선 작성을 위하여 광도 1,000µmol∙m-2∙s-1의 조건에서 CO2 농도별(50, 400, 600, 800, 1,200µmol·mol-1)로 광합성률을 측정하였다. 측정 시 챔버의 온도는 25℃, flow는 500µmol∙s-1으로 동일하게 설정하였으며, 처리별 3개의 화분에서 잎을 1개씩 선정하여 측정하였다. 시기별 최대광합성률과 기공전도도의 변화를 비교하기 위하여 5월 22일부터 7월 2일까지 10일 간격으로 처리별 6개의 화분에서 잎을 1개씩 선정하여 광합성률을 측정하였다. 측정 조건은 광도 1,000µmol∙m-2∙s-1, 온도는 측정하는 날의 최고 온도와 CO2는 처리별 농도 조건으로 설정하였다.
3. 엽록소 및 전분 함량 분석
엽록소와 전분 분석은 평균적인 크기의 잎을 무작위로 선정하여 3주 간격으로 4회 분석하였다. 엽록소 분석은 반지름 0.5cm의 leaf disc 10개를 채취하고, MeOH 30mL를 넣어 24시간 추출하였다. 추출액을 분광 광도계(UV-2501PC, Shimadzu, Japan)를 사용하여 651nm, 664nm의 파장에서 흡광도를 측정하였으며, 총 엽록소 함량은 total chlorophyll content = (25.5 × O.D.651 + 4 × O.D.664) × 0.3821656 식에 흡광도를 대입하여 계산하였다. 전분 함량 분석은 total starch assay kit(Megazyme, Wicklow, Ireland)와 엽록소 분석에 사용된 잎을 건조시켜 분쇄한 분말 0.1g을 사용하여 분석하였다.
4. 기공 밀도 변화 검경
처리별 기공 밀도 변화를 조사하기 위하여 조직의 절편을 3×4mm 크기로 자른 샘플을 채취하여 2.5% glutaraldehyde에 4℃ 24시간 동안 1차 고정 후, 1% osmium tetroxide로 4℃에서 4시간 2차 고정하였다. 고정 후 0.1M phosphate buffer (pH 7.2)를 사용하여 15분 간격으로 3회 세척하였다. 세척 후에는 ethanol series(40%, 60%, 80%, 90%, 95%, 100% ethanol)로 각각 30분씩 그리고 100% ethanol로 45분간 3회 탈수하였다. 탈수 후 isoamyl acetate로 치환, HMDS(hexamethyldisilane)로 건조, Ion-Sputter(MC1000; Hitachi, Japan)를 사용하여 gold coating하여 SEM(SU-3500, Hitachi, Japan)으로 검경하였다. 또한 생체시료가 건조되지 않으면서 전자빔으로 인한 시료의 손상을 최소화하는 저전압 모드에서 검경하였다.
5. 수체생육 및 과실품질 조사
주간부 단면적 증가량은 기부에서 10cm 위의 직경을 CO2 처리 전 4월과 처리가 끝난 시점인 7월에 측정하여 차이를 계산하였다. 엽면적과 신초 수, 신초 길이는 과실 수확 이후인 7월에 조사하였다. 엽면적은 처리당 3개의 화분에서 평균적인 크기의 잎을 20개씩 채취하여 엽면적 측정기(Li-3000C, Li-COR, USA)를 사용하여 측정한 뒤 잎 1개의 평균값을 계산하였다. 신초 수는 처리당 4개 화분의 신초 수를 조사하여 평균값을 계산하였고, 신초 길이도 같은 화분에서 전체 신초를 대상으로 길이를 측정하였다.
과실품질 조사를 위하여 6월 27일에 30개의 과실을 수확하여 과중 및 과실의 종∙횡경을 측정하였다. 경도는 과피를 지름 1cm 크기의 원형으로 벗긴 후 물성측성기(TAPlus, Lloyd Instrument, UK)의 8mm probe를 이용하여 측정하였다. 경도를 측정한 과육 부분을 잘라 착즙한 과즙을 이용하여 가용성 고형물 함량과 산 함량을 측정하였다. 가용성 고형물 함량은 디지털 당도계(PAL-1, ATAGO, Japan)에 과즙을 약 4-5mL를 떨어트려 측정하였다. 산 함량은 산도계(TitroLine® 5000, SI analytics, Germany)를 이용하여 과즙 5mL에 증류수 20mL를 첨가한 용액을 0.1N NaOH로 적정하면서 pH 8.2가 될 때까지 소요된 NaOH량을 malic acid량으로 환산하였다.
결과 및 고찰
1. 광합성률 및 CO2 포화점 변화
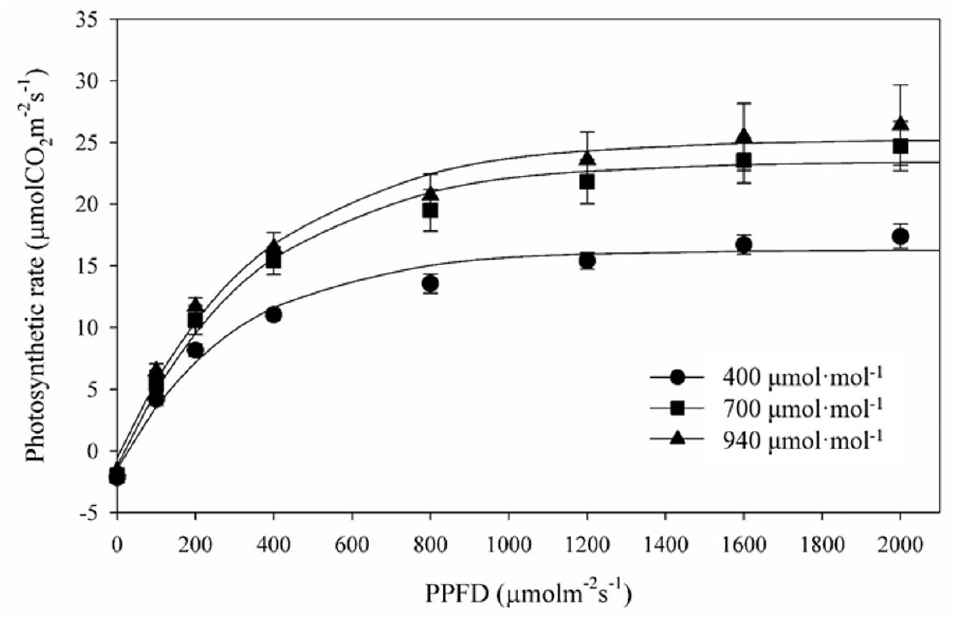
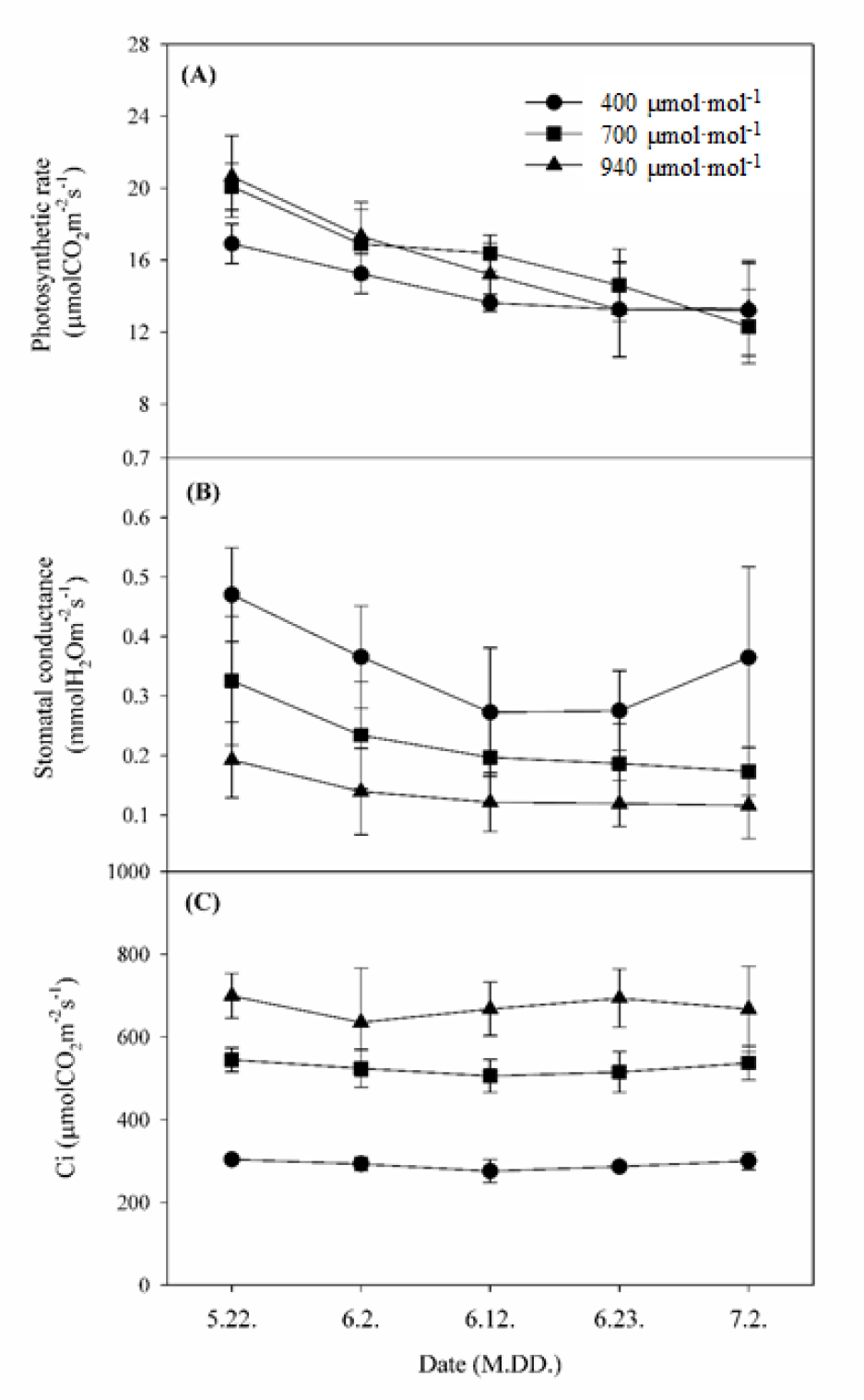
광도별 광합성률을 측정하여 광 포화 곡선을 작성한 결과, 대조구인 400µmol·mol-1보다 CO2 상승구에서 최대광합성률은 높았으나 광포화점은 모든 처리구에서 대략 1,200µmol∙m-2∙s-1인 것으로 나타났다(Fig. 2). 처리별 생육시기에 따른 최대광합성률의 변화를 알아보기 위하여 5월 22일부터 7월 2일까지 10일 간격으로 광포화점에 근접한 광도 수준인 1,000 µmol∙m-2∙s-1에서 광합성률을 측정하였다. 700µmol·mol-1 처리구가 생육기에 전반적으로 최대광합성률이 다른 처리구보다 높은 수준을 보였다. 최대광합성률 평균값이 16.06µmol∙CO2∙m-2∙s-1으로 대조구 14.45µmol∙CO2∙m-2∙s-1와 940µmol· mol-1 처리구의 15.96µmol∙CO2∙m-2∙s-1보다 높았다(Fig. 3A). 그러나 기공전도도는 광합성률과는 다르게 대조구인 400 µmol·mol-1 처리구보다 700µmol·mol-1 및 940µmol·mol-1 처리구에서 더 낮았다(Fig. 3B). 700µmol·mol-1 처리구의 기공전도도가 대조구보다 낮았음에도 불구하고 광합성률이 높았던 것은 세포 내 CO2 농도가 대조구보다 약 1.8배 높게 유지되었기 때문이라고 판단된다(Fig. 3C). 이는 사과에서 CO2 상승 처리구들이 대기 CO2 농도 처리구보다 세포 내 잔존해 있는 CO2 농도가 높아 기공이 닫혀도 세포 내의 CO2를 사용하여 광합성속도가 높았던 결과와 일치한다(Zhou와 Quebedeaux, 2003; Kweon 등, 2013).
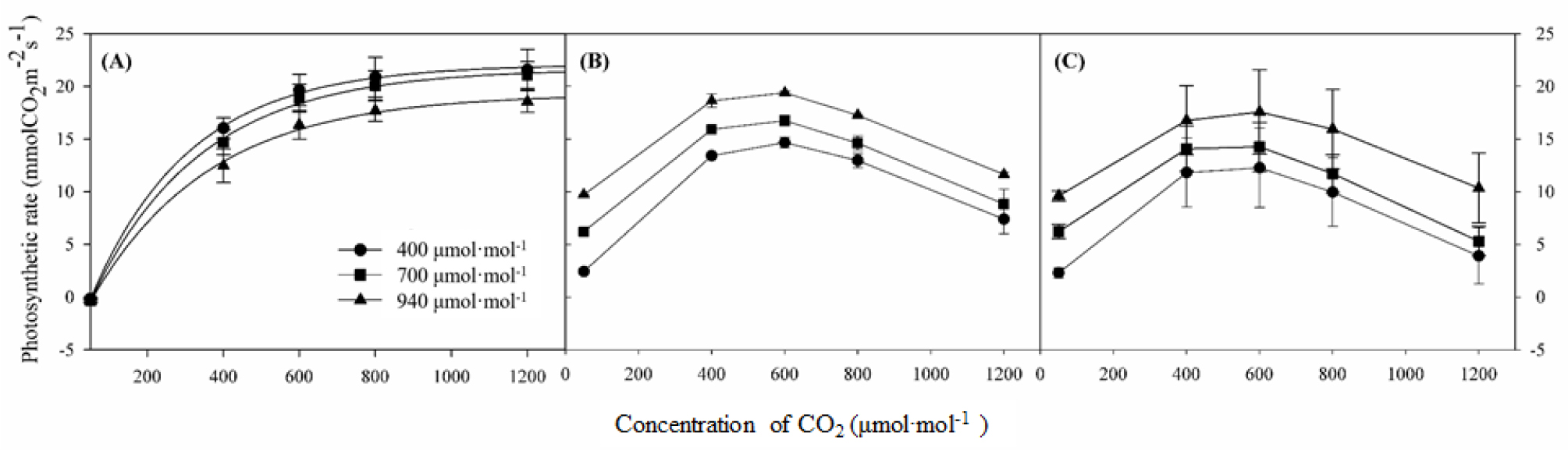
생육 시기별 이산화탄소 포화 곡선을 작성하여 CO2 포화점 변화를 조사하였다. 생육 초기(5월 21일) CO2 포화점은 모든 처리구에서 대략 1,200µmol·mol-1으로 측정되었지만, 생육 중기(6월 10일)와 수확 이후(7월 3일)에는 모든 처리구에서 600-800µmol·mol-1으로 낮아졌다(Fig. 4). Kim과 Lee(2001)는 CO2 농도가 상승된 조건에서의 생육이 장기화되면 CO2 분압 상승에 의한 광합성 촉진이 점차 둔화하면서 광합성 능력이 저하된다고 하였다. 본 연구에서도 생육 초기 CO2 상승 처리구들은 CO2 상승에 의해 광합성이 촉진되어 최대광합성률이 높았지만, 생육 후기에는 CO2 포화점이 낮아져 포화점 이상의 높은 농도에서는 대조구 수준으로 감소된 것으로 판단된다(Fig. 3A). 그러나 복숭아 과실 품질은 생육 후기보다 중기의 광합성률 영향을 더 많이 받는다는 연구 결과(Lee 등, 2020)에 따라 본 연구에서도 대조구와 비교하여 CO2 상승구들의 광합성률 감소가 수확(6월 27일) 이후에 나타났기 때문에 CO2 상승구들의 광합성 능력 저하가 과실 품질에는 영향을 미치지 않은 것으로 판단된다.
2. 엽록소 및 전분 함량
엽록소 함량은 처리 기간 동안 모든 처리구에서 상승하는 경향을 보였다(Fig. 5A). 이는 복숭아 ‘장호원황도’의 엽록소 함량은 전엽 후 2개월간 완만한 증가 추세를 보이고, 11주째 가장 높다는 보고(Yoon 등, 2013)와 유사하다. 그러나 CO2 상승 처리구의 엽록소 함량은 대조구보다 낮았으며, 특히 수확 이후 940µmol·mol-1 처리구에서는 다른 처리구보다 잎의 황화증상과 낙엽이 조기에 나타났다. 이는 사과에서 과실 수확 후 엽록소 분해와 함께 빠른 잎의 노화 현상을 보인다는 보고(Tartachnyk와 Blanke, 2004)와 유사하며, 장기간 CO2 농도를 상승 처리하였을 때 생육 후기에 엽록소 함량이 감소하면서 노화가 촉진된다는 보고(Delucia 등, 1985; Kweon 등, 2013)와 같다.
광합성에 의해 합성되는 동화산물 중 전분 함량을 분석한 결과, 모든 처리구에서 생육 초기보다 후기에 전분 함량이 증가하였다(Fig. 5B). 이는 복숭아 품종과 상관없이 생육이 진전되면서 엽 내 전분 함량이 증가한다는 보고(Lim 등, 2003)와 유사하였다. 또한 940µmol·mol-1 처리구의 경우 6월 1일 분석된 전분 함량이 대조구보다 2.1배, 700µmol·mol-1 처리구보다 1.6배 높았다. 이러한 결과는 sink-source 기관의 동화산물 분배와 관련이 있으며, sink strength가 낮고 야간의 동화산물 전류가 적으면 엽내 전분 함량은 높아지게 된다는 보고(Yelle 등, 1989)와 유사하다. 따라서 940µmol·mol-1 처리구는 이 시기에 sink 기관으로의 전류가 완료되고 남은 전분이 다른 처리구보다 많아 엽 내 전분 함량이 높은 것으로 추정된다(Table 1).
Table 1.
Characteristics of the tree growth under different carbon dioxide in peach ‘Mihong’.
| Treatment |
TCA increase (cm2) |
Leaf area (cm2) |
Number of shoot per tree |
Shoot length (cm) |
| 400 μmol·mol-1 | 1.02 az | 48.08 a | 124 a | 9.02 a |
| 700 μmol·mol-1 | 0.82 a | 45.53 a | 138 a | 6.77 b |
| 940 μmol·mol-1 | 0.89 a | 49.38 a | 137 a | 4.18 c |
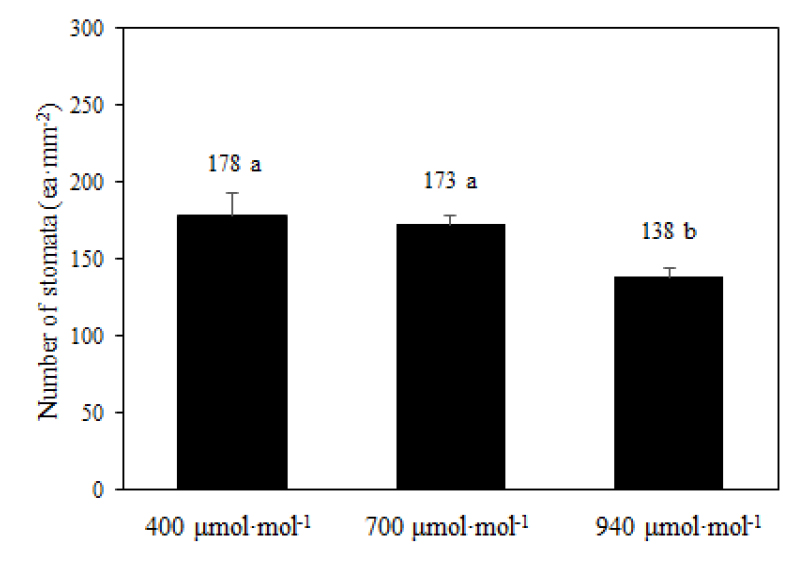
3. 기공 밀도 변화
CO2는 기공 밀도에 영향을 주는 요인 중 하나이므로 CO2 상승에 따른 기공 변화를 조사하기 위하여 잎 뒷면을 검경하였다(Fig. 6). 기공 밀도는 대조구인 400µmol·mol-1에서 178 ea·mm-2, 700µmol·mol-1에서 173ea·mm-2, 940µmol·mol-1에서 138ea·mm-2으로 CO2 농도가 높을수록 감소하였다(Fig. 7). 기공의 발달은 CO2 농도, 광도, 일장, 대기온도 등 생육 환경에 영향을 받는다. 특히 기공 밀도는 CO2의 영향을 많이 받으며, 대부분의 작물이 CO2 농도 증가에 따라 기공 밀도가 감소한다(Woodward와 Kelly, 1995). 포도에서 대기보다 높은 500µmol·mol-1의 CO2 농도에서 기공 밀도가 감소하였고(Moutinho-Pereira 등, 2009), 대기보다 낮은 94µmol·mol-1에서는 기공 밀도가 증가하였다고 보고하였다(Rogiers 등, 2011). 본 연구에서도 940µmol·mol-1의 고농도의 CO2 환경에서 기공 밀도가 낮았고, 이러한 결과는 940µmol·mol-1 처리구는 대조구와는 달리 광합성에 사용되는 CO2 유입에 많은 양의 기공이 필요하지 않아 발달이 억제되는 방향으로 적응한 것으로 추정된다.
4. 수체 생육 및 과실 품질
수체 생육 중 주간부 단면적 증가량 및 엽면적, 신초수는 모든 처리구에서 통계적 유의차가 없었다. 그러나 신초수는 대조구인 400µmol·mol-1보다 CO2 상승구들이 더 많은 경향이었으며, 신초 길이는 CO2가 상승할수록 짧아졌다(Table 1). 즉, CO2 농도가 상승할수록 짧은 길이의 신초가 다수 발생하였다. 따라서 940µmol·mol-1 처리구의 경우 신초 길이가 짧아 다음해 과실의 착과 부위가 감소하여 수확량에 부정적인 영향을 미칠 것으로 판단된다.
과실 수확기는 모든 처리구에서 6월 27일이었다. 과중은 700µmol·mol-1(152.5g), 940µmol·mol-1(147.4g), 400µmol· mol-1(141.8g) 순으로 높았다. 과실 종경은 과중과 같은 경향으로 700µmol·mol-1 처리구에서 61.8mm로 가장 컸으며, 횡경은 처리간의 통계적 유의차가 없었다(Table 2). Islam 등(1996)은 700-900µmol·mol-1의 고농도 CO2 환경에서 토마토 과실 무게는 대기 조건에서보다 높았으며, 높은 광합성률에 의한 과실로의 탄수화물 축적때문이라고 보고하였다. 과실 경도는 처리간 통계적 유의차가 없었다. 가용성 고형물 함량은 대조구인 400µmol·mol-1보다 CO2 상승구에서 유의적으로 증가하였으며, 940µmol·mol-1 처리구에서 11.2°Bx로 가장 높았다. 본 연구와 유사하게 토마토 과실의 당 함량은 대기 조건보다 고농도 CO2 환경에서 높았으며, 관련된 효소 활성의 증가와 함께 강화된 광합성산물의 전류때문이라고 보고하였다(Islam 등, 1996). 또한 배(Han 등, 2012)와 포도(Son 등, 2014)에서 대기조건보다 700µmol·mol-1의 CO2에서 가용성 고형물 함량이 증가한 결과와도 같은 경향이었다. 산 함량은 700µmol·mol-1 처리구에서 0.172 %로 가장 낮았지만, CO2 상승에 따른 경향은 보이지 않았다. 따라서 과중과 가용성 고형물 함량, 산 함량을 고려하였을 때, 700µmol· mol-1 처리구가 생산량 및 과실 품질이 가장 우수한 것으로 판단된다.
Table 2.
Harvest dates and the fruit quality under different carbon dioxide in peach ‘Mihong’.
| Treatment | Harvest date |
Fruit weight (g) |
Fruit length (mm) |
Fruit width (mm) |
Firmness (N) |
Soluble solids (°Bx) |
Acidity (%) |
| 400 μmol·mol-1 | 6.27. | 141.8 bz | 60.4 b | 70.1 a | 8.26 a | 10.2 b | 0.187 ab |
| 700 μmol·mol-1 | 152.5 a | 61.8 a | 71.4 a | 4.96 a | 11.0 a | 0.172 b | |
| 940 μmol·mol-1 | 147.4 a | 60.6 b | 70.0 a | 5.71 a | 11.2 a | 0.205 a |
이상의 결과들을 종합하면 CO2 상승 처리에 따라 복숭아 ‘미홍’의 과실 품질 요인 중 과중 및 크기, 가용성 고형물 함량은 증가하여 700µmol·mol-1 처리구에서 가장 우수한 것으로 판단되었다. 그러나 CO2 상승구들에서 신초 길이 감소, 조기 노화 등 수체 생육은 좋지 않았으며, 특히 940µmol·mol-1 처리구의 다음해 과실 수확량은 감소할 것으로 추정된다. 그러나 본 연구는 단기간의 생육기 CO2상승에 대한 수체 반응 및 과실 품질을 분석한 것이므로 장기적인 고농도 CO2 환경에서의 수체 변화 및 적응에 대한 지속적인 연구가 필요하다.