서 론
전세계 노지 작물 생산량은 이상 기후, 기후 변화, 사막화와 같은 환경 악화와 관개 용수, 경작지와 같은 자원 부족으로 인해 감소하고 있다(Raza 등, 2019). 특히, 무분별한 개발과 지구 온난화로 인해 약용식물과 자생식물의 자생지와 서식지가 파괴되고 있다(Pyšek 등, 2017). 식물공장은 광 환경(광도, 광질, 광주기), 지상부 환경(온도, 습도, 이산화탄소, 기류), 지하부 환경(수분, 양분)을 조절하여 작물을 계획적으로 생산할 수 있는 자동화된 식물생산 시스템을 말한다(Kozai와 Niu, 2020). 식물공장은 외부 환경과 무관하게 식물을 생산 할 수 있다는 측면에서 앞에서 언급한 미래 식량 확보, 자원 부족 문제 해결, 중요 식물 자원의 보존과 같은 다양한 문제를 해결하는데 기여할 수 있다. 또한, 식물공장에서는 정밀한 환경 제어를 통해 식물의 생장과 품질을 향상 시킬 수 있는데, 이런 특성을 이용하여 바이오 산업계에서 화장품, 식품, 의약품의 원료로 사용하고 있는 고부가가치 식물 소재를 안정적으로 안전하게 생산할 수 있다(Kim 등, 2020; Lee 등, 2016a; Nguyen와 Oh, 2021; Park 등, 2019).
LED는 크기가 작고 다양한 스펙트럼을 방출하여, 광질 환경의 인위적 조성이 가능하여 식물공장과 같은 환경제어 농업에서 많이 이용되는 인공광원이다(Pattison 등, 2018). 가시광선 영역에서 청색과 적색 파장은 엽록소 a와 b에 의해 가장 효과적으로 흡수되어 광합성에 기여하는 비율이 크다(Terashima 등, 2009). 또한, 청색광은 굴광성, 기공개폐, 스트레스 방어 기작에 관여하며, 적색광은 종자 발아, 꽃눈 분화, 줄기 신장, 색소 발현과 같은 식물의 다양한 생리적인 반응에 관여한다(Mitchell와 Sheibani, 2020; Shimizu, 2016). 녹색광은 과거 엽록소에 의한 흡수율이 낮다고 보고되어, 식물재배에 사용빈도가 적었다. 그러나 Terashima 등(2009)은 녹색광이 투과율이 높아 엽육조직 내까지 침투하여 잎 전체의 광화학적 효율을 높일 수 있다고 보고하였다. 선행연구에서 청색과 적색 혼합광에 녹색광을 추가한 경우 아이스플랜트와 이고들빼기의 광합성률과 작물의 생체중, 품질 등이 향상되었다(Lee 등, 2019; Park 등, 2020a). 하지만 녹색, 적색, 청색 비율과 광의 세기 등에 따라 식물이 받는 영향이 다르기 때문에 작물에 적합한 최적 광질을 규명하는 것은 어려운 작업이다. 백색 LED는 적색, 청색, 녹색을 포함하여 다양한 파장 스펙트럼을 방출하고 연색성이 우수하며, 단색 LED 보다 저렴하여 식물공장에서 많이 사용되고 있다. 그리고 적색, 청색, 녹색의 혼합광보다 백색 LED 하에서 재배한 식물의 생장이 증대된 연구 결과들도 보고되었다(Park와 Runkle, 2018; Phansurin 등, 2017). 최근에는 백색 기반 LED에 청색, 적색, 원적색과 같은 단색 LED를 추가하여 작물의 생산성과 품질 향상을 도모하는 연구들도 진행되었다(Mickens 등, 2019; Park와 Runkle, 2018; Yan 등, 2020).
이고들빼기(Crepidiastrum denticulatum(Houtt.) Pak& Kawano)는 한국의 약용식물로 산기슭과 같은 음지환경에서 주로 자생한다. 이고들빼기는 클로로젠산, 치커리산, 카프타릭산과 같은 다양한 생리활성물질을 풍부하게 함유하고 있다(Lee 등, 2014). 이전 연구에 의하면 이고들빼기 추출물은 높은 항산화도, 항지방간, 항비만, 항염증 특성을 가지고 있고 특히, 주요 생리활성물질인 치커리산은 비알콜성 지방간 질환 및 간염 치료에 효과적이라고 알려져 있다(Kim 등, 2017; Lee 등, 2014). 이고들빼기는 상업적으로 건강기능식품의 식물 원료로 사용되고 있으며, 식물공장과 같은 통제된 환경에서 이고들빼기의 안정적인 대량생산을 위한 연구들이 수행되었다(Bae 등, 2017; Bae 등, 2019; Park 등, 2016; Park 등, 2020a; Park 등, 2020b).
본 연구는 스펙트럼이 다른 다양한 백색 LED 하에서 재배한 이고들빼기의 생산량과 광 이용효율을 비교하고자 수행하였다. 또한, 우리의 이전 연구를 통해 이고들빼기의 생장과 품질 증대에 효과가 좋았던 적색과 원적색 비율을 1.0으로(Bae 등, 2017; Bae 등, 2019) 맞춰 주기 위해 원적색 LED를 백색 LED에 추가하여 그 효과를 검증하였다.
재료 및 방법
1. 식물 재료 및 재배환경
Park 등(2016)이 소개한 동일한 방법으로 이고들빼기 종자를 파종하고 발아시켰다. 파종 후 3주된 이고들빼기 묘를 원예용 상토가 채워진 플라스틱 포트[6 × 6 × 6cm(L × W × H)]에 1개체씩 정식하였고 심지재배 방식으로 재배하였다. 트레이[32 × 22 × 6.5cm(L × W × H)] 당 6개체씩 재배하였고 처리구 당 4개의 트레이를 사용하였다. Park 등(2016)이 개발한 이고들빼기 전용 배양액(EC 2.0dS∙m-1, pH 5.5)을 트레이에 공급하였고 2주 마다 배양액을 교체해주었다. 광 분포의 균일성을 확보하기 위해 트레이를 2일 마다 규칙적으로 재배치하였다. 이고들빼기는 기온 20.9 ± 0.1°C, 상대습도 60.8 ± 0.1%, 이산화탄소 농도 938.2 ± 5.8µmol·mol-1, PPFD 250.6 ± 0.6µmol· m-2·s-1, 광주기 16시간으로 설정된 인공광 이용형 식물공장에서 5주 동안 재배되었다.
2. 광질 처리
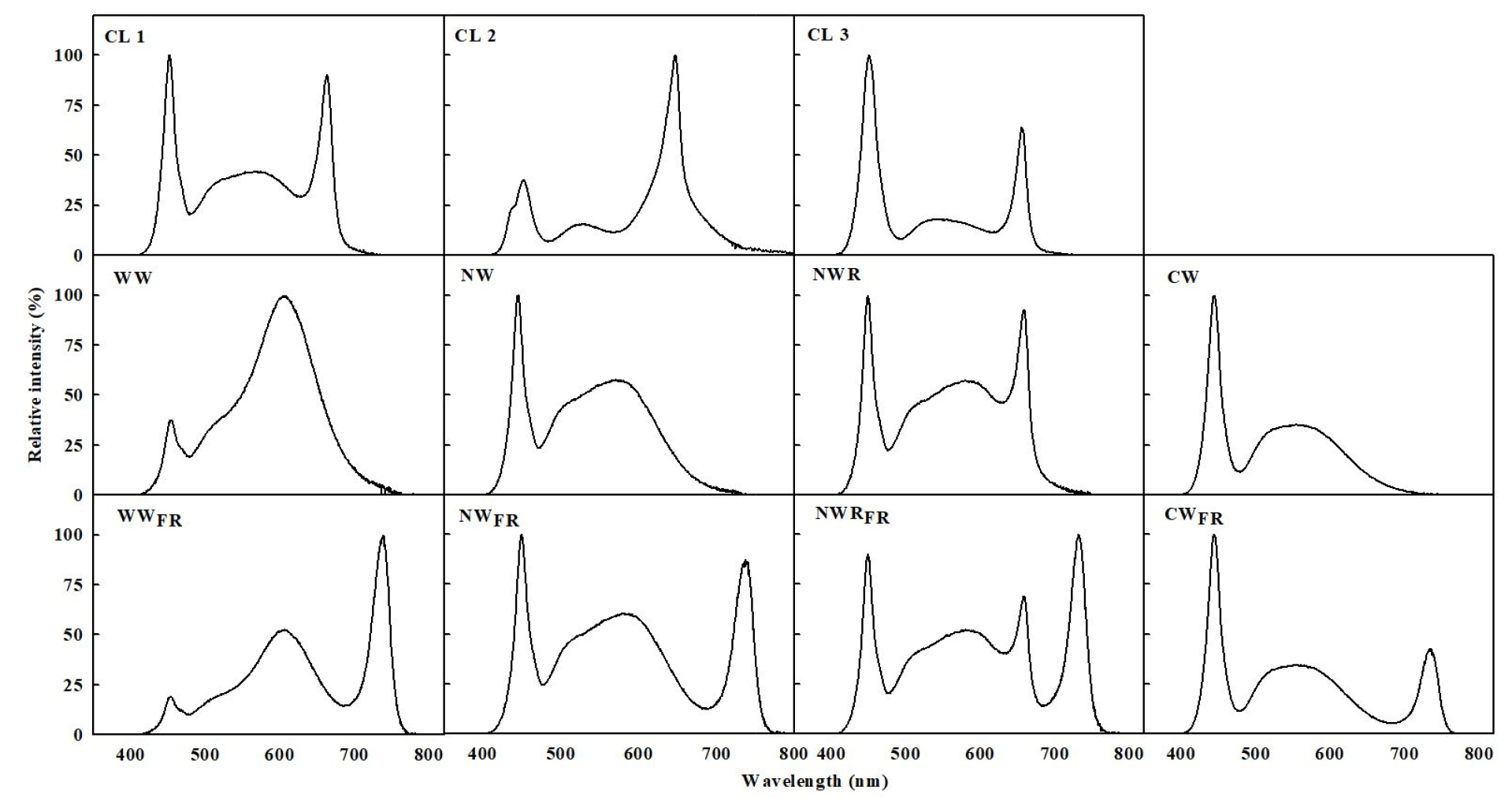
정식 후 5주 동안 대조구를 포함한 11개의 광질 처리의 효과를 검증하였다. 대조구로 식물재배용 3가지 백색 LED를 사용하였고 CL 1(S company, Seoul, Korea), CL 2(S company, Xiamen, China), CL 3(D company, Changnyeong-gun, Korea)로 표시하였다. 원적색광이 없는 그룹은 4가지 백색 LED[47.5 × 46.5cm(L × W), BISSOL LED, Seoul, Korea] Warm White (WW), Neutral White(NW), Neutral White + Red(NWR), Cool White(CW)으로 구성되었다. 원적색광 그룹은 4가지 백색 LED에 원적색 LED(BISSOL LED, Seoul, Korea)를 추가해주어 적색과 원적색광의 비율을 1.0로 맞춰주었고 WWFR, NFR, NWRFR, CWFR로 표현하였다. 분광복사기(JAZ-EL 200, Ocean optics, Dunedin, FL, USA)를 이용하여 광질 처리구별 8구역의 분광 스펙트럼을 측정하였다(Fig. 1). 이 데이터를 바탕으로 광합성 유효 광량자속밀도(photosynthetic photon flux density, PPFD), 광량자속밀도(photon flux density, PFD), 파이토크롬의 광평형상태값(phytochrome photostationary state, PSS)을 계산하여 평균 값으로 나타냈다(Table 1). PSS는 Sager 등(1988)이 서술한 방법으로 계산되었다.
3. 생육 특성
정식 5주 후 광질 처리에 따른 생육특성을 조사하였다. 기부를 중심으로 지상부와 지하부를 분리하였고 지상부의 생체중은 정밀전자저울(Si-234, Denver Instrument, Bohemia, NY, USA)로 측정하였다. 엽장과 엽폭은 가장 큰 잎을 기준으로 자를 이용하여 측정하였다. 지상부 전체의 엽면적은 엽면적 측정기(LI-2050A, Li-Cor, Lincoln, NE, USA)를 이용하여 측정하였다. 엽록소와 플라보노이드 지수는 휴대용 엽록소와 폴리페놀 함량 측정기(DUALEX SCIENTIFIC+™, Force A, Paris, France)를 이용하여 측정하였다.
4. 광 이용효율
모든 광질 처리구에서 LED에 공급되는 전류와 전압을 멀티미터(FLUKE-115, Fluke, USA)로 측정하였고 광주기 시간을 곱하여 일일 소비전력을 계산하였다. 5주의 재배기간 동안 소비된 총 소비전력은 Table 1에 나타내었다. 총 지상부의 생체중(g)을 합한 값과 재배기간 동안 소비된 총 소비전력을 이용하여 광 이용효율을 계산하였고, 공급한 전력 1kW 당 지상부 생체중 증가량(g/kW)으로 표현하였다.
Table 1.
Photosynthetic photon flux density (PPFD), photon flux density (PFD), phytochrome photostationary state (PSS), and red/far-red ratio for various lighting sources.
5. 통계 처리
생장 특성, 엽록소와 플라보노이드 지수의 평균 값은 광질 처리구별 24개체를 사용하여 측정하였다. 통계 분석은 Statistical Analysis System(SAS Institute, Cary, NC, USA) 프로그램을 이용하여 분산분석을 실시 하였다. 광질 처리구간 평균 값의 비교는 던칸의 다중검정(Duncan’s multiple range test)를 이용하였고 데이터 그래프는 시그마플롯(Exact Graphs and Data Analysis, Systat Software Inc, San Jose, CA, USA) 프로그램을 이용하여 나타내었다.
결과 및 고찰
1. 생육 특성
5주간 처리한 다양한 백색 LED 조사는 이고들빼기의 지상부 생장에 영향을 주었다(Fig. 2와 3). 대조구로 사용된 식물재배용 백색 LED 3가지 처리 중 적색 비율이 풍부한 CL 2는 지상부의 생체중, 엽면적, 엽장, 엽폭을 유의적으로 증대시켰다. 청색 비율이 높은 CL 3의 지상부 생육 특성은 전체적으로 모든 처리구들에 비해 유의적으로 낮은 경향을 보였다. 원적색광이 없는 그룹에서 적색 비율이 높은 WW 처리는 지상부 생장(생체중, 엽면적, 엽장)을 높였고, 나머지 3가지 광질 처리구 간의 유의적인 차이는 없었다. 4가지 백색 기반 LED에 원적색광의 보광은 이고들빼기의 지상부 생체중, 엽면적, 엽장을 증대시켰고, 그 중 WWFR 처리구의 지상부 생장 특성은 모든 처리구에 비해 유의적으로 높았다. WWFR 처리는 WW 비해 지상부 생체중을 1.5배 증가시켰다.
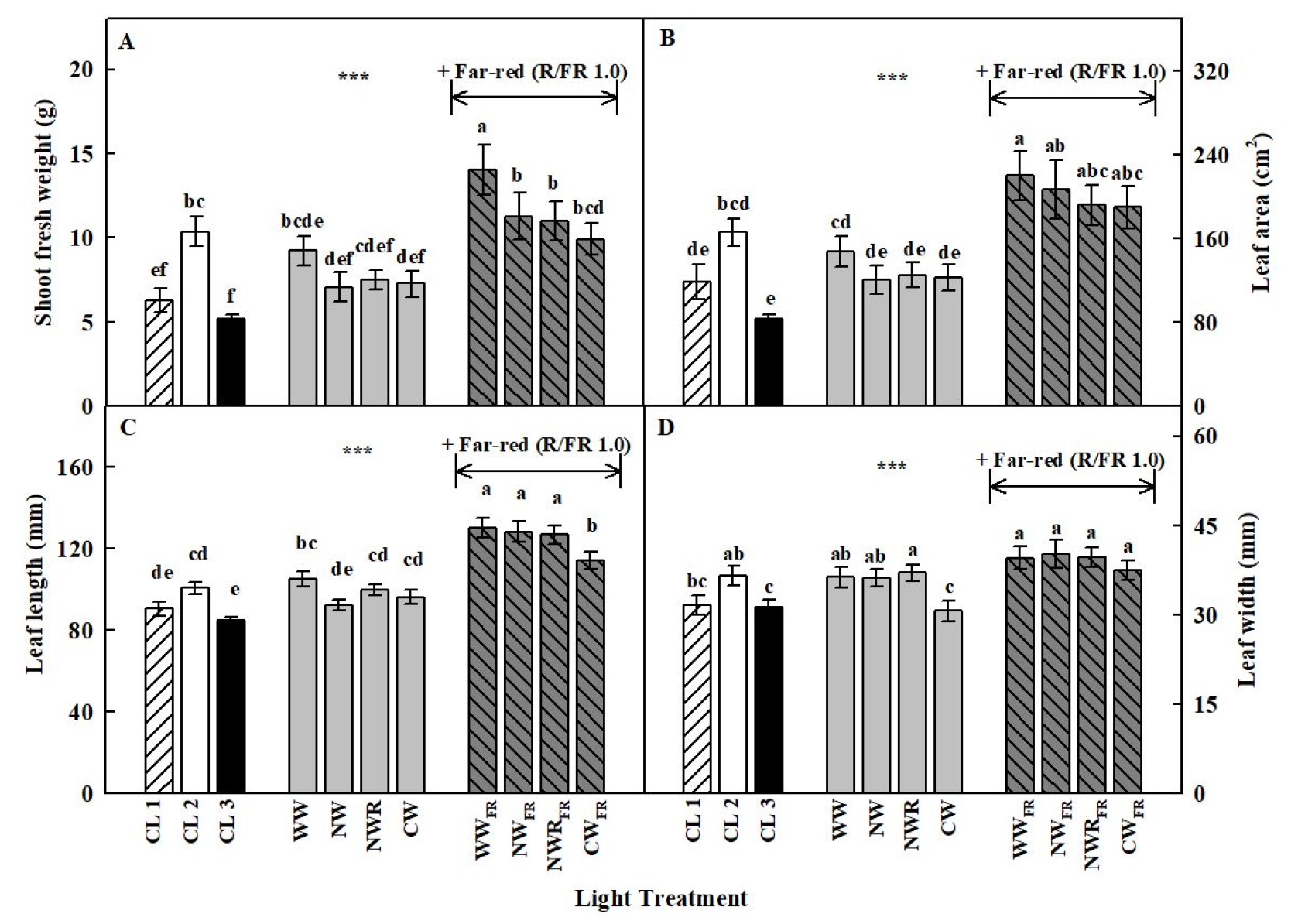
Fig. 3
Shoot fresh weight (A), leaf area (B), leaf length (C), and leaf width (D) of C. denticulatum grown under 3 types of commercial white LEDs (CL 1, CL 2, and CL 3) and various white LEDs with or without far-red LEDs for 5 weeks of transplanting. Different letters indicate a significant difference at ***p < 0.001 (n = 24).
청색광의 광수용체 중 하나인 크립토크롬(cryptochrome)은 줄기 신장을 촉진하는 옥신과 브라시노스테로이드 호르몬을 억제한다(Keuskamp 등, 2011; Song 등, 2019). 반면에 적색과 원적색광의 광수용체 파이토크롬(phytochrome)은 줄기 신장, 엽면적 증가, 엽각 증대와 같은 식물의 음지회피 반응을 유도한다(Lucas 등, 2008). 이전 연구들에서 청색광의 비율이 증가되고 적색광의 비율이 감소됨에 따라 무, 대두, 새싹삼, 차조기에서 줄기신장과 초장이 감소되었다(Cope와 Bugbee, 2013; Kim 등, 2020; Nguyen와 Oh, 2021). 본 실험에서도 청색광 비율이 가장 높은 CL 3의 엽장과 엽폭은 유의적으로 가장 낮았다(Table 1과 Fig. 3). 또한, 청색광 비율이 낮고 적색광 비율이 높은 CL 2와 WW의 엽장과 엽면적은 각 그룹에서 가장 높았다. PSS는 총 파이토크롬(Pf + Pfr)에 대한 활성상태 파이토크롬(Pfr)의 비율을 의미하며 낮은 PSS는 음지회피반응과 같은 광형태형성 반응을 유도한다고 알려져 있다(Runkle와 Heins, 2001; Sager 등, 1988). 원적색광을 보광 처리한 4가지 백색 LED 처리는 PSS 값이 0.8에서 0.6으로 감소하였고, 이는 이고들빼기의 엽면적과 엽장을 증가시켰다. 이러한 원적색광에 의한 지상부의 광형태형성 반응은 결국 지상부 생장 증대에 기여한 것으로 판단된다.
엽록소 함량은 CL 3와 NW에서 유의적으로 가장 높았지만 대조구 그룹과 원적색광이 없는 백색 LED 그룹 간의 엽록소 지수는 비슷한 수치였다(Fig. 4A). 반면에 원적색광의 보광 처리 그룹은 엽록소 함량 증가에 효과가 없었다. 지상부의 생장 결과와 반대로 엽면적이 가장 컸던 WWFR의 엽록소 함량은 유의적으로 가장 낮았다. 청색 비율이 높은 CW와 CL 3의 플라보노이드 지수는 다른 처리구들에 비해 유의적으로 높았다(Fig. 4B). 청색광 비율이 낮고 적색광 비율이 높은 CL 2와 WWFR의 플로보노이드 지수는 유의적으로 가장 낮았다. CW를 제외한 나머지 광질에서 원적색광의 보광 처리에 의한 플라보노이드 지수의 유의적인 변화는 없었다.
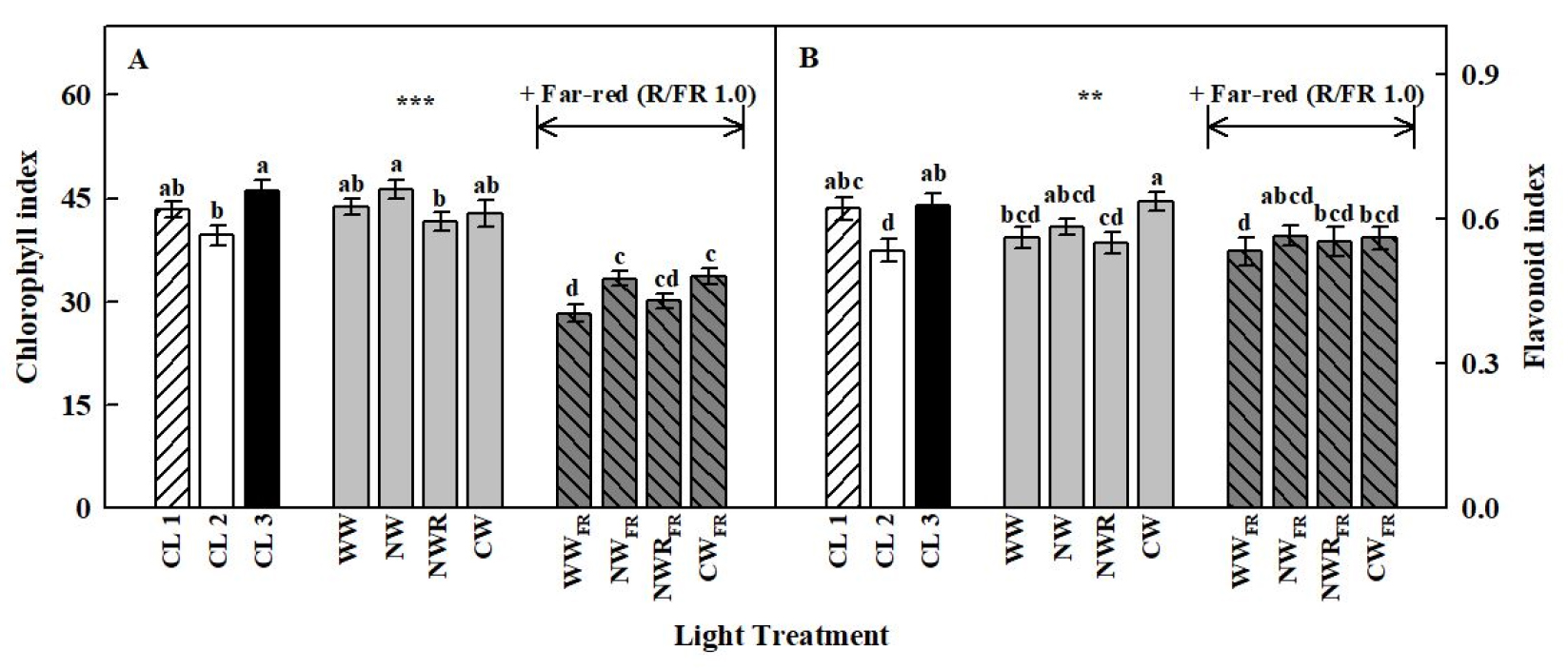
Fig. 4
Chlorophyll index (A) and flavonoid index (B) of C. denticulatum grown under 3 types of commercial white LEDs (CL 1, CL 2, and CL 3) and various white LEDs with or without far-red LEDs for 5 weeks of transplanting. Different letters indicate a significant difference at **p < 0.01 and ***p < 0.001 (n = 24).
Wittkopp 등(2017)은 청색광이 엽록소 생합성 과정 중 원엽록소(protochlorophyllide)에서 엽록소의 전구체인 클로로필라이드(chlorophyllide) a로의 변환을 촉진한다고 보고하였다. 실제로 여러 연구들에서 청색광은 새싹삼, 아이스플랜트, 이고들빼기의 엽록소 함량을 증대시켰다(Kim 등, 2020; Lee 등, 2019; Park 등, 2020a). 광 보호 메커니즘에서 크립토크롬은 핵심적인 역할을 하며 청색광에 의해 활성화된 크립토크롬은 안토시아닌과 플라보노이드 생합성 경로에 관여하는 유전자를 상향 조절한다(Siipola 등, 2015; Son 등, 2017). 본 실험에서도 청색광이 이고들빼기의 엽록소와 플라보노이드 지수 증대에 영향을 준 것으로 판단된다. 반면 단위면적당 엽록소와 플라보노이드 함량은 식물 생장과 반대되는 경향을 갖는다(Ahmad, 2012; Son과 Oh, 2013). 청색광의 비율이 증가함에 따라 오이의 초장과 엽면적을 감소되었고 식물의 크기를 작게 만들었다(Hernandez와 Kubota, 2016). 또한, 적색과 청색 혼합광에 청색광 비율의 증가는 상추의 생장을 감소시켰고 플라보노이드 함량을 증가시켰으며, Son과 Oh(2013)는 상추 생장과 페놀화합물이 음의 상관관계를 갖는다고 보고하였다. 반면에 원적색광이 상추의 세포 크기를 확장시켜 엽면적을 증대시킨다는 이전의 연구결과와 동일하게 원적색광의 보광은 이고들빼기의 엽면적을 증가시켰다(Lee 등, 2016b). 원적색광에 의해 엽면적 크기의 변화는 단위 엽면적 당 엽록소와 플라보노이드 지수를 감소시킨 것으로 판단된다. 실험을 통해 다양한 백색 LED에 원적색광의 보광 처리가 이고들빼기의 광형태형성을 유도하였고 이는 결과적으로 지상부 생장 증대에 원적색 광원이 핵심적인 역할을 한 것으로 판단된다.
2. 광 이용효율
5주의 재배기간 동안 11가지 백색 LED의 총 소비전력과 광 이용 효율을 계산하여 Table 2에 나타내었다. 3가지 상업용 백색LED중 총 소비전력은 CL 2가 50.4kW로 가장 높았다. 원적색광이 없는 그룹에서 4가지 백색 LED의 총 소비전력은 31.1–31.9kW 범위로 유사한 값을 나타내었다. 반면 NW에 적색 광원을 추가하면 총 소비전력이 증가하였다. 4가지 백색 LED에 원적색 광원을 추가하면 총 소비전력이 증가하였고 PFD 기준 원적색광을 가장 많이 추가한 WWFR의 총 소비전력이 가장 높았다(Table 1과 2). 지상부 생산량(g) 대비 사용한 총 소비전력을 이용하여 계산된 광 이용효율은 광질에 따라 차이를 보였다(Table 2). 총 소비전력이 가장 낮았던 CL 2를 제외한 나머지 두 대조구(CL 1과 CL 3)의 광 이용효율은 각각 4.9와 4.1g/kW으로 모든 광질 처리구 중 가장 낮았다. WW와 WWFR의 광 이용효율은 각각 6.7와 6.4g/kW으로 대조구를 포함한 모든 광질 처리구에서 가장 높았다. NW, NWR, CW에 원적색 광원의 추가는 광 이용 효율을 3–15% 증가시켰다.
Table 2.
Total power consumption and light use efficiency of various light treatments.
인공광을 이용하여 작물을 생산하는 경우 소비전력과 생산량을 기준으로 추정되는 광 이용효율은 광원의 효율을 평가하는데 중요한 지표이다. 식물공장에서 전기비용은 작물 생산비용의 약 20%를 차지하며, 전체 전력소모량 중 인공광원의 사용이 약 70–80%를 차지한다(Kozai와 Niu, 2020). 인공광원은 에너지를 소비하여 작물의 생산 비용을 증가시키기 때문에 인공광원의 광 이용효율을 향상시키는 것은 식물공장의 경제성 확보에 중요한 요인이다. LED는 발광 효율이 높아 형광등, 고압나트륨 등에 비해 소비전력이 낮고 에너지 효율이 높다(Pattison 등, 2018). LED는 상추 재배에 있어 형광등에 비해 토마토 재배에 있어 고압나트륨에 비해 광 이용효율을 각각 3.5배와 1.9배 증가시켰다(Dannehl 등, 2021; Son 등, 2016). Kim 등(2013)은 청색 LED보다 적색 LED의 소비전력이 더 크다고 보고하였다. 3가지 식물재배용 백색 LED중 적색 PPFD가 가장 많은 CL 2의 소비 전력은 가장 높았다. 하지만 원적색광이 없는 4가지 백색 LED의 소비전력에서 큰 차이가 없었고 원적색 광원의 추가는 소비전력을 증가시켰지만 동시에 지상부 생장을 증대시켰기 때문에 광 이용효율을 높일 수 있었다.
본 실험을 통해 다양한 백색 LED의 광 스펙트럼에 따라 이고들빼기의 생장 특성이 변할 수 있음을 확인하였다. 또한 다양한 백색 LED에 원적색광을 추가하여 이고들빼기의 형태형성적 변화 유도를 통해 지상부 생장을 증대하였고, 이는 작물의 생산량과 광 이용효율을 향상시킬 수 있음을 확인하였다. 따라서 식물공장과 같이 인공광원을 사용하여 작물을 재배할 때 재배 목적을 고려하여 백색 LED를 선택할 필요가 있으며, 원적색 광원을 추가하는 인공광원 설계는 식물공장의 운영에 있어서 작물생산 비용을 감소시키고 경제성을 향상시키는데 효과적일 것으로 판단된다.