서 론
재료 및 방법
1. 식물 재료
2. 실험처리
3. 생육 측정
4. 생리활성 화합물 측정
5. 통계처리
결과 및 고찰
1. 침지 시간에 따른 종자의 수분 흡수량
2. 광의 유무가 7가지 새싹 채소의 생육에 미치는 영향
3. 광의 유무가 7가지 새싹 채소의 생리활성 화합물 함량에 미치는 영향
결 론
서 론
최근 건강한 식단에 대한 관심과 중요도가 높아짐에 따라 식물 유래 식품의 선호도가 증가하고 있으며, 식품의 안전성 또한 중요시되고 있다. 신선 채소는 필수 영양소를 함유하고 있을 뿐만 아니라 수 많은 생리활성 화합물을 가지고 있어, 심혈관 질환과 암을 예방하는 등 건강 증진에 효과적이다(Guo 등, 2012; Pérez-Balibrea 등, 2008).
생물학적 관점에서 새싹은 종자 발아에서 시작하는 식물 생육의 첫 번째 단계의 식물체이다. 새싹 채소는 종자에서 발아한 싹을 키워 생육 초기의 어린 자엽과 배축을 이용하는 것으로 약 1주일의 짧은 생육 주기(4-10일)를 가지고 있기 때문에 비료 또는 농약 없이 암상태에서 단기간에 수확이 가능하다는 특징을 가지고 있다(Di Gioia 등, 2017).
새싹 채소는 독특한 맛과 향을 가지며 비타민과 무기질을 풍부하게 함유하고 있기 때문에 식품적 가치가 충분하다(Jung, 2007; Lucy 등, 2002; Luo 등, 2014). 종자가 발아하는 동안 물질대사의 활성화가 이루어지면서, 저장 단백질과 탄수화물의 가수분해가 촉진되어 생리활성을 띄는 이차 대사산물의 합성 및 축적이 유도된다(Cáceres 등, 2014). 또한, 발아 과정에서 필수 아미노산과 같은 일차 대사산물도 증가되어 새싹 채소는 동물성 단백질과는 차별화되는 아미노산/단백질 공급원이 될 수 있다(Aguilera 등, 2013; Tarasevičienė 등, 2009; Vale 등, 2015).
이전 연구들은 새싹 채소의 품질이 형태, 크기, 색깔 등 외적 요인에 좌우된다고 보고하였지만 최근 들어 맛과 향 그리고 생리활성 물질 함량 등 내적요인의 중요성이 강조되고 있다(Ampofo와 Ngadi, 2021; Lee 등, 2007; Świeca 등, 2012). 새싹 채소의 영양적인 가치의 향상은 종자의 발아 과정과 밀접한 관련이 있기 때문에, 발아 환경 조건은 새싹 채소의 영양학적 품질을 결정하는 중요한 요인이라 할 수 있다. 이전 연구에서 종자의 발아 과정동안 무기양분 및 단백질 프로파일, 그리고 포화 및 불포화 지방산의 비율 등과 같은 다양한 영양학적 품질의 변화가 보고되었다(Cáceres 등, 2014; Tarasevičienė 등, 2009). 발아 환경 조건 중 광도, 광질 그리고 광주기를 포함한 광 환경은 식물의 생장과 발달에 중요한 역할을 한다(Frankland와 Taylorson, 1983; Woolley와 Stoller, 1978). 빛을 필요로 하는 호광성 종자(positive photoblastic seeds)는 광에 노출된 후에만 발아하는 반면, 빛이 제한된 환경에서 발아하는 혐광성 종자(negative photoblastic seeds)는 어둠속에서만 발아하며, 세번째 범주인 중립 종자(light-neutral seeds)는 광 유무의 관계없이 발아하는 특징을 가지고 있다(Mérai등, 2019). 즉, 광의 유무는 종자의 발아율과 발아속도에 크게 영향을 줄 수 있기 때문에 종자 발아에 있어 중요한 요인이라 할 수 있다. 일반적으로 새싹 채소를 대량생산하는 과정에서 경제성과 편리성 때문에 종자를 대부분 암상태에서 발아시킨다. 하지만, 암조건에서의 종자의 발아가 새싹 채소의 생장 그리고 영양학적 품질 측면에서 최적의 조건인지에 대한 연구는 부족한 실정이다.
본 연구에서 사용된 7종의 새싹 채소들은 일반적으로 새싹 채소로 많이 이용되고 있는 작물이며 십자화과 채소(홍빛 열무, 케일, 다채, 브로콜리, 적양배추, 무)는 특히 인체 건강에 유익한 파이토케미컬을 함유하여 전세계적으로 인기를 얻고 있다(Šamec와 Salopek-Sondi, 2019). 따라서 본 연구의 목적은 7가지 작물의 발아 및 수확 시 광의 유무가 생장과 생리활성 물질 함량에 미치는 영향을 확인하는 것이다.
재료 및 방법
1. 식물 재료
광 유무에 따른 다양한 새싹 채소의 생육 그리고 생리활성 물질 함량의 변화를 확인하기 위하여 새싹 채소용 홍빛 열무(Raphanus sativus var.), 케일(Brassica oleracea L. var. Onica), 다채(Brassica campestris L.), 브로콜리(Brassica oleracea L. var. italica), 알팔파(Medicago sativa L.)(Asia seed Korea, Seoul, Korea), 무(Raphanus sativus L.), 적양배추(Brassica oleracea var. capitata f. rubra)(Onsem, Anseong, Korea) 종자를 실험에 사용하였다.
2. 실험처리
2.1 종자 침지 시간에 따른 수분함량의 변화
7가지 종자의 침지 시간을 결정하기 위한 침종 실험을 수행하였다. 각각의 종자를 1g씩 증류수에 침지 한 뒤 시간의 경과에 따라 24시간까지 매시간 종자의 무게를 측정함으로써 수분 흡수량을 추정하였다. 종자의 무게는 각 종자 별로 10립씩 취하여 종피에 묻은 수분을 제거한 뒤 전자 저울(Si-234, Denver Instrument, Bohemia, NY, USA)을 이용하여 무게를 측정하였다.
2.2 재배 및 광조건
종자 침지 실험에서 도출된 결과를 토대로 7가지 작물의 종자를 증류수에 5시간 동안 침지 시켰다. 가라앉은 종자를 2-3g씩 나누어 투명한 플라스틱 용기(120 × 73mm; Fig. 1A)에 골고루 펴 파종하였다. 파종한 새싹들을 광조건(Red : Green : Blue = 6 : 1 : 3, 130µmol·m-2·s-1, 12시간 광주기) 그리고 암조건 아래에서 온도 20°C, 상대습도 60%의 생장 챔버(BI-1000M; Jeio-Tech, Daejeon, Korea)에서 7일 동안 재배하였다(Fig. 1B). 발아 과정 동안 과습 피해를 받지 않도록 투명 플라스틱 용기 뚜껑에 6개씩 구멍을 냈으며 관수는 파이펫을 이용하여 매일 오전 10시에 증류수를 10mL씩 공급해 주었다. 광 처리구에서는 균일한 광 분포를 위해 1일 간격으로 용기를 시계방향으로 옮겨주었다.
3. 생육 측정
생장 지표로 새싹 채소의 생체중, 건물중, 초장을 측정하였다. 생체중은 처리 당 9개체의 새싹 채소를 티슈로 표면의 수분을 제거한 후 전자저울(Si-234, Denver Instrument, Bohemia, NY, USA)을 이용하여 측정하였고, 이후 70°C의 항온 건조기(FS-420, Advantec, Tokyo, Japan)에 72시간 이상 건조시킨 뒤 건물중을 측정하였다. 처리 종료일인 7일째에 새싹의 식용 가능한 크기 여부를 알아보기 위하여 초장을 측정하였다. 광 처리 후 4일째부터 7일째 까지 1일 간격으로 새싹 채소의 샘플을 채취하였다.
4. 생리활성 화합물 측정
4.1 총 페놀 함량
총 페놀 함량은 Ainsworth와 Gillespie(2007)에 의해 보고된 방법을 이용하여 Folin-Ciocalteau reagent를 사용하여 측정하였다. 새싹 채소 샘플은 분석 전까지 -70°C 초저온 냉동고에 보관되었다. 새싹 채소는 막자 사발을 사용하여 액체질소와 함께 분쇄한 뒤 3mL의 80%(v/v) 아세톤을 이용하여 추출하였다. 이후 4°C 암 상태에서 12시간 이상 보관된 샘플을 3,000 × g에서 2분간 원심분리 시켰다. 다음의 용액들을 순서대로 2mL의 마이크로 튜브에 넣었다; 135µL의 증류수, 750µL의 10% Folin-Ciocalteau시약(Sigma-Aldrich, St. Louis, MO, USA), 50µL의 추출 샘플, 그리고 600µL의 7.5%(w/v) Na2CO3. 혼합물을 잘 섞어준 후 45°C의 항온수조에서 15분 동안 반응시켰다. 반응 용액의 흡광도는 분광 광도계(UV-1800, Shimadzu, Kyoto, Japan)를 사용하여 765nm에서 측정하였다. 새싹 채소 추출물의 총 페놀 함량은 단위 생체중(g)당 Gallic acid(Acros Organics, Geel, Belgium)의 함량(mg)으로 표현하였다.
4.2 항산화도
항산화도는 안정한 ABTS[2,2’-Azino-di-(3-ethylbenzthiazoline sulfonic acid) (Sigma-Aldrich, St. Louis, MO, USA)] 용액에 대한 추출물의 라디칼 소거능력으로 표현하였고, Miller와 Rice-Evans(1996)방법을 약간 수정하여 분석에 이용하였다. 총 페놀 함량 측정에 사용된 방법과 동일하게 추출한 새싹 채소 추출물은 -20°C 암 상태에서 12시간 이상 보관되었다. 3,000 × g에서 원심 분리된 상층액을 분석에 이용하였다. 0.4g의 MnO2(Sigma-Aldrich, St. Louis, MO, USA)를 2.5mM의 ABTS용액에 첨가하여 ABTS 활성 양이온 용액(ABTS*)을 제조한 뒤, 여과지와 0.22µM 필터로 걸러주었다. ABTS*용액에 5mM의 PBS[phosphate buffer saline, pH 7.4, ionic strength(150mM NaCl)] 용액을 첨가하여 730 nm의 파장에서 흡광도를 0.7(±0.02)로 맞춰주었다. ABTS*용액은 분석이 끝날 때까지 30°C 항온수조에 보관되었다. 100µL의 새싹 채소 추출물을 1mL의 ABTS*용액에 반응시킨 뒤, 충분히 섞은 다음 1분 후 730nm에서 흡광도를 측정하였다. 흡광도의 변화는 대조구에서 차감되었으며 새싹 채소의 항산화도는 단위 생체(g)당 Trolox(mM)[(6-Hydroxy-2,5,7, 8-tetramethylchromane-2-carboxylacid)(Sigma-Aldrich, St. Louis, MO, USA)]로 표현하였다.
5. 통계처리
데이터 분석은 SAS(Statistical Analysis System, 9.2 Version, Cary, NC, USA) 통계 프로그램을 이용하여 분산 분석을 실시하였고, 처리 간 평균값은 T-test를 이용하여 비교하였다. 종자 침지 실험의 경우, 각각의 새싹 채소 종자 10립을 반복으로 하여 수행되었다. 하지만 생육(생체중, 건물중, 초장)과 생리활성 물질 함량 분석의 경우, 홍빛 열무, 케일, 다채, 알팔파는 6반복 그리고 무, 브로콜리, 적양배추는 9반복하였고, 1반복 당 8개체가 이용되었다. 광조건 그리고 암조건의 실험구 배치는 완전임의 배치법으로 수행되었다.
결과 및 고찰
1. 침지 시간에 따른 종자의 수분 흡수량
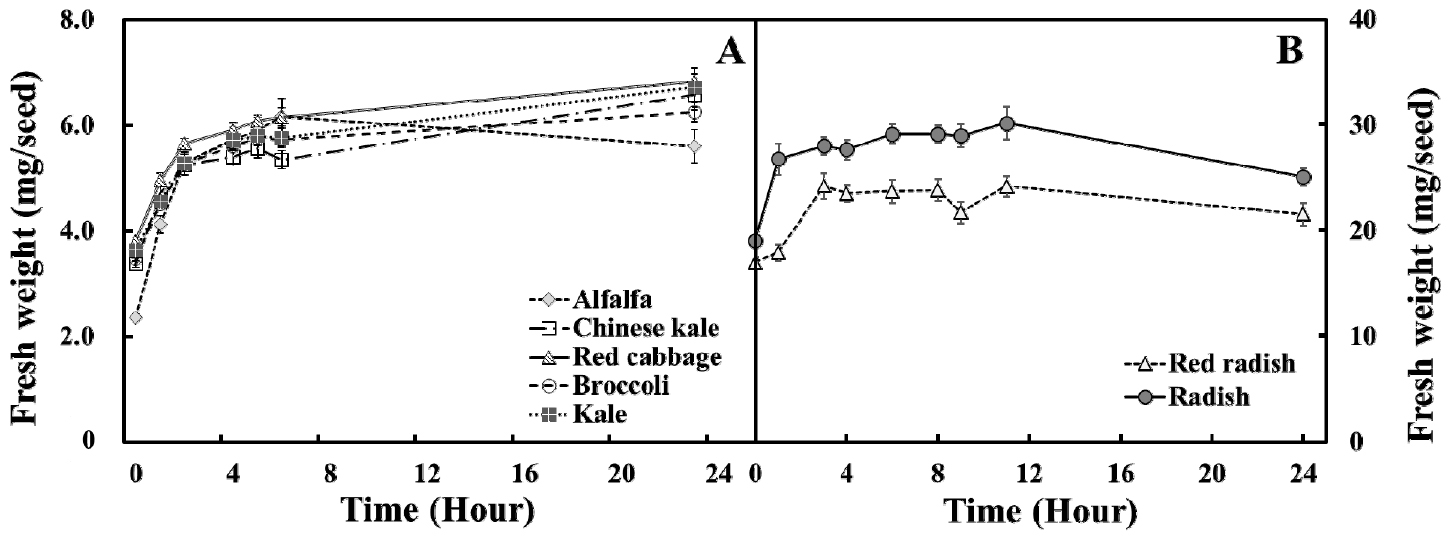
다양한 종류의 새싹 채소 종자의 시간 경과에 따른 수분 흡수량을 조사한 결과, 비교적 종자 크기가 작은 케일, 다채, 브로콜리, 적양배추 그리고 알팔파는 종자 침지 후 2시간째부터 수분 흡수량이 급격히 증가하였다(Fig. 2A). 이 종자들은 5시간 이후 수분 함량이 평형상태에 도달하여 24시간까지 비교적 비슷한 값을 유지하였다. 비교적 종자의 크기가 큰 홍빛 열무와 무 종자는 침종 직후 수분 함량이 급격히 증대되었고, 약 4시간 이후 평형상태에 도달하였다(Fig. 2B).
점진적으로 종자에 흡수된 수분은 종자의 배아 성장을 유도하고 궁극적으로 발아 시기를 결정하기 때문에 종자 침지 시간의 결정은 매우 중요한 요인이라 할 수 있다(Lechowska 등, 2019). 이전 연구결과에 따르면 암조건에서 장기간의 종자 침지는 수분 스트레스 또는 산소 부족을 유도할 수 있으며 이러한 영향은 종자의 2차 휴면의 가능성을 증대시킬 수 있다(Hoang 등, 2013; Pekrun 등, 1997). 종자 발달 과정 중, 미성숙한 종자가 성숙되는 동안 1차 휴면(primary dormancy)이 유도되며, 성숙한 종자가 삼투압 스트레스 및 저산소증과 같은 종자 발아에 불량한 환경 조건에 노출되면 2차 휴면(second dormancy) 상태가 될 수 있다(Hilhorst, 1995). 2차 휴면은 ABA활성 관련 메커니즘을 통해 유도되는데(Fei 등, 2009), 스트레스 조건에 노출되었을 때 종자내 관련 유전자 발현이 상향조절 되어 궁극적으로 발아율의 감소를 초래한다. 본 실험을 통해 모든 종자의 침종 시간은 5시간이 적합하다고 판단하였다.
2. 광의 유무가 7가지 새싹 채소의 생육에 미치는 영향
2.1 광의 유무에 따른 새싹 채소 별 생체중 및 건물중
광조건과 암조건에서 재배된 새싹들의 생육은 모두 생체중에서 유의적인 차이를 보였다(Table 1). 대부분의 십자화과 채소(케일, 다채, 브로콜리, 적양배추)와 콩과 작물 알팔파는 암조건에서 생체중이 유의적으로 높았다. 이 5종의 새싹 채소는 파종 4일째에는 광조건과 암조건에서 생체중에 유의적인 차이를 보이지 않다가 파종 후 5일 째부터 유의적인 차이를 보이기 시작하였다. 암조건에서 생육이 급격히 증대되기 시작하여 처리 종료일인 7일째까지 점차적으로 생체중이 증대되었으며, 적게는 12%(다채)에서 많게는 19%(알팔파)까지 유의적인 증대가 나타났다. 하지만 모든 종의 새싹 채소의 건물중은 유의적인 차이를 보이지 않았다.
Table 1.
Fresh and dry weights of various sprouts grown under light and dark conditions at 4, 5, 6, and 7 days after sowing.
같은 종임에도 불구하고 Raphanus 속인 홍빛 열무와 무는 생육 기간에 따라 두 처리구에서 서로 다른 경향을 나타냈다. 홍빛 열무의 경우, 다른 새싹들과는 달리 광조건에서 생체중이 지속적으로 높은 경향을 보였다. 파종 후 4일째부터 암조건에 비해 광조건에서 자란 홍빛 열무 새싹의 생체중이 약 1.36배 높았고 특히, 7일째에는 2.14배 유의적으로 증대되었다. 무의 경우에는 생육 기간에 따라 생체중의 결과가 다르게 나타났다. 파종 후 6일째까지는 암조건에서 생체중 값이 유의적으로 높았지만 처리 종료일인 7일째에는 광조건에서 생체중이 약 1.12배 유의적으로 증대되었다. 하지만 홍빛 열무 그리고 무 새싹의 건물중에는 모든 처리 일수에서 대부분 유의적인 차이가 없었으며 처리 종료일인 7일째에는 모두 유의적인 차이를 나타내지 않았다.
다양한 작물의 종자의 발아에서 광의 유무는 식물의 생육과 발달에 영향을 미친다(Mérai등, 2019). 어떠한 종자는 발아를 위해 광이 필요하지만 어떠한 종자는 광을 필요로 하지 않는다(de Jong 등, 2013). 일반적으로 십자화과 종자는 암 상태, 고온 다습 조건 하에서 100%에 가까운 발아율을 보인다(Landbo와 Jørgensen, 1997; Naeem 등, 2009). 알팔파 종자 또한 암조건에서 발아시켜 새싹을 재배한 여러 연구들이 보고 되었다(Yacoubi 등, 2013; Janicki 등, 2005). 이러한 연구 결과들을 토대로, 십자화과 채소인 케일, 다채, 브로콜리, 적양배추 그리고 콩과 작물인 알팔파는 암조건에서 발아가 빠르게 진행되어 광조건보다 생체중이 급격히 증대되었을 가능성이 존재한다. 이러한 새싹 채소들의 암조건에서의 발아율 증가는 종자 발아의 광 저해 효과에 기인한 결과일 수 있다(Pons, 2000). 종자 발아의 광 억제 반응은 전통적으로 토양 표면 또는 그 근처에서 발아를 피하기 위한 생리학적 적응 반응일 수 있으며 묘목이 탈수 또는 극도로 높은 온도에 노출되는 것을 보호하는 역할을 한다(Koller 등, 1964; Thanos 등, 1991).
Raphanus 속(홍빛 열무, 무) 작물은 일반적으로 광조건에서 보다 암조건에서 발아율이 높다(Mekenian와 Willemsen 1975; Vercellino 등, 2019). 반대로 일부 무 품종의 비 휴면 종자는 어두운 조건 보다 광조건에서 더 쉽게 발아된다고 보고된 바 있다(Baskin와 Baskin, 1988). 이전 연구에 따르면, 광 환경 조건(특히, 광도)에 따라 구성 성분, 초미세구조 그리고 광합성 능력이 다른 뚜렷한 두 가지 형태의 엽록체가 생성된다(Lichtenthaler, 1979). 발아 시 종자가 약한 광(예: 음지)에 노출되면 높은 grana stacks 함량, 낮은 Hill-activity rate을 가진 shade-type 엽록체가 형성된다. 반면에, 높은 광도에 노출되는 경우 lamellar material이 적고 grana stacks이 거의 없는 sun-type 엽록체가 형성된다. 이러한 sun-type 엽록체는 더 높은 Hill-activity를 가지고 있으며 이것은 잠재적인 전자운반자 역할을 하는 prenylquinones의 수준을 향상시켜 광합성 능력을 증대시킬 수 있다. 추가적으로 8일간 무 종자를 높은 광 아래에서 발아 및 재배하였을 때 chlorophylls, carotenoids 그리고 prenylquinones의 축적이 더 많이 유도되었고 생체중 및 건물중 또한 대략 2배 정도 증대되었다(Lichtenthaler, 1979). 즉, 홍빛 열무 그리고 무 종자의 광조건에서의 생장 증진은 7일간의 재배기간 동안 발생된 광합성 능력의 증대에 의한 것일 수 있다.
2.2 광의 유무에 따른 새싹 채소별 초장 및 외형 특성
홍빛 열무와 무를 제외하고 비교적 종자 크기가 작은 케일, 다채, 브로콜리, 적양배추 그리고 알팔파는 암조건에서 초장이 유의적으로 증대되었다(Table 2). 케일, 다채, 브로콜리, 적양배추, 알팔파는 암조건에서 2.35배, 1.85배, 1.91배, 1.17배, 2.28배 각각 증대되었다(Table 2). 일반적으로 암조건에서 재배된 묘는 광형태형성(photomorphogenic)이 아닌 암형태형성(skotomorphogenic) 반응이 진행된다. 암형태형성 반응에는 종자 발아, 노화, 다양한 생물학적 그리고 비생물학적 요인에 대한 방어를 포함한 생리학적 특성을 제어하는 스테로이드 호르몬인 브라시노스테로이드가 관여한다. 식물체내 동화산물이 떡잎과 뿌리 발달이 아닌 배축 신장으로 분배되기 때문에 초장이 길어짐과 동시에 1차적인 뿌리 성장이 억제된다(Josse와 Halliday, 2008; Vriet 등, 2013; Yamamuro 등, 2000). 광이 없는 조건에서 나타나는 암형태형성 반응에 의한 급격한 배축의 신장은 식물체가 광원을 추가적으로 받도록 하는 수단임과 동시에 토양 속에서 발아된 묘가 토양을 뚫고 지표면 위로 나오는데 있어 중요한 역할을 한다(Josse와 Halliday, 2008; Jiao 등, 2007). 이러한 이유로 암상태의 케일, 다채, 브로콜리, 적양배추 그리고 알팔파는 광을 받기 위해 급격히 초장이 증대된 것으로 판단된다.
Table 2.
Shoot length of various sprouts at 7 days after sowing.
하지만, Raphanus 종인 홍빛 열무의 초장은 광조건에서 4.06cm, 암조건에서는 2.51cm로 광조건에서 유의적으로 높았다. 새싹 채소들 중 가장 큰 초장 값을 나타낸 것은 무 새싹으로, 광조건에서 5.21cm를 기록했지만 암조건과 비교하여 유의적인 차이는 보이지 않았다. 이러한 결과는 생체중의 결과와 일치한다. 7일간 광에 의한 무 새싹의 초장 증대는 Sun-type 엽록체 의해 광합성 능력이 증가되어 나타난 결과일 수 있다(Lichtenthaler, 1979). 이러한 결과는 무 새싹을 8일간 4가지의 다양한 광질의 광조건(암조건, 형광등, 적색 LED, 청색 LED)에 옮겨 주었을 때 암조건에 비해 광조건(청색 LED)에서 생체중이 유의적으로 증대된 AbdElgader등(2015)의 결과와도 일치한다. 하지만 우리의 결과와 반대되는 결과 또한 보고되었으며 이것은 품종에 따른 반응일 수 있다(Park 등, 2013). 새싹 채소 수확 시 적절한 초장 길이는 작물의 품종에 따라 달라지며, 고품질의 새싹을 수확하는데 있어 제한적인 요인은 짧은 초장과 생육의 불균일성이라 할 수 있다. 우리의 실험에서 새싹 채소의 초장은 작게는 1.2cm에서 길게는 5.2cm까지 다양했지만 외관상으로 보았을 때 균일함을 보였기 때문에 상업적으로 이용하는데 있어 큰 문제가 없을 것이라 생각된다.
초장 이외에도 광조건과 암조건에서 재배된 새싹을 육안으로 관찰하였을 때 색과 모양에서 뚜렷한 차이를 보였다(Figs. 3와 4). 전반적으로 광조건에서 재배된 새싹은 녹색을 암조건에서는 황색을 띄었다. 녹색 빛을 띈 새싹 채소는 광조사에 의한 광합성 작용으로 생성된 엽록소(엽록소 a)에 의한 것이며, 황색 색소는 새싹이 엽록소를 합성하지 못하여 카로티노이드가 발현되어 나타난 결과이다(Green과 Durnford, 1996). 하지만 적양배추는 광조건에서 검붉은 색을 암조건에서는 분홍색을 띠었는데, 이러한 결과는 식물 세포 내 안토시아닌 생합성 정도의 차이에 의한 것일 수 있다. 식물 조직에서 안토시아닌의 생합성은 빛에 의존적이며 광에 노출된 시간이 증가될수록 그 발현이 강화된다(Mancinelli, 1985). 일반적으로 안토시아닌은 가시광선(290-750nm)에 장기간 노출되었을 때 안토시아닌 생합성과 관련된 유전자 발현이 자극되어 색소가 발현된다(Mancinelli, 1985). 이러한 이유로 광조건에서는 광의존성 안토시아닌의 합성으로 어두운 자색을 나타내었고, 암조건에서는 안토시아닌이 발현될 만큼의 광이 조사되지 않아 분홍빛을 띤 것으로 생각된다(Boo와 Lee, 1999).
3. 광의 유무가 7가지 새싹 채소의 생리활성 화합물 함량에 미치는 영향
3.1 십자화과 채소 및 알팔파의 총 페놀 함량과 항산화도
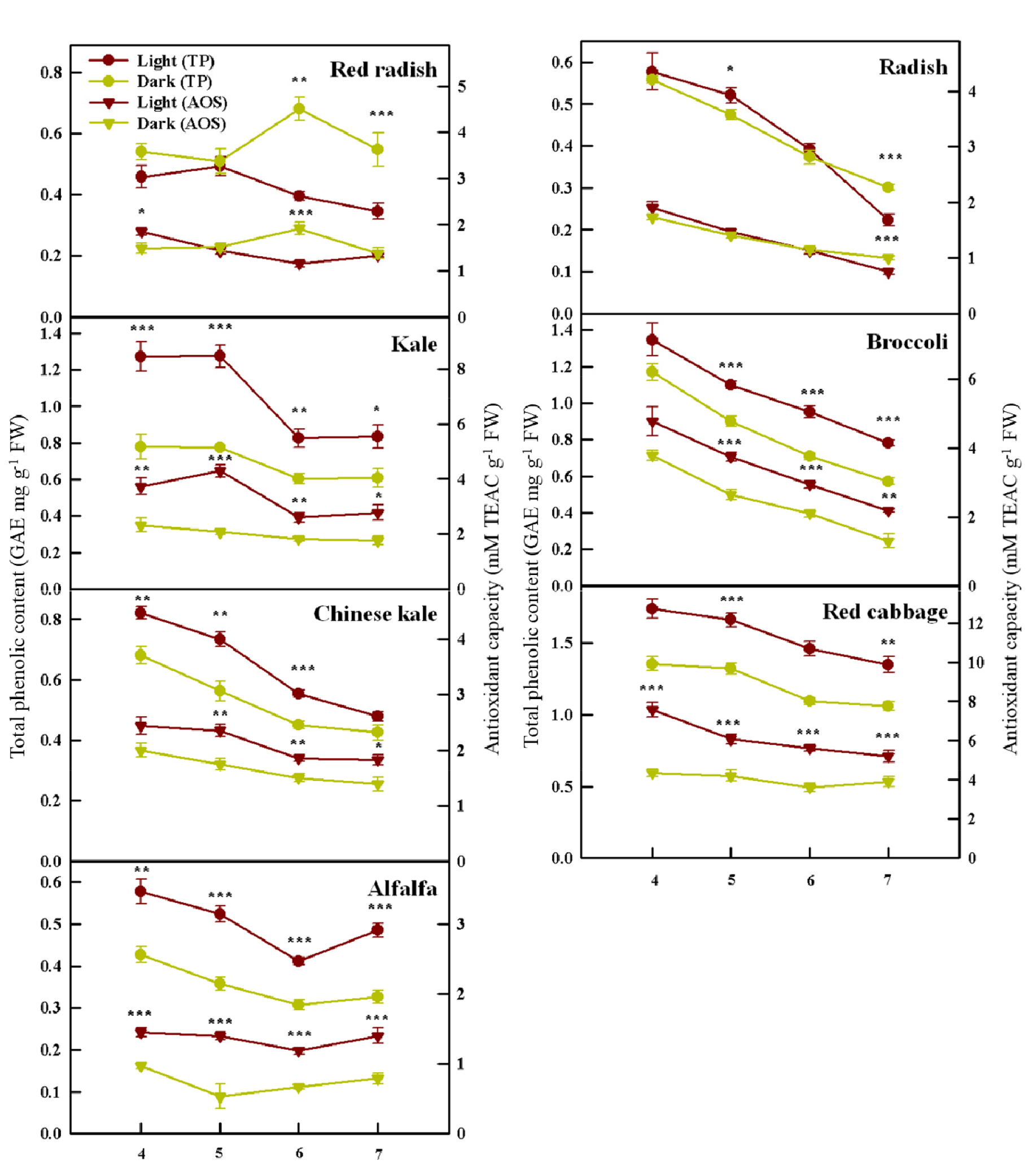
광조건과 암조건 하에서 재배된 다양한 새싹 채소의 총 페놀 함량 그리고 항산화도는 종에 따라 서로 다른 반응을 나타냈다(Fig. 5). 파종 후 4일째 광조건에서 재배된 십자화과 새싹 채소(케일, 다채, 브로콜리, 적양배추)의 총 페놀 함량이 가장 높다가 시간이 지남에 따라 점차 감소하는 경향을 보였다. 알팔파는 파종 후 4일째에서 6일째까지는 십자화과 품종과 비슷하게 광조건에서 총 페놀 함량이 감소하는 경향을 보이다가 처리 종료일인 7일째에 급격히 높아졌다. 항산화도 또한 총 페놀 함량과 비슷한 경향을 보였다. 십자화과 및 콩과 작물 새싹은 총 페놀 함량과 마찬가지로 모두 광조건에서 항산화도가 높았다. 십자화과 채소는 총 페놀 함량과 비슷하게 파종 후 4일째에 광조건에서 가장 높은 항산화도를 보였다가 시간이 지나면서 점차 감소하였다. 하지만 케일은 파종 후 4일째 보다 5일째에 더 높은 항산화도를 기록하였다. 알팔파는 총 페놀 함량과 비슷한 경향을 보이긴 했지만 생육 전기간 동안 거의 비슷한 함량을 보였다.
본 실험의 결과는 십자화과 종인 브로콜리와 콩 새싹에 광과 암처리를 해 주었을 때 광조건(형광등, 적색, 청색, 황색, UV-B) 아래에서 총 페놀 함량, 항산화도, 비타민 C등과 같은 생리활성 물질 함량이 더 높아진 이전 연구 결과와 일치한다(Chen와 Chang, 2015; Jiao 등, 2016; Liu 등, 2016; Pérez-Balibrea 등, 2008; Yuan 등, 2015). 발아하는 동안 흡수된 광은 새싹 채소의 페놀 화합물의 합성에 관여하는 malonyl-CoA pathway의 경로를 촉진하여 총 페놀 함량을 증대시킨다(Kim 등, 2006). 또한, 광은 flavonoids를 포함한 다양한 극성 이차대사산물의 함량을 증가시킬 수 있으며(Maldini 등, 2015), 이러한 화합물들은 건강 증진에 도움이 되는 매우 강력한 항산화 능력을 갖고 있다(Gorelik 등 2005; Hollman와 Katan, 1999; Plumb 등, 1997). 이전 연구 결과에 따르면 높은 광자 에너지를 가진 청색광과 UV-A 광 조사가 케일과 바질에서 총 페놀 함량을 증대시켰다(Bian 등, 2018; Smith 등, 2017). 또한 녹색광 또한 상추의 비타민 C, 안토시아닌 그리고 총 페놀 함량을 증대시켰다(Samuolienė 등, 2012). 따라서 우리가 사용한 LED 광원에서 녹색광과 청색광이 새싹 채소의 총 페놀 함량과 항산화도의 함량 증대를 유도했을 가능성이 존재한다.
3.2 홍빛 열무 및 무의 총 페놀 함량과 항산화도
Raphanus 속인 홍빛 열무와 무는 생육과 비슷하게 서로 다른 경향을 나타냈다. 홍빛 열무는 전 생육 기간 동안 암조건에서 총 페놀 함량이 높았다. 파종 후 5일째까지는 유의적인 차이를 보이지 않다가 파종 후 6일과 7일째에서는 암조건에서 그 값이 유의적으로 증대되었다. 무는 파종 후 6일째까지는 광조건에서 총 페놀 함량이 수치적으로 높다가 처리 종료일인 7일째엔 암조건에서 값이 유의적으로 증가하였다. 홍빛 열무와 무의 항산화도 결과는 총 페놀 함량과 거의 유사한 경향을 보였다.
이러한 광 유무에 따른 생리활성 물질 함량에 대한 결과는 McGregor(1988)와 Mastropasqua 등(2020)의 연구 결과와 일치한다. 일반적으로 무 새싹은 다른 새싹 채소와 비교하여 상당히 많은 양의 글루코시놀레이트 함량을 함유한다(Fenwick 등, 1983). 이전 연구에 따르면 광조건에서 발아된 새싹은 암조건에서 발아된 새싹(5, 6, 7일)과 비교하였을 때 전체 글루코시놀레이트가 품종에 따라 30-70%까지 감소됨이 보고되었다(Mastropasqua 등, 2020). 또한, 암조건과 광조건에서 발아된 병아리 콩 새싹의 비타민 C의 함량을 분석한 Riddoch 등(1998)의 논문에서도 완전한 암조건에서 5일간 자란 새싹에서 그 함량이 증대되었다. 다양한 품종의 완두콩을 암조건에서 재배하였을 때 종자 크기가 비교적 큰 품종에서 발아 7일째에 총 isoflavone, 총 페놀 함량 그리고 항산화도가 광처리구에 비하여 유의적으로 증대되었다(Eum 등, 2020). 하지만 우리의 결과와 반대되는 연구 결과들 또한 보고되었으며 이러한 차이는 품종 또는 광 처리의 강도와 지속 시간에 기인한 결과일 수 있다(Castillejo 등, 2021; Eum 등, 2020).
홍빛 열무를 제외하고 대부분의 새싹 채소의 생리활성 물질은 대체적으로 생육 초반에 높은 값을 가지다가 점차 감소하였다. 광조건의 경우에는 광조건에서 발아되는 동안 새로운 화합물이 합성되었을 가능성이 존재한다. 이러한 발아 일수 경과에 따른 생리활성 물질 함량의 감소는 이전 연구에서도 보고되었다(Oh와 Rajashekar, 2009). 이러한 생리활성 물질의 하향 조절은 생육의 급격한 증대에 의한 희석 효과일 수 있으며(Pérez-Balibrea 등, 2008), 또는 생육 단계에 따른 식물 생리활성 화합물의 변화에 의한 것일 수 있다(Vogt와 Gul, 1994).
결 론
광 ․ 암조건 아래에서 발아된 7가지 새싹 채소는 생육과 생리활성 물질 사이에서 서로 다른 반응을 보였다. 생육면에서는 비교적 종자 크기가 작은 케일, 다채, 브로콜리, 적양배추와 알팔파는 암조건에서 생체중이 유의적으로 높았고, Raphanus 속인 홍빛 열무와 무는 광조건에서 생체중이 유의적으로 증대되었다. 생리활성 물질 함량 면에서는 케일, 다채, 브로콜리, 적양배추와 알팔파는 총 페놀 함량 그리고 항산화도가 광조건에서 모두 높았고 Raphanus 속인 홍빛 열무와 무는 암조건에서 생리활성 화합물의 함량이 유의적으로 증대되었다. 전반적으로 새싹 채소의 생육과 생리활성 화합물 함량 사이에서는 반 비례적인 관계가 관찰되었다.
하지만 몇몇 생육기간에서는 생육과 관계하여 음의 상관관계가 나타나지 않았다. 그 중 하나인 홍빛 열무는 파종 후 5일째 광조건 암조건의 생체중을 보면 광조건 107.8(mg/sprout), 암조건 79.4(mg/sprout)로 생체중 값에서 큰 차이를 보였다. 하지만 생리활성 물질 함량은 광조건과 암조건에서 비슷한 함량을 나타냈다. 이것을 보아 홍빛 열무는 광조건 아래에서 파종 후 5일째 수확한다면 생육과 생리활성 물질 함량 모두 좋은 새싹 채소를 얻을 수 있을 것으로 생각된다. 케일의 경우엔 파종 후 5일째에, 광조건 18.3(mg/sprout), 암조건 21.8(mg/ sprout)로 생체중 값에 큰 차이를 보이지 않았다. 하지만 생리활성 물질 함량에서는 광조건 아래에서 값이 상대적으로 더 높았기 때문에(대략 2배 이상 증대), 광조건 아래에서 파종 후 5일째에 수확한다면 고품질의 새싹 채소를 수확할 수 있을 것이다. 추가적으로 다채, 알팔파, 브로콜리, 적양배추 또한 파종 후 4일째에는 광조건 암조건 사이에서 생체중이 유의적인 차이를 보이지 않지만 생리활성 물질 함량 면에서는 광조건에서 더 큰 값을 나타내어 파종 후 4일째 수확한다면 고품질의 최종 산물을 얻을 수 있다.
본 실험을 통해 발아 시 광의 유무에 따라 다양한 새싹 채소의 생육 그리고 생리활성 물질 함량 특성이 변할 수 있음을 확인하였다. 우리의 연구 결과는 고품질의 새싹 채소를 재배하기 위한 기초적인 정보를 제공하며 적절한 수확 시기의 결정은 고품질의 새싹 채소 생산을 위한 좋은 접근법이 될 수 있음을 보여준다.