서 론
재료 및 방법
1. 실험재료
2. 식물재배 및 재배환경
3. 수량 및 과실특성 조사방법
4. 생육조사 항목 및 측정방법
5. 엽병 즙액 내 양분 함량 측정 방법
6. 통계분석
결과 및 고찰
서 론
국내 방울토마토(Lycopersicon esculentum L.) 수경재배 면적은 2020년 기준 313ha로 일반토마토 수경재배 면적보다 44ha 더 넓다(KOSIS, 2020). 국내 소비자는 생식용으로 토마토를 주로 구매하기에 소과종인 방울토마토의 인기가 높다. 대추방울토마토는 기존의 방울토마토보다 당도가 높고 경도가 우수해 열과 발생이 적어 상품성이 좋다. 2022년 기준 지난 3년 평균 대추방울토마토의 월별 시세는 3월과 10월에 각각 kg당 7,031원과 7,293원으로 높았다(KAMIS, 2022). 시세가 높은 3월과 10월에 맞춰 토마토를 출하하기 위해서는 토마토 재배 작형을 다형화하여 연중 생산하는 방법이 있다. 수경재배 시설은 작물 수확 후 철거 및 정식 준비 기간이 짧고 인터플랜팅 기법(interplanting method)을 사용해 토마토를 연중 생산할 수 있다. 인터플랜팅은 이미 수확되고 있는 작물 사이에 새로운 모종을 미리 정식하여 수확 시기를 앞당기는 방법으로 공백기 없이 과실 생산이 가능하다.
토마토 작형은 크게 8월 상중순에 파종하는 촉성재배와 저온기에 육묘하는 반촉성재배, 고온기 육묘하는 억제재배로 나눌 수 있다. 이 중 토마토 반촉성재배는 남부 지방의 경우 10월 하순에서 11월 하순 사이에 파종하는데 온도가 낮고 일조량이 부족한 시기에 육묘되어 정식 후 저온 스트레스에 노출되는 경우가 많다(RDA, 2018). 토마토는 아열대성 원예작물로 주간 생육적온은 21에서 28℃이고 야간 생육적온은 15에서 20℃이며 12℃ 이하가 되면 생장이 멈춘다(Monte 등, 2013; Criddle 등, 1997). 전국을 기준으로 2021년 12월부터 2022년 2월까지의 월별 평균 기온은 0.3℃로(KMA, 2022) 겨울철 온실 내부 온도를 토마토 생육적온까지 올리기 위해서는 난방이 필수이다. 겨울철 온실 난방을 위한 화석 연료 사용의 급증은 탄소 배출을 증가시켜 지구 온난화를 급격화시키는 환경 문제로도 이어진다(Ploeg와 Heuvelink, 2005). 저온에 내성을 갖는 토마토를 재배하면 온실 내 난방 설정온도가 낮아지고 탄소 배출이 줄어들며 난방 비용이 절감된다. 겨울철 토마토 재배는 보온을 위해 온실 환기가 자유롭지 못해 습도가 높아져 병 발생이 많아지고 배지의 과습으로 뿌리 발육이 원활하지 못하다. 또한 인터플랜팅으로 정식하면 수확 공백기를 없앨 수 있지만 같은 배지를 사용하기 때문에 생리장해나 병충해의 위험부담이 올라갈 수 있다. 접목 토마토는 대목 뿌리가 강해 활착률이 높아 생육 후기까지 세력을 유지하며 수량성이 높은 장점이 있어 이 같은 각종 환경 스트레스를 견디기에 적합하다.
접목 토마토는 대목이 저온에서도 생육이 왕성하여 양수분 흡수 효율이 높아져 접수 생장이 정상적으로 이루어진다(Huang 등, 2016). 생육 초기 영양생장하는 토마토 식물체의 생장속도는 상대생장률로 표현하고(Ploeg와 Heuvelink, 2005) 정식 후 70내지 80일에 최대 생장률을 보인다(Monte 등, 2013). 토마토 수량성은 독립적인 특성이 아닌 작물 전체 생장에 따라 달라지기 때문에 작물 형태 및 생리학적 특성과 생육 조건 간의 상호작용에 따라 결정된다(Ploeg와 Heuvelink, 2005). 접목 토마토는 생육초기 영양생장의 발달로 상대생장률이 증가하여 수량성이 높아지지만(Latifah 등, 2021) 생육적온 이하의 온도 조건에서 토마토 식물체의 생장은 감소한다. 저온 스트레스는 토마토의 생장률을 감소시켜 수확 시기를 늦추는데(Adams 등, 2001), 이 때 접목묘를 사용하면 저온에 내성을 가져 생육적온 이하에서도 생장률을 유지해 수확 시기를 앞당길 수 있다. 수경재배 시설은 작업 편리성이 높고 장기재배가 가능해 1주 당 수량이 많아지면 곧바로 농가 소득 증대로 이어진다. 저온기 육묘의 단점 극복과 각종 환경 스트레스에 대한 저항성을 위해 대목의 사용이 권장된다. 그러나 국내에서 사용하는 대목은 주로 일본이나 유럽 품종으로 가격이 높기 때문에 저렴한 가격에 보급 가능한 동시에 시판 대목 품종에 경쟁력을 가지는 국내산 대목 개발 및 보급이 필요하다.
접목 토마토의 대목은 양수분을 효율적으로 흡수하여 과실 수량이 증대되는 효과를 가진다(Albornoz 등, 2018). 접목 토마토가 높은 수량성을 가지는 이유는 대목이 강한 뿌리 활력을 가져 접수로 식물 호르몬과 질소와 같은 양분의 흡수 및 이동이 원활하여 광합성률이 높아지고 각종 환경 스트레스에 대한 저항성이 높아져 식물체가 건강하기 때문이다(Sharma 등, 2019). 토마토 수량성을 결정짓는 요인으로 식물체 내 질소 함량 수준을 들어 평가할 수 있다(Llanderal 등, 2020). 식물체 내 질소는 식물 호르몬, 단백질 및 엽록소 등을 포함하는 유기 화합물들의 가장 큰 구성 원소이며 칼륨은 광합성과 세포의 삼투퍼텐셜을 조절하는 호흡에 관여하는 효소들의 활성제이다(Lee 등, 2016). 작물의 생장과 과실 수량에 중요한 질소와 칼륨(Beverly, 1994)은 비색법(colorimetric method)을 이용해 엽내 함량 수준을 측정할 수 있다(Bischoff 등, 1996). 비색법 중 test strip을 사용하는 Reflectometer는 농가 현장에서도 실시간으로 분석 가능하고 측정값이 정확해 활용성이 높다(Rodrigo 등, 2005). 대목 성능에 따라 토마토의 생장과 수량이 달라지고 이에 따라 체 내 양분 함량에도 차이를 보일 것으로 판단된다.
따라서 본 연구는 반촉성 수경재배시 방울토마토 접목묘의 대목 종류에 따라 나타나는 생육과 수량 변화를 비교 분석하고 Reflectometer를 활용한 엽병 즙액 분석을 통해 질산태 질소와 칼륨 함량을 측정하여 국내 개발 대목의 성능을 검정하고자 수행하였다.
재료 및 방법
1. 실험재료
대목 계통 및 품종 4종류 ‘HSF4’(National Institute of Horticultural and Herbal Science, Korea), ‘21LM(Bunongseed, Korea), ‘21A701’(Bunongseed, Korea), ‘B-blocking’(Takii, Japan)과 접수품종으로 대추방울토마토(Lycopersicon esculentum L.) ‘Nonari’(Namnong, Korea)를 사용하여 접목한 처리구 4개와 비접목 처리구 1개를 사용하였다. 2021년 11월 4일에 대목 종자 4종류와 접수 종자 1종류를 128구 트레이에 파종하였고, 11월 28일에 대목묘는 40구 트레이에 가식하였다. 12월 9일에 합접법으로 접목하였고 접목 직후 활착실(온도 25℃, 상대습도 80% 이상)에 옮겨 6일간 두었다. 접목묘가 활착실에서 나온 후 접목 부위가 완전히 붙을 때까지 접목 클립을 그대로 두었다. 실생묘는 접목묘와 같은 식물체 크기로 정식하기 위해 11월 14일에 파종하였고 모든 처리구는 12월 23일에 정식하여 육묘기간은 총 49일이 소요되었다.
2. 식물재배 및 재배환경
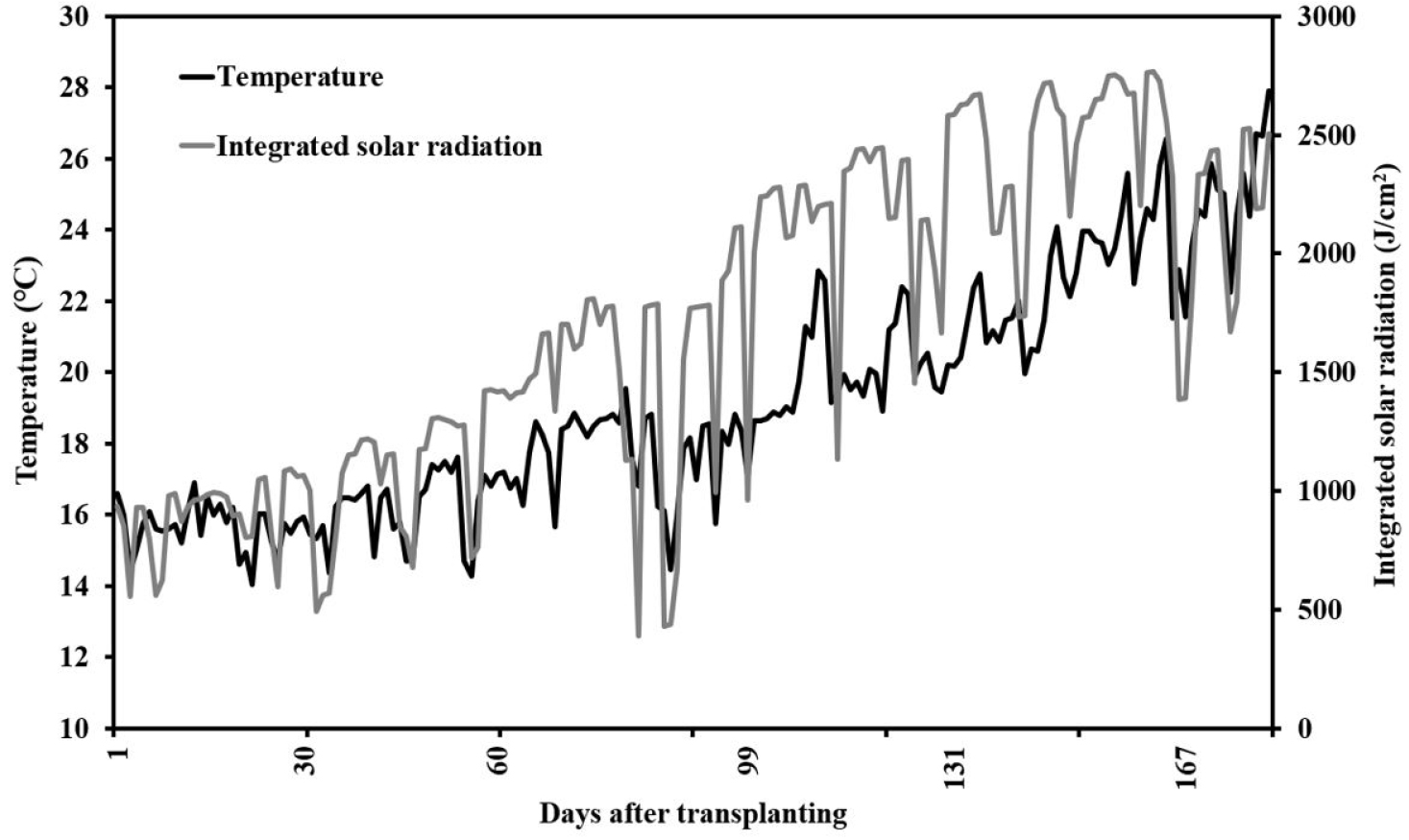
본 실험은 연동형 수경재배 비닐 온실(폭 7m, 길이 110m, 동고 6m; 전북 정읍 소재)에서 수행하였다. 대추방울토마토 접목 처리구 4개와 비접목 처리구 1개를 15주씩 3반복 난괴법으로 배치하여 재식거리 160cm × 25cm로 이미 수확되고 있는 완숙토마토 사이에 인터플랜팅 기법을 사용하여 정식하였다. 코코피트 배지(Duck Yang Coco, Korea; 가로 20cm, 세로 100cm, 높이 10cm)에 모종이 들어갈 자리를 만들어 놓고 드리퍼로 모종의 상토를 고정시켜 정식하였다. 공급 배양액은 pH 6.0, EC 2.5 dS·m-1 수준으로 조정한 Grodan 토마토 표준용[5{Ca(NO3)2·2H2O}·NH4NO3 75.48kg, Ca(NO3)2·4H2O 16.42kg, KNO3 37.37kg, Fe-EDTA 2.75kg, KH2PO4 22.22kg, MgSO4·7H2O 54.68kg, K2SO4 27.16kg]을 사용하였다. 배양액 공급 횟수는 겨울철에 오전 10시부터 일몰 4시간 전까지 하루 5에서 6회(80mL/주)를 급액하였고 여름철에 오전 8시부터 일몰 2시간 전까지 하루 17에서 18회(100mL/주)를 자동 공급 장치(Magma 1000 Ver. 2.0, Green Control System Ltd, Korea)를 이용하여 급액하였다. 식물체 관리는 파스칼 유인하여 측지를 주기적으로 제거해주었으며 약광기와 강광기에 따라 최대 20매와 최소 10매의 잎을 남겨두고, 화방 적화 작업은 실시하지 않았고 모든 처리구 그대로 과실이 맺히도록 두었다. 일별 온실 내부 온도와 적산광량은 복합 환경 제어시스템(Magma multivariable controller Ver. 2.4, Green Control System Ltd, Korea)으로 환경 데이터를 수집하였다.
3. 수량 및 과실특성 조사방법
토마토 수량은 정식 후 99일(2022년 3월 31일)부터 정식 후 167일(6월 7일)까지 1주일 간격으로 11주 동안 처리당 15주를 조사하였다. 수확한 토마토는 개체별로 평균 과중, 과실 개수, 과실의 세로 길이(과경) 및 가로 길이(과폭)를 측정하였다. 과중은 전자저울(KS-308, Dretec, Japan)로 조사하였으며 과경과 과폭은 디지털 버니어 캘리퍼스 150mm(IP67, Futuro, Switzerland)를 이용하여 처리별로 과실 5개를 1회씩 조사하였다.
4. 생육조사 항목 및 측정방법
토마토의 생육은 줄기 직경(경경), 개화위치, 엽장 및 엽폭을 조사하였으며 정식 후 131일(2022년 5월 2일)부터 정식 후 160일(5월 31일)까지 5주 동안 수행하였다. 줄기직경은 유인줄에 7일 전 생장점이 있던 위치를 표시하고 그 표시점에 위치해 있는 줄기의 두께를 디지털 버니어 캘리퍼스 150mm(IP67, Futuro, Switzerland)를 이용하여 측정하였으며 측정 부위가 마디에 있다면 마디 바로 아랫부분을 측정하였다(Kim 등, 2010). 개화 위치는 꽃이 한 개라도 만개한 최상위 화방과 생장점 사이 기부 거리를 측정하였다. 엽장과 엽폭은 그 최상위 화방의 바로 밑에 있는 잎 전체의 길이와 너비를 측정하였다.
5. 엽병 즙액 내 양분 함량 측정 방법
토마토 엽병 즙액 내 NO3-N과 K+ 함량은 정식 후 60일, 111일 및 167일에 생장점으로부터 5번째 또는 6번째 위치한 잎을 처리별 9주에서 2장씩 총 18장을 채취하여 실험에 사용하였다. 엽 채취 1시간 이내에 엽병을 분리하고 엽병 무게를 처리별로 동일하게 맞춰 갈릭프레스로 착즙하여 즙액을 확보하였다. 엽병 즙액 0.5mL를 50mL 튜브에 증류수와 100배 희석하여 Reflectometer RQflex® 20(Merch, Germany)로 NO3- 농도를 측정하였다. NO3-N 함량은 NO3- 측정값에 희석배율 100을 곱해주고 4.43으로 나누어 계산하였다(Hochmuth, 1994). K+ 함량은 즙액 0.5mL를 5mL 튜브에 증류수와 10배 희석하여 동일한 기기로 측정하였다.
6. 통계분석
통계분석은 R(RStudio, 2022.02.0 Version, USA)을 이용하여 평균 간 비교를 Duncan’s multiple range test(DMRT) 검정을 통해 95% 신뢰수준에서 차이를 확인하였다.
결과 및 고찰
정식 후 99일에 수확을 시작하여 정식 후 139일까지 처리 간 주당 누적 수량은 유의적인 차이를 보이지 않았다(Fig. 1). 정식 후 146일에 ‘21A701’과 ‘21LM’ 처리구의 주당 누적 수량은 각각 1,951g과 1,921g으로 높았고 비접목 처리구는 1,607g으로 낮았다. 정식 후 153일에 ‘21A701’의 주당 누적 수량은 ‘21LM’보다 7% 높았고 ‘HSF4’는 수량이 점차 감소하기 시작하였다. 정식 후 167일의 주당 총 수량은 ‘21A701’이 3,387g으로 높았고 비접목 처리구와 ‘HSF4’가 각각 2,658g과 2,573g으로 낮았다. 본 실험의 대추방울토마토는 12화방을 수확하였고 8화방(정식 후 146일)부터 처리 간 주당 누적 수량이 유의적인 차이를 보이기 시작하였다. Soe 등(2018)의 실험결과, 접목 토마토의 주당 총 수량은 비접목 토마토보다 36% 높았다. 본 실험결과는 ‘21A701’의 주당 총 수량이 비접목 처리구보다 22% 높았고 ‘HSF4’보다 24% 높았다. 대목과 접수 간의 접목 친화성이 낮으면 물관 내 식물 호르몬과 양수분의 수송이 원활하지 못해(Sharma 등, 2019) 수량 증가 효과가 낮다(Romano와 Paratore, 2001). ‘HSF4’가 비접목 처리구보다 주당 총 수량이 낮은 이유는 접목 친화성이 낮기 때문으로 판단된다. 대목 ‘21A701’과 ‘21LM’은 시판 대목 품종인 ‘B-blocking’보다 주당 총 수량이 각각 368g과 108g 더 많아 수량이 높았다.
평균 과중은 ‘21A701’이 14.6g으로 높았고 ‘HSF4’가 12.2g으로 낮았다(Table 1). 대조 대목품종 ‘B-blocking’의 평균 과중은 14.3g으로 ‘21A701’의 과중은 0.3g 더 높았고 ‘HSF4’는 2.1g 더 낮았다. 처리 간 과실 개수는 적화 작업을 따로 하지 않았음에도 유의한 차이를 보이지 않았다. 과경은 처리 간 유의한 차이가 없었고 과폭은 ‘21A701’이 29.8mm로 컸고 ‘HSF4’가 28.1mm로 작았다. 처리 간 토마토 수량이 다른 이유는 평균 과중의 차이(Pogonyi 등, 2005)로 ‘21A701’의 주당 총 수량이 많고 ‘HSF4’가 적은 이유는 과중이 다르기 때문인 것으로 판단된다.
Table 1.
Average fruit weight, the total number of fruits, average fruit length, and average fruit diameter of non-grafted and grafted tomatoes in hydroponics.
| Graft combination |
Fruit weight (g) | No. of fruits |
Fruit length (mm) |
Fruit diameter (mm) | |
| Scion | Rootstock | ||||
| Nonari | HSF4 | 12.2 cz | 211 a | 40.8 a | 28.1 c |
| Nonari | 21LM | 13.6 abc | 231 a | 41.5 a | 29.2 ab |
| Nonari | 21A701 | 14.6 a | 232 a | 41.9 a | 29.8 a |
| Nonari | B-blocking | 14.3 ab | 213 a | 42.0 a | 29.4 ab |
| Nonari | - y | 13.1 bc | 205 a | 41.3 a | 28.9 b |
정식 후 139일에 ‘21A701’의 줄기직경은 10.02mm로 두꺼웠고 ‘HSF4’는 8.30mm로 얇았다(Table 2). 정식 후 146일에도 마찬가지로 ‘21A701’의 줄기직경이 9.58mm로 두꺼웠고 ‘HSF4’는 7.28mm로 얇았다. 정식 후 160일에는 ‘21A701’이 8.26mm로 두꺼웠고 ‘HSF4’와 비접목 처리구가 각각 7.40mm와 7.23mm로 얇았다. 줄기직경의 평균값을 계산한 결과, ‘21A701’은 ‘B-blocking’보다 줄기직경이 6% 더 두꺼웠고 ‘HSF4’는 13% 더 얇았다. 정식한 날(2021년 12월 23일)부터 정식 후 60일(2022년 2월 20일)까지 일평균기온은 15.9℃로 토마토 생육적온인 18-27℃(Suchoff 등, 2018)보다 낮은 온도를 보였다(Fig. 2). 토마토 초기 생장은 정식 후 70일에서 80일까지 지수적으로 증가하는데(Monte 등, 2013) 이 때 생육적온 이하의 조건에서는 상대생장률이 감소한다(Ploeg와 Heuvelink, 2005). 토마토는 아열대성 원예작물로 12℃ 이하가 되면 생장이 멈춘다(Criddle 등, 1997). 본 실험에서 정식일부터 정식 후 73일까지 야간 최저 온도는 12℃를 기록했다. ‘21A701’이 수량이 많은 이유는 생육 초기 낮은 야간 온도 조건에서부터 생장을 유지해 생육 후기까지 세력을 유지하였기 때문으로 판단된다. 대목 ‘HSF4’는 접수 ‘Nonari’와 접목 친화성이 낮아 생육 초기 뿌리 형성과 활착이 다른 처리구에 비해 약해 작물체 세력이 약하여 줄기직경이 얇은 것으로 판단된다. ‘21A701’은 뿌리 활력이 강해 생육 초기 세력을 생육 후기까지 유지하여 줄기직경이 두껍고 수량이 많은 것으로 판단된다.
Table 2.
Changes in the stem diameter of non-grafted and grafted tomatoes grown in hydroponics.
| Graft combination | Stem diameterz (mm) | |||||
| Scion | Rootstock | 139y | 146 | 153 | 160 | |
| Nonari | HSF4 | 8.30 bx | 7.28 c | 7.03 b | 7.40 c | |
| Nonari | 21LM | 8.78 ab | 8.30 b | 8.60 a | 7.45 bc | |
| Nonari | 21A701 | 10.02 a | 9.58 a | 8.58 a | 8.26 a | |
| Nonari | B-blocking | 8.80 ab | 9.08 ab | 8.64 a | 7.99 ab | |
| Nonari | - w | 8.82 ab | 8.10 bc | 8.05 ab | 7.23 c | |
zStem diameter was expressed as the average diameter of the stem. The stem diameter was measured at the place where the growing tip was at 7 days before measurements were taken.
정식 후 131일의 ‘21A701’의 엽폭은 17.3cm로 컸고 ‘HSF4’은 11.8cm로 작았다(Table 3). 정식 후 160일의 ‘21LM’의 엽폭은 18.0cm로 컸고 비접목 처리구는 12.9cm로 작았다. 정식 후 139일에 ‘21A701’의 개화위치는 21.3cm로 높았고 비접목 처리구는 11.7cm로 낮았다(Table 4). 정식 후 153일에는 ‘21LM’의 개화위치가 18.0cm로 높았고 비접목 처리구가 9.6cm로 낮았다. 정식 후 160일의 비접목 처리구의 개화위치는 10.1cm로 처리구 중 가장 낮은 값을 보였다. 개화위치는 식물체가 영양생장상인지 생식생장상인지를 판별할 수 있는 생육지표이다(Stradiot과 Battistel, 2003). 생육 후기로 갈수록 ‘21LM’의 개화위치는 5% 감소한 반면, 비접목 처리구의 개화위치는 39% 감소하였다. 비접목 처리구는 접목 처리구보다 생식생장상으로 전환되는 속도가 빨라 수량이 적은 것으로 판단된다. ‘21LM’은 생장상의 균형을 유지하여 생육 후기까지 많은 수량을 보인 것으로 판단된다.
Table 3.
Changes in the leaf length and width of non-grafted and grafted tomatoes grown in hydroponics.
| Graft combination | Leaf length and width (cm) | |||||||||||||||
| 131z | 139 | 146 | 153 | 160 | ||||||||||||
| Scion | Rootstock |
Leaf length |
Leaf width |
Leaf length |
Leaf width |
Leaf length |
Leaf width |
Leaf length |
Leaf width |
Leaf length |
Leaf width | |||||
| Nonari | HSF4 | 21.7 ay | 11.8 b | 30.4 ab | 20.0 ab | 31.2 a | 17.0 ab | 27.2 ab | 16.4 ab | 26.4 ab | 16.5 ab | |||||
| Nonari | 21LM | 27.8 a | 15.8 ab | 31.2 ab | 20.8 ab | 33.3 a | 19.8 a | 31.6 a | 19.4 a | 29.4 a | 18.0 a | |||||
| Nonari | 21A701 | 28.1 a | 17.3 a | 33.6 a | 24.3 a | 30.8 a | 16.2 ab | 29.6 a | 16.6 ab | 28.7 a | 17.8 a | |||||
| Nonari | B-blocking | 24.6 a | 15.8 ab | 30.6 ab | 19.0 b | 31.3 a | 17.8 ab | 28.0 ab | 16.7 ab | 28.1 a | 15.8 ab | |||||
| Nonari | - x | 25.4 a | 14.4 ab | 25.4 b | 17.2 b | 24.6 b | 14.0 b | 24.6 b | 13.6 b | 22.9 a | 12.9 b | |||||
Table 4.
Changes in the flowering position of non-grafted and grafted tomatoes grown in hydroponics.
| Graft combination | Flowering positionz (cm) | ||||||
| Scion | Rootstock | 131y | 139 | 146 | 153 | 160 | |
| Nonari | HSF4 | 18.0 abx | 17.0 ab | 10.4 c | 13.5 abc | 14.7 a | |
| Nonari | 21LM | 16.5 ab | 17.8 ab | 16.2 ab | 18.0 a | 15.7 a | |
| Nonari | 21A701 | 18.9 a | 21.3 a | 17.6 a | 14.8 ab | 14.4 a | |
| Nonari | B-blocking | 17.5 ab | 13.8 ab | 12.4 b | 11.8 bc | 13.9 a | |
| Nonari | - w | 14.0 b | 11.7 b | 10.6 c | 9.6 c | 10.1 b | |
정식 후 60일과 111일에 엽병 즙액 내 NO3-N과 K+ 농도는 처리 간 유의한 차이를 보이지 않았다(Table 5). 정식 후 167일에 ‘21LM’의 NO3-N 농도는 1,746mg·L-1으로 높았고 그 다음으로 ‘21A701’과 ‘B-blocking’이 각각 1,580mg·L-1과 1,415mg·L-1이었으며, 비접목 처리구와 ‘HSF4’가 각각 1,252mg·L-1과 1,245mg·L-1으로 낮았다. 접목묘의 체 내 칼륨 함량은 실생묘보다 높다는 연구결과(Huang 등, 2013)와는 달리, 본 실험 결과 처리 간 엽병 즙액 내 칼륨 함량의 차이는 보이지 않았다. 생육 후기로 갈수록 식물체 내 양분 함량 농도가 감소한다는 연구결과와 같이(Rodrigo 등, 2005) 본 연구결과, NO3-N와 K+ 함량 수치가 생육 후기로 갈수록 점차 감소하는 양상을 보였다. 엽내 양분 함량 차이는 대목과 접수의 접목 조합에 따라 다르게 나타나고(Goto 등, 2013), 엽병 즙액을 통해 작물 전체의 질소 함량 수준을 알 수 있으며 체 내 질소 함량 수준에 따라 수량성이 결정된다(Llanderal 등, 2020). 정식 후 167일에 ‘21LM’의 주당 누적 수량과 NO3-N 농도 모두 높아 엽병 즙액 분석을 통한 양분함량 측정으로 대목의 성능을 평가할 수 있으며 공급하는 양분의 양을 조절할 수 있을 것으로 판단된다.
Table 5.
Tomato fresh petiole sap NO3-N and K+ concentration throughout the harvesting season at 60, 111, and 167 days after transplanting in non-grafted and grafted tomatoes in hydroponics.
| Graft combination | Fresh petiole sap concentration (mg·L-1) | |||||||||
| 60z | 111 | 167 | ||||||||
| Scion | Rootstock | NO3-N | K+ | NO3-N | K+ | NO3-N | K+ | |||
| Nonari | HSF4 | 2,155 ay | 7,420 a | 1,824 a | 6,988 a | 1,245 d | 6,280 a | |||
| Nonari | 21LM | 2,093 a | 7,545 a | 1,995 a | 7,010 a | 1,746 a | 6,200 a | |||
| Nonari | 21A701 | 2,107 a | 7,787 a | 1,772 a | 6,820 a | 1,580 b | 6,287 a | |||
| Nonari | B-blocking | 2,084 a | 7,360 a | 1,790 a | 6,740 a | 1,415 c | 6,160 a | |||
| Nonari | - x | 2,168 a | 7,413 a | 1,845 a | 6,947 a | 1,252 d | 6,220 a | |||