서 론
재료 및 방법
1. 식물재료 및 재배환경
2. 삽목묘의 생육특성 분석
3. 엽록소형광분석
4. 통계분석
결과 및 고찰
1. 삽수 채취시기와 오옥신 처리가 생존율에 미치는 영향
2. 삽수 채취시기와 오옥신 처리가 생육에 미치는 영향
3. 삽수 채취시기와 오옥신 처리가 광합성에 미치는 영향
서 론
딸기(Fragaria × ananassa Duch.)는 전 세계적으로 널리 재배되는 경제적으로 중요한 원예작물로, 2018년 딸기 국내 생산액은 12,936억원에 이르며 우리나라 전체 과채류 생산액의 25.1%를 차지하고 있다(MAFRA, 2019). 그 중 촉성재배 시설딸기는 10a당 소득이 11,728천원으로, 소득률이 50.2%로 높은 고소득 작물이다(RDA, 2020).
딸기 재배에 있어서 고품질 묘 생산은 전체 비중의 80%를 차지할 정도로 과실의 생산량과 품질에 결정적인 영향을 미치는 요인이다(Jun 등, 2014). 딸기 포트 육묘는 5~6개월의 긴 육묘 기간을 거치며 좁은 재식밀도로 인해 묘가 도장하거나 묘소질이 불균일해지는 단점이 있는데, 묘소질이 불균일하면 정식 후 개체 간 생장 차이가 심하고 화아분화가 불균일해져 생산성이 저하된다(Kim 등, 2018).
최근 유럽에서는 딸기의 육묘 기간을 단축하고 균일한 묘를 생산하기 위한 방법으로, 과실을 생산한 모주에서 이듬해의 고온장일 조건 하에서 생산된 자묘를 삽수로 채묘한 후 육묘하는 삽목법이 시도되고 있다(Kang 등, 2011). 삽목 육묘는 3개월이라는 비교적 짧은 육묘 기간으로 묘 생산이 가능하며 일시 채묘로 노동력 절감과 동시에 균일한 자묘를 확보할 수 있는 장점이 있지만, 삽목 후 1~2주 사이에 자묘의 생존율과 뿌리 활착을 유도하기 위한 환경 및 관수관리가 중요시되며 새 뿌리를 발생시키기 위한 많은 노력이 필요하다(Kim 등, 2018).
국외에서 딸기 육묘 시 환경조절 기술에 관한 연구로는 ‘Chandler’ 품종의 런너팁 채취 조건 등에 따른 특성 검정(Takeda와 Hokanson, 2001), 광선택적 네트 적용에 따른 ‘Festival’ 품종의 반응 비교(Takeda 등, 2010) 등이 수행되었다. 국내 품종을 대상으로 한 육묘 기간 단축 연구로는 폐쇄형 육묘 시스템에서 광합성유효광량자속에 따른 ‘매향’ 딸기의 자묘 생산(Kim 등, 2010), ‘매향’ 딸기의 삽목 번식 시 관수방법(Kim 등, 2018) 등이 수행되었다. 일반적으로 대부분의 작물에서 삽목 번식 시 발근율 및 뿌리 발달에 영향을 미치는 요인으로는 삽목시기, 발근촉진물질, 습도유지, 관수방법 등이 있다고 알려져 있다(Kim과 Kim, 2012).
이러한 관련된 기존 연구들의 결과에 비추어볼 때, 딸기 삽목 육묘 시 삽수 채취시기와 식물생장조절제는 삽목묘의 생육에 영향을 줄 수 있을 것으로 예상된다. 이에 본 논문은 삽수 채취시기에 따른 적정 오옥신의 종류와 농도를 설정함으로써 삽목묘의 생존율을 높이고 뿌리 활착 증진이 가능할 것이라는 가설 하에, 국내에서 80% 이상을 점유하고 있는 ‘설향’ 딸기를 대상으로 삽수 채취시기와 식물생장조절제의 적용에 따른 생육 특성을 비교하고 그 현장 적용 가능성을 확인하기 위해 수행되었다.
재료 및 방법
1. 식물재료 및 재배환경
‘설향’ 딸기(Fragaria ×ananassa Duch. cv. Seolhyang) 삽수는 익산시에 소재한 전라북도농업기술원에서 2018년 9월부터 2019년 5월까지 수경재배한 묘에서 발생한 자묘를 대상으로 하였다. 이때 1~2번째 발생 자묘 중 전개엽이 2~3매인 묘를 2019년 6월 7일과 7월 5일의 2차례에 걸쳐 채묘하였으며, 3℃에 냉장보관한 후 2019년 7월 12일에 딸기 전용 포트(24구 A형, 60×34×10cm, Hwaseong Industrial Co. Ltd., Korea)에 혼합 상토(Myung Jin Joo, Homan Industrial Co. Ltd., Korea)를 충진하여 1구당 1개의 삽수를 삽목하였다.
‘설향’ 딸기 삽목 육묘 시 식물생장조절제의 효과를 평가하기 위하여 삽수 삽목 시에 오옥신 IBA와 NAA를 각각 0.025, 0.05, 0.1%로 농도를 달리하여 처리하였다. 냉장보관했던 삽수의 기부를 오옥신에 3초간 침지 후 상토에 삽목하였으며, 증류수 침지를 대조구로 두었다.
삽목한 묘는 전라북도농업기술원 고설 육묘장 내에서 소형비닐터널을 제작한 뒤 직사광선 차단과 온‧습도 유지를 위해 부직포, 비닐, 35% 차광막 순으로 덮고 표면이 마르지 않을 정도로 10일간 관수하였다. 10일 후 소형터널의 부직포, 비닐, 차광막을 제거한 뒤 본포 정식 한 달 전까지 딸기 야마자키 전용 양액을 EC 0.8dS·m-1, pH 6.0으로 맞추어 모든 처리구에 동일하게 관주하였다. 육묘기 동안 탄저병, 흰가루병, 진딧물, 응애 등의 주요 병해충 방제를 위하여 주기적으로 적용 약제를 살포하여 관리하였으며, 2019년 9월 23일에 묘를 정식하였다.
육묘장 내부 온‧습도는 데이터로거(TR-72wf, TandD Co. Ltd., Japan)를 이용해 60분 간격으로 측정하였다. 터널재배 후부터 본포 정식 전까지 육묘 실험이 진행된 온실 내부의 평균 온도 및 상대 습도는 각각 28.0±4.9℃, 71.9±9.8%였다.
2. 삽목묘의 생육특성 분석
식물체의 엽장, 엽폭, 엽병장, 관부직경 등 생육은 특성조사 표준매뉴얼(RDA, 2017)에 따라 조사하였다. 생존율은 10일간 터널재배 후 3일 간격으로 6회 동안 달관 조사하였고, 전체 삽목묘 개수 대비 온전한 식물체로 볼 수 있는 묘의 수를 백분율로 표기하였다.
활착된 딸기를 대상으로 삽목 후 40일째와 본포 정식 시에 초장, 엽병장, 엽수, 관부직경, 생체중, 건물중 등을 조사하였다. 관부직경은 버니어캘리퍼스(CD-20CPX, Mitutoyo Co. Ltd., Japan)를, SPAD 값은 엽록소 측정기(SPAD-502, Konica Minolta Inc., Japan)를, 지상부와 지하부의 생체중과 건물중은 전자저울(Entris, Sartorius Inc., Germany)을 이용하여 측정하였다. 이때 건물중은 시료를 60℃의 항온 건조기(DH- 2009H, Korea Dry Tech., Korea)에서 72시간 건조 후 측정하였다.
3. 엽록소형광분석
삽목 후 43일째에 엽록소형광이미지장치(Chlorophyll fluorescence imaging; Closed Fluorcam FC 800-C, PSI, Drasov, Czech)를 이용하여 엽록소형광 지수를 측정하였다. 엽록소형광 조사를 위해 식물체를 20분간 암적응시킨 후 카메라와 식물체 간의 거리를 20cm로 고정하고 측정하였다. 엽록소형광 지수 획득을 위한 측정 기법은 Quenching Act2 방법을 이용하였으며, 개별 식물체에 대하여 엽록소형광 수준을 연속 측정하고 FluorCam7(Version.1.2.5.16, PSⅠ, Chez)을 이용하여 측정된 이미지에서 완전히 전개된 상위엽 1매 영역을 직접 분리하여 엽록소형광 지수를 획득하였다.
4. 통계분석
삽수 채취시기와 식물생장조절제의 종류 및 농도가 딸기 삽목묘에 미치는 영향을 확인하기 위해 실험구 및 대조구는 각 처리당 72개체씩 두었고, 완전임의배치법 3반복으로 배치하였다. 실험 결과의 통계분석은 R program(version 3.5.2)을 이용하여 분산분석(ANOVA)을 실시하였고, 던컨의 다중검정(Duncan’s multiple range test)을 이용해 95% 수준에서 각 처리구 간 유의성을 검증하였다. 그래프는 SigmaPlot program (SigmaPlot 8.0, Systat Software Inc., San Jose, CA, USA)을 이용하여 작성하였다.
결과 및 고찰
1. 삽수 채취시기와 오옥신 처리가 생존율에 미치는 영향
삽목묘의 생존율은 삽목 10일 후부터 3일 간격으로 6회 동안 조사하였다. 삽목 13일 후 생존율을 비교했을 때 오옥신을 처리하지 않은 대조구의 경우 6월 삽수 채취묘에서는 90.3%가 생존하였고 7월 삽수 채취묘에서는 88.9%가 생존하여, 6월 삽수 채취 시 생존율이 다소 높은 것을 확인할 수 있었다(자료 미제시). 세포분열이 왕성하게 이루어지고 있는 상태의 신초지를 이용한 것이 발근 촉진에 효과적이었다는 Lee 등(2002)의 기존 연구처럼, 삽수 채취시기에 따라 식물체 내에 존재하는 오옥신의 이동 및 농도에 차이가 발생하여 생존율에 차이가 나타난 것으로 생각되었다. 이는 또한 ‘선홍’, ‘매향’, ‘설향’, ‘아키히메’의 네 품종에서 여름 고온기에 대량으로 런너 묘 삽수를 채취할 경우 시간이 경과함에 따라 삽수가 시들어 활착률을 떨어뜨리는 요인으로 작용했다는 Rho 등(2009)의 연구와도 일치하는 결과였다.
삽수의 채취시기는 발근에 매우 중요한 역할을 하며(Bassuk과 Howard, 1981), 삽수 내의 C/N율과 발근 역시 상관관계가 있는데 일반적으로 C/N율이 높으면 발근이 잘되고 N의 절대량이 높으면 발근이 억제되는 것으로 알려져 있다(Hambrick 등, 1985). 딸기 삽목 육묘 시에는 전년도에 재배에 이용되었던 묘가 모주가 되며 모주 내에 저장되어 있던 탄수화물은 런너를 통해 새로 발생하는 자묘 쪽으로 이동하여 축적되는데, 자묘 발생이 증가할수록 기존에 발생했던 1~2번 자묘는 숙지가 되어 새로 발생하는 3~4번 자묘 내에 탄수화물의 이동이 증가한다. 그 결과 하나의 모주에서 발생하는 자묘의 개수가 적었던 6월의 1~2번째 삽수는 자묘의 개수가 증가하는 시기인 7월에 채취했던 1~2번 자묘 삽수에 비해 탄수화물의 함량이 높으므로, 6월 삽수 채취묘에서 7월 삽수 채취묘보다 발근이 잘 되고 생존율이 높았던 것으로 생각되었다.
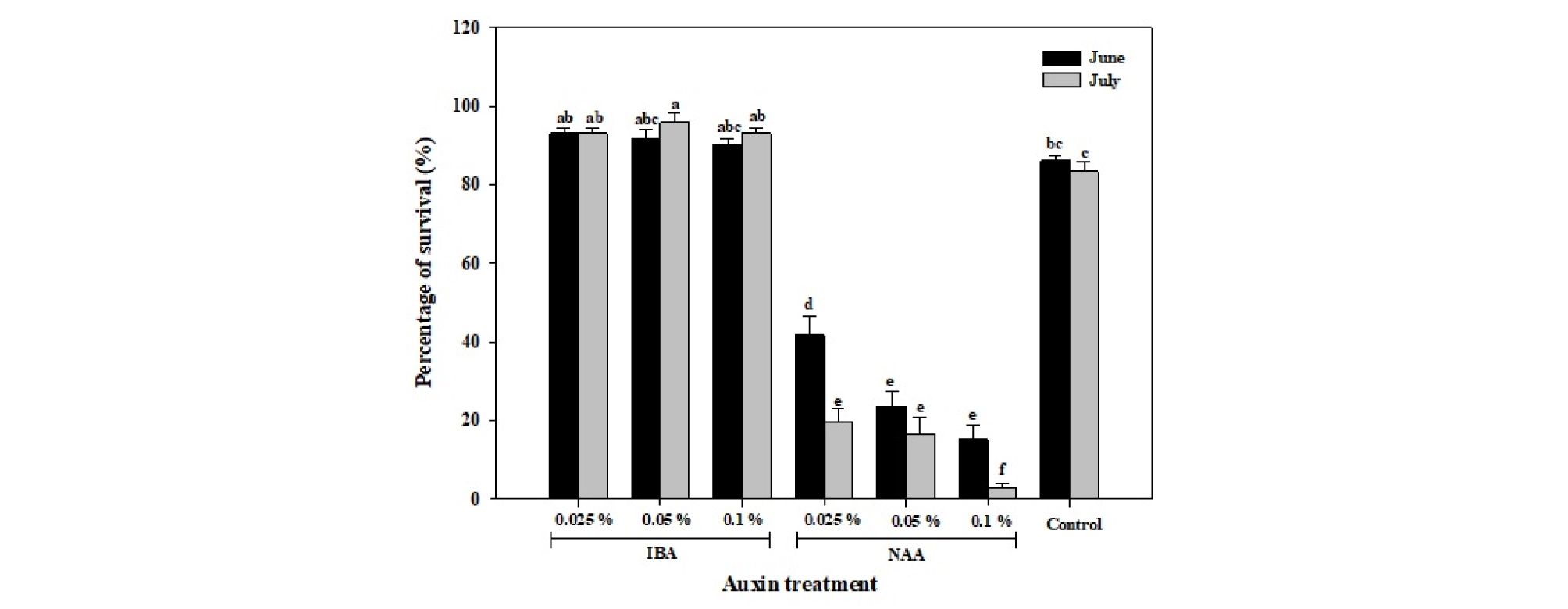
삽목 28일째 각 처리별로 생존율을 비교한 결과는 Fig. 1과 같다. 오옥신 종류 및 농도에 따른 생존율은 삽수 채취시기와 상관없이 IBA 처리 시에는 증가하였지만, NAA 처리 시에는 급감함을 확인할 수 있었다. 6월 채취묘에서는 IBA 처리구에서 생존율이 모두 90% 이상이었고, 무처리보다 생존율이 다소 높았으나 큰 차이는 없었다. 7월 채취묘에서도 무처리보다 IBA 처리에서 생존율이 높았는데, 그 증가 효과는 6월 채취묘보다 크게 나타났으며 IBA 0.05%에서 가장 생존율이 증가하였다. 반면 NAA 처리에서는 삽수 채취시기와 상관없이 생존율이 모두 50% 미만으로, NAA 농도가 높아질수록 생존율이 감소하는 경향을 보였다. 7월 채취묘에서는 6월 채취묘에서보다 NAA 처리 시 생존율이 현저히 떨어지는 것을 확인할 수 있었으며, 그 중에서도 NAA 0.1% 처리에서 생존율이 2.8%로 대부분의 묘가 고사하였다. 삽수 채취시기에 상관없이 NAA를 처리한 식물체에서는 잎의 급격한 위조현상이 일어났으며, 그 결과 지상부 잎이 말리는 등 수분 스트레스로 인해 고사주가 많이 발생하였다. 이때 생존한 일부 삽목묘에서도 초장과 엽병장이 짧고 엽수가 적어 온전한 식물체로 생육을 유지하기에는 다소 힘들었다.
이상의 결과를 바탕으로, 딸기 ‘설향’ 삽목 시 생존율에 미치는 오옥신의 영향은 삽수 채취시기에 따라 다르게 나타남을 확인할 수 있었다. IBA는 딸기 삽목 시 묘의 생존에 보다 적합한 오옥신 계열로서 6월 채취묘보다 7월 채취묘에서 그 효과가 더 컸지만, NAA는 삽수 채취시기와 관계없이 딸기 삽목 육묘에 있어서 부적합한 오옥신 계열인 것으로 판단되었다.
2. 삽수 채취시기와 오옥신 처리가 생육에 미치는 영향
딸기 삽목에 부적합한 NAA 처리를 제외하고, 삽수 활착이 이루어진 후 삽목상 내에서 식물체의 생육특성을 비교한 결과는 Table 1, Fig. 2와 같다. 6월에 삽수를 채취한 처리구에서는 초장, 엽병장, 엽수, 엽장, 엽폭에서 처리구 간 유의한 차이가 없었다. 이때 SPAD 값도 유의한 차이가 없었는데, 이는 외부 처리한 IBA의 농도 또는 내부 IBA 농도의 증감에 관계없이 식물의 SPAD 값은 유의적인 차이가 없었다는 기존의 여러 연구들과 유사한 결과였다(Kim 등, 2018). 관부직경 또한 처리구 간 유의한 차이는 없었으나 무처리구에서 7.96mm로 가장 얇았고, 오옥신의 농도가 증가할수록 관부의 두께가 증가하는 경향을 나타내었다. 반면 생체중과 지상부 건물중은 IBA 0.1% 처리에서 무거웠고, 무처리구와 IBA 0.025%에서 가벼웠다. 7월 삽수 채취 처리구에서는 6월 채취구와 다소 다른 경향을 나타냈는데 초장과 엽병장은 IBA 0.025%에서 유의하게 짧았지만, 생체중과 건물중 및 T/R율은 처리구 간 유의한 차이가 없었다.
Table 1.
The growth of strawberry cuttings according to the collecting date and auxin treatments at 40 days after cutting.
삽수 채취시기와 IBA 농도 간의 분산분석 결과 초장, 엽병장, 관부직경, 생체중 및 건물중은 삽수 채취시기에 따른 유의성이 인정되었는데, 이때 6월 삽수 채취묘에서 7월 삽수 채취묘보다 유의하게 값이 커서 생육이 우수하였다. 반면 오옥신 농도에 따른 유의성은 초장에서만 인정될 뿐 다른 지표들에서는 차이가 없었다. 이러한 결과는 왕벚나무 삽목 시 IBA와 NAA 간 호르몬 종류에 따른 유의적 차이가 있을 뿐 IBA와 NAA 내에서는 농도에 따른 유의한 차이가 나타나지 않았다는 Kim과 Kim(2012)의 연구와 일치하는 결과였다. 반면 지하부 생체중은 삽수 채취시기와 IBA 농도 간의 상호작용에 따른 효과가 인정되었다. 이는 삽수 채취시기에 따른 뿌리 발근정도의 차이 및 내생 오옥신의 영향, 그리고 뿌리에 오옥신을 순간 침지한 효과에 따른 결과라고 생각되었다.
딸기는 정식 시 묘소질이 정식 후 생육 및 수량에 결정적인 역할을 한다. 이에 딸기 삽목묘를 본포에 정식할 때 묘소질을 조사한 결과는 Table 2와 같다. 6월 삽수 채취구에서 초장과 엽병장 및 엽장은 IBA의 농도가 증가할수록 길었으며, 무처리구에서 가장 짧았다. 이는 딸기 모주의 엽병장에 IBA를 처리했을 때 대조구보다 유의적으로 길었다는 기존의 연구결과와 일치하는 것으로서, 오옥신의 식물 엽병 신장효과 때문인 것으로 판단되었다(Samarakoon과 Horton, 1983). 반면 엽수, SPAD 값, 지상부 생체중 및 건물중, T/R율은 오옥신의 농도에 따른 유의한 차이가 없었다. 관부직경은 무처리구에서 8.57mm로 가장 가늘었고, 오옥신 처리구에서는 농도 간의 유의한 차이는 없었으나 그 농도가 증가할수록 관부직경이 굵어지는 경향을 나타내었다.
Table 2.
The growth of strawberry cuttings according to the collecting date and auxin treatments at transplanting.
7월 삽수 채취 처리구는 6월 삽수 채취 처리구와 다소 다른 경향을 보였는데, 초장과 엽병장은 IBA 0.05%에서 유의하게 가장 길었다. 관부직경은 IBA 0.1%에서 8.09mm로 가장 가늘었으며, IBA 0.05%에서 9.00mm로 가장 굵었다. 반면 엽폭, 생체중, 건물중, T/R율은 처리 간 유의한 차이가 없었으나, 전반적으로 무처리구에서 그 값이 작고 IBA 0.05%에서 가장 우수한 경향을 나타내었다. 이는 무처리에 비해 IBA를 처리한 딸기의 자묘에서 지상부 생육이 증진되었다는 Murti와 Yeoung(2013)의 연구와 유사한 결과였다. 분산분석 결과 관부직경, 지하부 생체중 및 건물중, T/R율은 삽수 채취시기에 따른 유의성이 인정되었고, 6월 채취묘에서 보다 우수하였다. 이는 오옥신이 식물의 발달 단계에 따라 세포 및 조직에 차등 분배되기 때문에(Vanneste와 Friml, 2009), 삽수 채취시기에 따라 딸기 자묘 내 발달 상태의 차이가 발생한 것에 기인한 것으로 생각되었다.
Kang 등(2011)은 딸기 양질묘의 판단기준이 되는 주요 요소로 관부직경의 두께를 제시하였으며, 관부직경이 8mm 이상의 대묘를 정식묘로 사용하였을 때 식물체의 생장 및 뿌리활착이 우수하고 소묘에 비하여 빠른 수확과 전체 과실의 생산량이 증가한다고 보고된 바 있다(Cocco 등, 2010; Durner 등, 2002). 본 실험에서는 모든 처리구에서 관부직경이 8mm 이상이었는데, 그 중에서도 6월 삽수 채취구에서는 IBA 0.1%, 7월 삽수 채취구에서는 IBA 0.05%에서 가장 그 두께가 굵었다. 이때 6월 삽수 채취구에서는 처리 간 유의한 차이는 없었으나 IBA의 농도가 증가할수록 관부의 두께가 증가하는 경향을 보였다. 식물생장조절제를 처리하지 않은 대조구에서는 관부직경이 8.57mm로 가장 얇았는데, 이를 통해 6월 삽수 채취 시에는 식물생장조절제를 처리하는 것이 보다 유리한 것으로 판단되었다. 반면 7월 삽수 채취구에서는 IBA 0.05% 처리에서 관부직경이 가장 굵고 IBA 0.1% 처리에서 가장 얇아, 7월 삽수 채취 시에는 오옥신을 고농도로 처리하는 것이 부적합한 것으로 확인되었다.
Takeda 등(2004)은 ‘Chandler’ 품종에서 딸기 자묘의 생체중이 9.9g과 0.9g인 묘를 정식했을 때, 무거운 묘에서 활착률도 높고 생산량이 10% 증가한다고 보고한 바 있다. ANOVA 분석 결과, 지하부 생체중과 건물중은 삽수 채취시기에 따른 유의성이 인정되었으며 6월 삽수 채취 시에 보다 그 무게가 증가하는 것을 확인할 수 있었다. 이때 6월 삽수 채취묘에서는 IBA 0.1%, 7월 삽수 채취묘에서는 IBA 0.05%에서 묘의 무게가 무거워, 정식 후 활착과 생산량 증가가 가능할 것으로 유추할 수 있었다.
이상의 결과, 딸기 삽목 시 자묘 생육에 미치는 오옥신의 효과는 삽수 채취시기에 따라 그 영향이 다르게 나타났다. 이때 오옥신 농도보다는 삽수 채취시기가 삽목묘의 생육에 더 많은 영향을 미치는 것으로 확인되었으며, 6월 삽수 채취 시에는 IBA 0.1%, 7월 삽수 채취 시에는 IBA 0.05%를 이용하는 것이 묘의 생육을 증진시키는 데 보다 유리한 것으로 판단되었다.
3. 삽수 채취시기와 오옥신 처리가 광합성에 미치는 영향
식물체는 외부환경으로부터의 다양한 환경스트레스에 의하여 광합성 활성이 감소되며 이러한 광합성 수준의 감소는 엽록소형광반응의 측정을 통해 간접적으로 정량화될 수 있다(Chaerle 등, 2007). 딸기 삽목 시에 식물생장조절제 처리가 삽목묘의 스트레스 요인으로 작용하는지의 여부를 판단하고 그 건전성을 비교하고자 삽수 채취시기와 오옥신 IBA의 농도에 따른 딸기 삽목묘의 양자수율을 비교한 결과는 Table 3과 같다. 6월 삽수 채취 처리구에서는 생체중과 건물중이 무겁고 관부직경이 두꺼웠던 IBA 0.1%에서 양자수율이 0.796으로 가장 높았고, 지상부 건물중이 가벼웠던 IBA 0.05%에서 0.774로 유의하게 가장 낮았다. 반면 7월 삽수 채취 처리구에서는 6월 삽수 채취의 경우와는 달리 처리 간의 유의한 차이는 없었으나 IBA 0.05%에서 양자수율이 0.800으로 가장 높았다.
Table 3.
Comparison of quantum yield (QY=Fv/Fm) according to the collecting date and auxin treatments at 43 days after cutting.
Fv/Fm은 암적응 시 식물체의 광합성 수준을 평가할 수 있는 대표적인 엽록소형광 지수로, 다양한 비생물적 및 생물적 스트레스 탐지에 활용되고 있다(Rungrat 등, 2016). 이에 딸기 육묘 시 오옥신의 처리에 따른 뿌리 활력에의 변화로 수분 흡수 패턴의 변화가 나타나 식물체가 스트레스를 받는지에 대한 여부를 양자수율 측정을 통해 확인하였다. 그 결과 딸기 삽목 시 삽수 채취시기와 식물생장조절제 처리에 따른 Fv/Fm을 비교했을 때 6월 삽수 채취 시 IBA 0.05% 처리를 제외하고 유의한 차이를 보이지 않았다. 이는 식물생장조절제가 딸기 삽목묘에서 스트레스 요인으로 작용하지 않으며 광합성 효율의 감소에 미치는 영향이 미비하다는 것으로 해석할 수 있었다.
이상의 결과, 6월 삽수 채취 시 IBA 0.1%, 7월 삽수 채취 시 IBA 0.05%를 처리하였을 때 양자수율이 높게 나타남을 확인할 수 있었다. 이를 통해 딸기 삽목 육묘 시에는 식물생장호르몬이 스트레스 요인으로 작용하지 않으며, 오히려 일정 농도 처리하는 것이 식물체의 광합성 효율을 증진시키는 데 보다 유리하게 작용하는 것으로 생각되었다.
본 연구를 통해, 국내 육성 딸기 ‘설향’ 품종의 삽목 육묘 시 삽수 채취시기에 따라 오옥신의 종류 및 농도별 효과가 달리 나타나는 것을 확인할 수 있었다. IBA는 삽수 생존 및 활착에 보다 적합하였지만, NAA는 삽수 채취시기와 관계없이 묘의 고사율을 높여 딸기 삽목 육묘에 있어서 부적합한 오옥신 계열이었다. 이때 묘의 생육과 광합성 효율을 증진시키기 위한 IBA 농도는 6월 삽수 채취 시에는 0.1%, 7월 삽수 채취 시에는 0.05%로 이용하는 것이 보다 적합한 것으로 판단되었다.