서 론
재료 및 방법
1. 배지 및 식물 재료
2. SAP의 물리·화학적 특성
3. SAP배지 재배의 발아율
4. SAP 배지의 새싹 재배 방법
5. 생육 조사
6. 기능성 분석
7. 통계 분석
결과 및 고찰
1. SAP의 물리·화학적 특성
2. SAP처리에 따른 홍화와 아마란스의 발아율
3. SAP 처리에 따른 홍화 새싹과 아마란스 새싹의 생육 및 기능성 물질
서 론
홍화(Carthamus tinctorius L.)는 국화과(Compositae)에 속하는 일년생 초목으로 아프가니스탄의 산악지대 또는 에티오피아가 주 원산지이며 중국, 티벳 등지에서도 재배된다(Lee, 1981). 홍화는 꽃, 종자 모두 약용으로 사용되며 공통적으로 aspartic acid, glutamic acid 함량이 높으며 다른 아미노산 및 지방산의 함량이 높아 건강 보조식품으로 적합하다(Kim 등, 2000). 아마란스(Amaranthus spp. L.)는 남아메리카 고산지대가 원산지인 비름과(Amaranthaceae)에 속하는 일년생 쌍떡잎 식물이다(National Academy of Sciences, 1984). 새싹채소 중에서도 식감, 풍미, 외관 및 전반적인 식사 품질 측면에서 가장 선호되는 작물 중 하나이며(Lee 등, 2014; Xiao 등, 2015), 아마란스의 잎이나 새싹에는 쿼서틴, 루틴, 플라보노이드 등 다양한 기능성 물질이 함유되어 있다(Gins 등, 2010).
새싹채소는 4~10cm 미만의 채소로, 파종 후 3~4일 내에 본 잎이 3~6잎 일 때 수확하여 어린 배유와 자엽을 통째로 섭취하며 성채보다 비타민과 미네랄 등의 기능성 물질이 많고, 어린 상태에서 수확되기 때문에 재배 기간이 짧고 생산량이 많으며 식물 조직이 연하고 부드러운 식감을 가지고 있다(Lee 등, 2007; Steadman 등, 2001; Zhang 1992). 다양한 영양소를 손실이 적게 섭취할 수 있어 2000년대부터 신세대들의 새싹채소 선호도가 높아짐에 따라 친환경 농산물의 소비가 늘어나 다양한 베이비 채소류들의 생산이 지속적으로 늘어나고 있다(Seo, 2013).
수경 재배는 새싹을 재배하기 위한 최적화된 방법으로, 국내에서 1992년(13.4ha)부터 2002년(780ha)을 거쳐 현재까지 재배 면적이 꾸준히 증가하고 있으며 수경 재배의 84%가 펄라이트와 암면 등의 고형배지경으로 재배되고 있으나, 폐기 및 구입 가격이 비싸고, 오염 문제를 일으켜 이들을 대체할 환경 친화적인 배지 개발의 필요성이 요구되어져 왔다(Cheng 등, 2010; Kim 등, 2013; Lee 등, 1993; Lee 등, 2007; RDA, 2003). 고흡수성 수지는 토양 혼합재로써 사용되나 처리에 따라 폐기 처리가 어려운 다른 고형 배지경들과 달리 전분 함량이 높으면서 흡수성이 적절한 전분계 고흡수제를 제조할 수 있어 기능을 다한 후에 토양에서 생분해 되어 재활용 및 장기간 사용 뒤에도 폐기에 어려움이 없다(Ahn and Yun, 1999).
고흡수성 합성고분자(Super Absorbent Polymer, SAP)는 하얀 분말 형태이며 분자 구조에 따라 자기 무게의 200~1000배까지 물을 흡수할 수 있으며 물 흡수 시 겔(gel)상태가 된다. SAP은 일회용 기저귀, 여성용 생리용품 등의 위생용품 산업에서 활발히 사용되고 있으며, 일상생활 뿐만 아니라 농 · 원예 분야까지 다양하게 활용되고 있다(Lepoutre, 1976). SAP의 뛰어난 수분 흡수력에 기반하여 토양에 SAP를 처리한 혼합 상토에서 토양 수분 흡수력 및 수분 유지력이 증가함을 밝혀(No, 1987), 이후 상추와 보리(Woodhouse와 Johnson, 1991), 옥수수(Islam 등, 2011), 배(Jamari 등, 2015), 콩, 사탕수수에 관한 연구도 진행되어 작물의 생육과 수량 향상 효과 또한 알려졌다. 이는 압력을 가해도 쉽게 손상되지 않고 거의 물을 방출하지 않는 SAP의 특성으로, 토양 내 영양물질과 낭비되는 물, 토양 표면으로부터의 수분 증산작용을 감소시켜 관수에 필요한 물을 절감시킬 수 있다(Bai, 2010). 수분 흡수 시 겔(gel) 형태로 변하면서 부피 팽창에 의한 입단구조 형성으로 경운 효과 등 밭작물의 관개 효율성 증대를 위해 사용된다(Po, 1994). 그러나 과도한 SAP 사용은 토양 수분함량을 불필요하게 증가시켜 오히려 생육에 문제가 될 수 있기 때문에 사용량을 조절해야 한다(Jo 등, 1987; Watanabe 등, 2019).
SAP는 토양수에 고농도의 양이온, 무기염이 존재할 시 수분 흡수력이 감소하는 특성 때문에 재배 기간에 순수한 물을 사용하는 새싹채소 재배에 적합하다(Bowman 등, 1990). 본 연구는 수경재배에서 SAP을 배지로 사용했을 때, 1) 홍화와 아마란스의 발아와 생육, 그리고 기능성물질에 미치는 영향을 알아보고, 2) 저관수 농법으로서의 활용 가능성을 분석하고자 실시하였다.
재료 및 방법
1. 배지 및 식물 재료
배지 재료로는 SAP(GK 고흡수성수지 비드300G, GK그린코리아, Gwangmyeong, Korea)을 증류수에 불려 gel의 형태로 실험에 이용하였다(Fig. 1). 식물 재료로는 홍화(Carthamus tinctorius L., Co. Danong, Incheon, Korea)와 아마란스(Amaranthus spp. L., Co. withbud, Incheon, Korea) 종자를 이용하였다.
2. SAP의 물리·화학적 특성
SAP의 물리적특성을 분석하고자 SAP(bead)를 0.2, 0.3, 0.6g씩 정량 후 각각 증류수 180mL와 혼합하여 2시간 동안 수분을 흡수시켜 20분 간격으로 실린더를 이용하여 3반복으로 부피를 측정하였다. 각 SAP(bead) 양에 따른 부피를 구하고 수분을 흡수한 SAP(gel)의 부피를 구하여 배수를 계산하였다. SAP(bead) 0.2, 0.3, 0.6g의 전체 부피는 각 0.30, 0.45, 0.90cm3이고, 부피 증가 수치는 다음 식으로 계산하였으며, AV는 증류수를 흡수한 SAP(gel)의 부피(cm3), NAV는 수분 흡수 전 SAP(bead)의 부피(cm3)를 의미한다.
SAP의 밀도가 수분흡수력에 미치는 영향을 보고자 SAP (bead)를 0.125, 0.166, 0.25, 0.5g씩 정량 후 각각 증류수 150mL와 혼합하여 수분 흡수 경과 시간에 따라 1, 2, 3, 4, 5, 6, 7, 24, 96시간마다 혼합섬유를 이용해 표면 수분을 걸러낸 후 무게를 저울로 3반복 측정하였다. 수분흡수량(mL/g)은 아래 식으로 계산하며, AG는 수분 흡수 후의 SAP(gel) 무게(g), NAG는 수분 흡수 전 SAP(bead)의 무게(g), WG는 SAP(bead) n이 흡수한 수분량(mL), n은 SAP(bead)의 양(g)을 의미한다.
AG-NAG = WG
식물 재배시 SAP(gel)에서 용탈된 수분을 흡수하여 생장하기 때문에 SAP(bead) 0.125, 0.166, 0.25, 0.5g을 저울로 정량하여 각각 증류수 150mL와 혼합하고 혼합섬유로 SAP(gel)을 걸러낸 뒤 SAP로부터 용탈된 증류수를 pH측정기(Orion 5 star Thermo Scientific, Beverly, MA, USA)로 1, 2, 3, 4, 5, 6, 7, 24, 96시간 동안 pH와 EC를 3반복으로 측정하였다.
추가적으로 SAP내부의 성분을 분석하기 위해 SAP(bead) 2.5g을 증류수 3L를 담은 비커에서 7일동안 흡수시키고 SAP(gel)에서 걸러 나온 추출액 1.5L를 경남농업기술원에 수질 분석을 맡겨 pH, EC 및 NO3-N, K, Ca, Mg, Na, Cl, HCO3-, SO42-, Fe, Mn, Zn, As, Ni, Cd, Cu, Cr, Hg, Pb, NH4-N의 이온 농도를 분석하였다.
3. SAP배지 재배의 발아율
SAP의 배지로서의 활용 가능성을 보기 위해 홍화와 아마란스의 재배 실험 전 발아율 조사를 먼저 실시하였다. 새싹 재배기(Mini sprout cultivation, Asia Seed Co. Ltd, Seoul, Korea, 19 × 14 × 9cm, W × D × L)에 각각 증류수 570mL, 증류수를 흡수한 SAP(gel) 570cm3를 채우고 혼합섬유를 깐 뒤 4°C의 증류수에 15시간 침지시킨 홍화 새싹 종자를 80립씩 새싹 재배기에 파종하였다. 아마란스 새싹 종자는 침지 처리 없이 80립씩 파종하였다. 홍화와 아마란스는 각 처리구당 4개의 재배기에서 재배하였다. 재배 기간 동안 증류수로 관수 하였으며 대조구는 이틀에 한 번 물을 갈아주고 570mL만큼, 처리구는 교체없이 SAP(gel)이 570cm3를 유지하도록 관수하였다.
홍화 새싹은 식물생장상 내 파종 후 4일 동안 암조건에서 재배하였고 아마란스 새싹은 광조건에서 4일 동안 재배하여 발아 기간 동안 하루 간격으로 발아율을 4반복으로 측정하였다. 식물생장상 내부 온도는 23 ± 2°C, 습도는 60 ± 6%가 유지되었고, 광은 62 ± 6µmol·m-2·s-1로 설정되었다. 광원은 White LED를 사용하였고 12시간 주기로 광을 처리하였다.
4. SAP 배지의 새싹 재배 방법
새싹 재배기(19 × 14 × 9cm, W × D × L)에 거즈를 깔고, 처리구에는 SAP(gel)를 한 층 바르고 거즈로 감싼 형태로 깐 뒤 30°C의 증류수에 기포발생장치를 넣어 5시간 동안 침지시킨 홍화 새싹 종자를 100립씩 9반복으로 치상하여 식물생장상에서 재배하였다. 생장상 내부 온도는 25 ± 2°C, 습도는 70 ± 5%를 유지하였고 광은 35 ± 8µmol·m-2·s-1 으로 설정하였다. 광원은 White LED를 사용하였으며 12시간 주기로 광을 처리하였다. 4일 동안 암발아 후 7일동안 재배하여 수확한 후 생육조사 및 기능성 분석에 사용하였다. 2일 주기로 물갈이를 해주었고 570mL씩 증류수로 관수하였다.
새싹 재배기(19 × 14 × 9cm, W × D × L)에 거즈를 깔고, 처리구에는 SAP(gel)를 한 층 깔아준 뒤 거즈로 감싼 형태로 깔고 아마란스 새싹 종자 100립을 5반복으로 치상하여 식물생장상에서 재배하였다. 식물생장상 내부 온도는 25 ± 2°C, 습도는 70 ± 5%를 유지하였고 광은 188 ± 10µmol·m-2·s-1로 설정하였다. 광원은 White LED를 사용하였으며 16시간 주기로 광처리하여 3일동안 광발아 후 8일동안 재배하여 수확한 후 생육조사 및 기능성 분석에 사용하였다. 5일 주기로 물갈이를 해주었고 증류수로 570mL씩 관수하였다.
5. 생육 조사
처리 반복 당 10개체씩 선정하여 5반복으로 조사하였다. 버니어 캘리퍼스(CD-P30S, Co, Mitutoyo, Japan)를 이용하여 하배축의 길이와 직경을 측정하고 물기를 제거하여 저울(OHAUS, PAG214C, Parsippany, NJ, USA)로 생체중을 측정하였다. 그 후 70°C의 드라이오븐(WOF-155, Daihan, Wonju, Korea)에서 72시간 동안 건조 후 건물중을 측정하였다. 수분함량은 생체중(FW)에서 건물중(DW)을 뺀 값에서 생체중으로 나누어 계산하여 백분율로 표현하였다.
6. 기능성 분석
분석에 사용할 새싹의 생체중(g/10 plants)을 측정하여 10mg당 아세톤 1mL로 계산하여 농도를 맞추어 처리당 5반복으로 준비하였다. 막자사발에 -70°C에 보관한 새싹과 액체 질소를 넣은 후 갈아서 80% 아세톤을 3mL씩 넣고 다시 갈아 일회용 스포이드로 1mL씩 micro tube에 분주한 뒤 45°C의 항온 수조(WUC-D06H, Daihan, Wonju, Korea)에 15분간 반응시키고 0.5mL씩 분주하여 총 페놀 농도와 항산화도 분석용으로 사용하였다.
새싹의 총 페놀 농도 측정은 Folin-Ciocalteau방법으로 결정하였다(Ainsworth와 Gillespie, 2007). 샘플을 2분간 1,350 rpm에서 원심분리 시킨 후 상층액을 측정에 이용하였다. 135 µL의 증류수, 750µL의 10배를 희석시킨 Folin-Ciocalteau 시약(Sigma-Aldrich, St. Louis, MO, USA)과 600µL의 7.5%(w/v) Na2CO3를 순서대로 혼합한 후 페놀 추출물 50µL를 넣어 vortex mixer (MSH-20A, Daihan, Wonju, Korea)로10초간 vortexing후 45°C의 항온 수조에 15분간 반응시켰다. Blank는 식물 샘플 대신 80%(v/v) 아세톤으로 이용하였고 페놀함량은 단위 생체중(g)당 gallic acid(mg)(Acros Organics, Belgium)로 표현하였다. 흡광도 측정 전 시료를 충분히 식혀주었고 분광광도계(Libra S32, Biochrom, Cambridge, UK)로 765nm에서 흡광도를 측정하였다.
항산화도는 ABTS(Aminobenzotriazo le; 2,2’-Azino-bis [3-ethyl benzothiazoline 6-sulfonic acid] diammonium salt)를 이용한 방법(Rice-Evans 등, 1996)으로 측정하였다. 샘플을 2분간 1,000rpm에서 원심분리 시킨 후 상층액을 사용하였다. 2.5mM의 ABTS(Sigma-Aldrich, St. Louis, MO, USA)용액을 ABTS 활성 양이온 용액(ABTS*)으로 만들기 위하여 0.4g의 MnO2(Sigma-Aldrich, St.Louis, MO, USA)를 넣고 30분간 혼합하여 사용하였다. 0.22µm의 실린지필터(SN13P020NL, HYUNDAI MICRO, Seoul, Korea)로 거른 ABTS*용액을 30°C의 항온 수조에 넣고, 5mM의 PBS[phosphate buffer saline, pH 7.4, ionic strength (150mM NaCl)]용액과 희석하여 730nm에서 흡광도를 0.7(±0.05)로 맞춰주었다. 100µL의 추출물을 ABTS*용액에 반응시킨 후, vortex mixer로 2초동안 혼합 후 1분 후의 흡광도를 730nm에서 측정하였다. AOS는 단위 생체중(g)당 mM Trolox [(6-Hydroxy-2,5,7, 8-tetramethylchrom ane-2-carboxylacid (Sigma-Aldrich, St. Louis, MO, USA)]로 표현하였다.
7. 통계 분석
통계 분석은 SAS 프로그램(SAS 9.1.3, SAS Institute Inc., USA)을 이용하였으며, SAP의 물리 및 화학적 특성은 처리당 3반복, 식물의 발아율은 처리당 4반복, 생육 및 기능성 분석은 처리당 5반복으로 조사하였다. 발아율 및 재배 실험은 총 2회 반복 실시하였다. SAP의 물리 및 화학적 특성은 Duncan다중검정을 실시하였고, 홍화와 아마란스의 발아율, 생체중, 건물중, 수분함량, 하배축, 직경, 페놀함량, 항산화도를 t-test를 실시하여 유의성을 검사하였다.
결과 및 고찰
1. SAP의 물리·화학적 특성
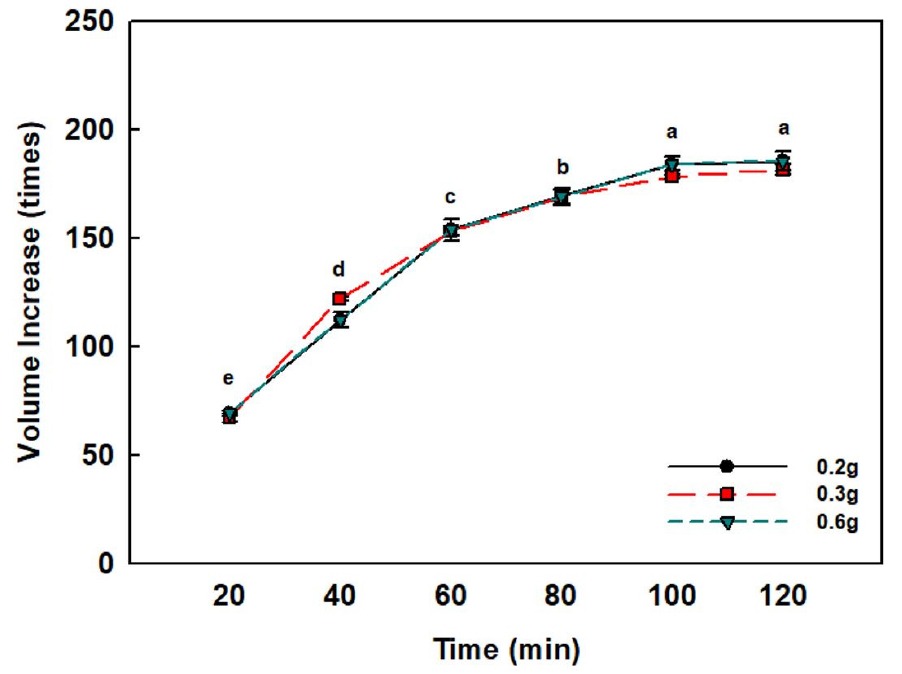
Fig. 2는 2시간 동안 20분 간격으로 SAP(bead)의 양(0.2, 0.3, 0.6g)을 달리 하여 부피 증가를 측정한 결과이다. 증류수 흡수 후 100분 이후부터 SAP(gel)이 포화되어 수분 흡수를 멈추었으며 이 때 0.2g과 0.3g은 각각 약 184배, 178배까지 부피가 증가하였고 0.6g는 약 163배가 증가하였다. 40분까지는 0.2g과 0.3g에 비해 0.6g의 부피 증가폭이 컸지만 60분부터 점차 증가 속도가 느려지고 SAP이 포화된 100분부터 0.2g과 0.3g에 비해 유의적으로 낮은 값을 보였다. Fonteno와 Bilderback(1993)의 실험에 따르면 상토에 따라 비중이 다르기 때문에 가비중이 무거울 경우 SAP이 물을 흡수한 후 팽창하는 것이 물리적으로 제약을 받기 때문에 용기용수량 증가가 크지 않다고 하였다. SAP의 양이 많아 밀집될수록 물을 흡수하는 비표면적이 감소하고 서로 작용하는 압력이 높아져 수분흡수가 감소하는 것으로 보인다(Yun, 2016). 수분 흡수 중 압력 차이로 인해 SAP(gel)의 부피에 편차가 있을 것을 예상하여 재배 실험에서는 gel형태에서 정량하여 진행하는 것이 필요하다. 수분 흡수 후 100분 경과부터 부피 증가가 현저히 감소하였고 120분부터는 거의 증가하지 않고 100분과 120분 사이에 유의적인 차이가 없었다. 따라서, SAP의 물리적 특성은 기존 bead 형태에서 물을 흡수하게 되면 gel 형태로 변하면서 약 160배 이상 부피가 증가하며, 약 2시간 정도면 물을 충분히 흡수하여 포화된다는 것을 알 수 있었다(Fig. 2).
수분흡수시간에 대한 SAP(bead)의 무게 변화 및 SAP (bead)의 수분흡수량(mL/g)에 대해 분석하였다(Table 1). SAP의 무게에 따라 약 4~6시간 까지는 증가되는 경향을 보였으나, 모든 처리에서 수분 흡수 후 24시간의 SAP(gel) 무게가 가장 높았다. 수분흡수량 계산 결과 SAP(bead)의 양과는 상관없이 수분흡수 4시간에서 평균 약 18.44(mL/g), 24시간에서 평균 약 19.22(mL/g)의 값을 보였다. 이 결과는 식물 재배에 SAP 이용 시 관수량을 조절(제어) 및 정령화하여 물 사용량을 절약할 수 있다는 가능성을 보여준다. SAP의 부피는 수분흡수 후 2시간부터 포화상태였으나 무게 변화에서 4시간 이후에도 무게 증가가 있는 것으로 보아 SAP의 부피가 최대로 증가하여도 수분흡수는 가능한 것으로 보인다.
Table 1.
The changes in weight of SAP (gel) and water absorption according to SAP (bead) amount and water absorption time (n = 3).
| Treatment (g)z | Weights (g)y | Water absorption (ml/g) | |||
| 4h | 24h | 4h | 24h | ||
| 0.125 | 23.34 ± 0.20x | 24.47 ± 0.27 | 18.57 ± 0.16 | 19.48 ± 0.22 | |
| 0.166 | 31.74 ± 0.79 | 32.81 ± 0.40 | 19.02 ± 0.48 | 19.66 ± 0.24 | |
| 0.25 | 47.69 ± 0.26 | 50.05 ± 0.32 | 18.98 ± 0.10 | 19.92 ± 0.13 | |
| 0.5 | 86.44 ± 1.37 | 89.60 ± 1.51 | 17.19 ± 0.27 | 17.82 ± 0.30 | |
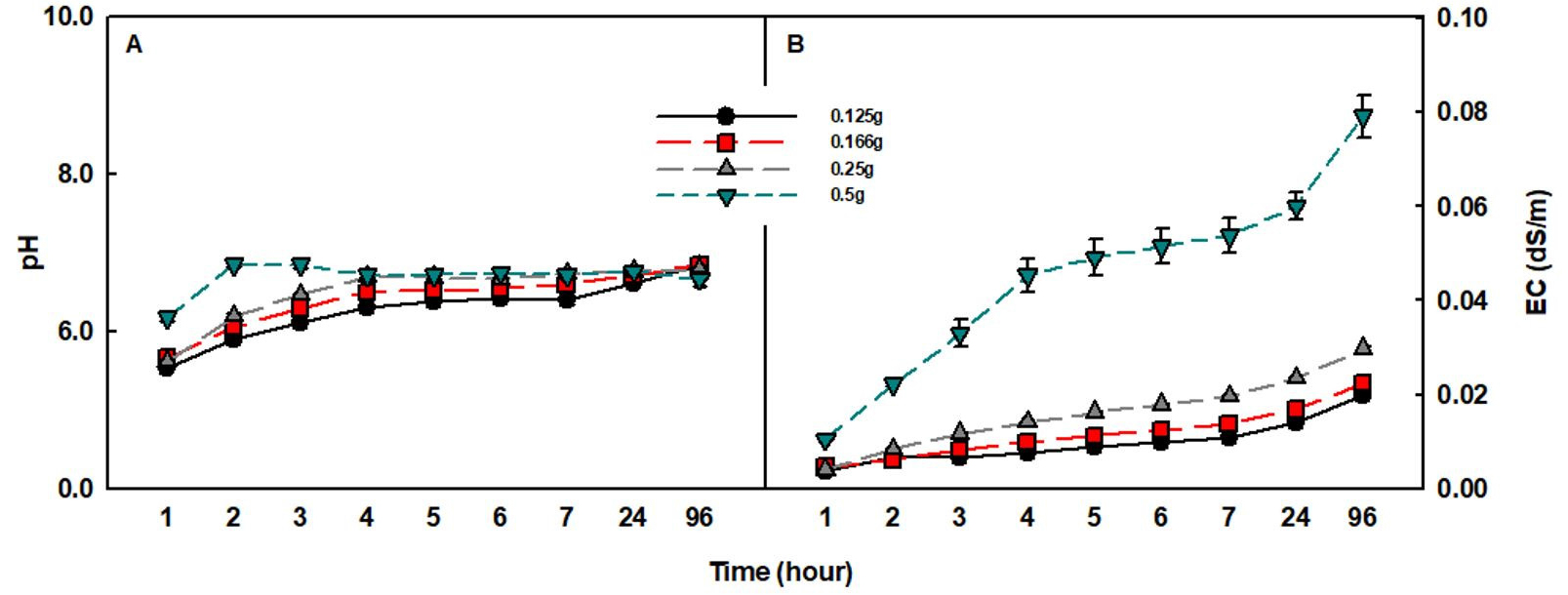
SAP의 화학적 특성 중 pH는 처리구 간에 큰 차이가 없었지만 0.5g에서 초반에 급격한 변화를 보였다(Fig. 3A). 그러나 96시간 후에는 pH 7을 넘지 않았으며 처리구 간의 유의적 차이가 없었다. 또한 SAP의 양이 적을수록 pH의 변화 폭이 작았다. EC에서는 SAP의 양이 많을수록 값이 높게 나타났는데, 특히 0.5g에서는 시간이 지남에 따라 크게 증가하였다(Fig. 3B). 0.5g에서는 96시간 후에 EC가 0.08 ds/m로 다른 처리보다 약 4배 높았다. 위의 결과로부터 pH 및 EC의 변화 특성을 고려한 적정 작물 선정 및 양액 조성이 필요하며, SAP가 pH 및 EC에 영향을 준다는 것을 확인할 수 있었다.
SAP의 성분을 검사한 결과 미량이나마 필수원소인 K, Ca, Mg이 각각 0.12, 0.07, 0.01(mg/L)이 검출되었다(Table 2). SAP의 다량원소 중 Na는 다른 이온에 비해 함량이 많았던 것은 실험에 사용한 SAP가 Na계 Polymer였기 때문이다. 한편, SAP의 작물에 긍정적인 원소들이 검출된 반면 극미량의 중금속 성분 또한 검출되었으나 식품의약청 식품위생 기준에 의하면 인체에 유해한 수준은 아니다(Yoo 등, 2010). 이를 통해 SAP는 성분(원소)에도 영향을 주어 작물에 긍정적으로 사용될 수 있는 가능성을 보여 추후 이를 고려한 추가적인 실험 설계가 필요하다고 판단된다.
Table 2.
Chemical characteristics of super absorbent polymer (SAP) used in this study.
2. SAP처리에 따른 홍화와 아마란스의 발아율
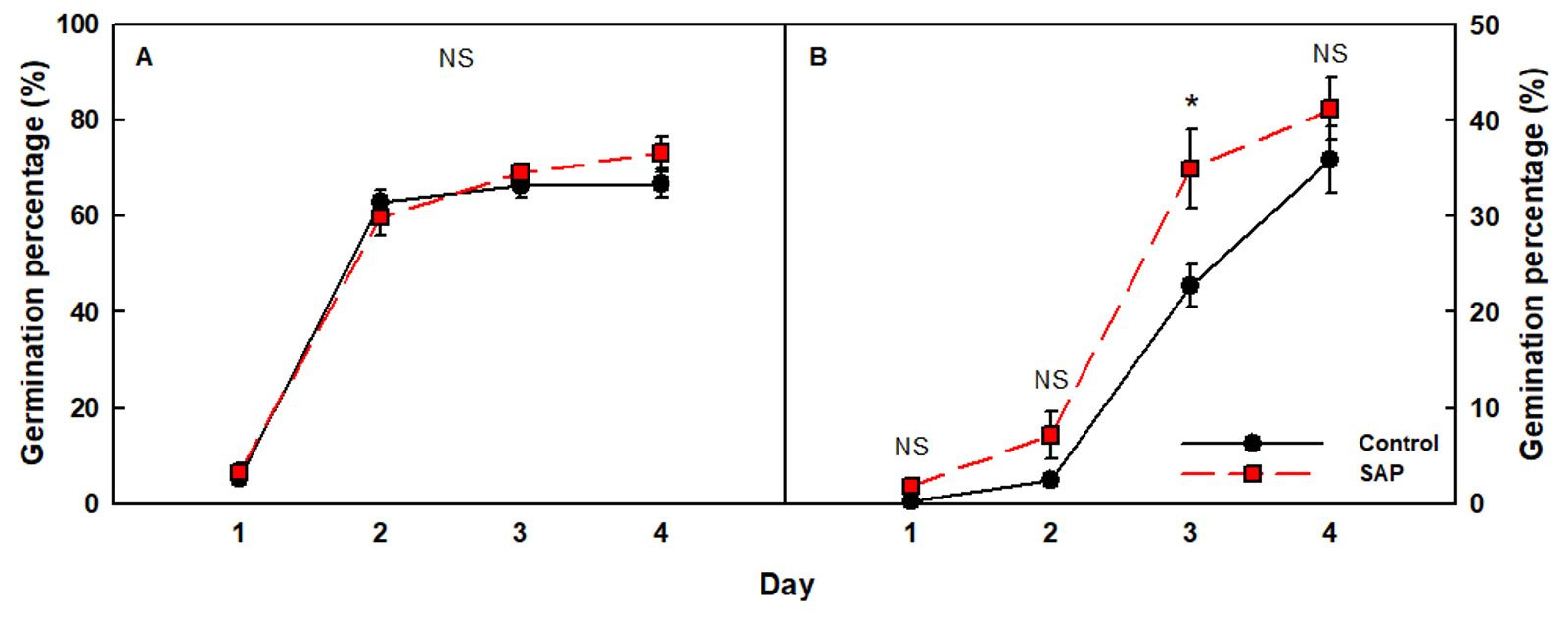
홍화 종자를 대조구와 SAP에 파종했을 때, 3일까지는 차이가 보이지 않았으나, 발아 4일째에는 SAP처리구에서 73%로 대조구(67%)보다 발아율이 높았음에도 유의적인 차이는 없었다(Fig. 4). 아마란스 종자의 발아율 또한 대조구와 처리구의 큰 차이는 없었으나 발아 3일 째에는 SAP에서 유의적으로 높게 나타났고, 4일 째에도 41%로 대조구보다 높은 값을 보였다. 발아율 실험 결과, 긍정적인 SAP의 배지 이용 가능성을 확인할 수 있었으나, 장기간 SAP에 노출 시 뿌리가 고사하여 검변하였고 배축 또한 성장하지 못하였다. 이는 흡수지의 오염과 혼합섬유를 뚫고 뿌리를 내릴 수 없기 때문에 뿌리가 쉽게 건조해지고, 고농도의 SAP 처리 시 물이 SAP에 강하게 흡착되어 수분 이동이 느려져 합성섬유의 수분이 생육에 충분하지 않아 초기 생육이 느리거나 생장이 균일하지 못한 것으로 판단된다(Elliot, 1992; Powel, 1982). 이번 실험에서는 SAP의 사용 가능성 측면에서만 이루어진 실험으로 추후 실험에서는 흡수지의 오염을 줄이고 뿌리가 건조해지지 않도록 개선되어 진행되어야 될 것으로 사료된다. 따라서, SAP를 배지로 이용하여도 홍화와 아마란스의 발아에는 악영향이 없음을 확인할 수 있었으며, SAP의 활용 시 적절한 흡수지 선정을 위한 연구가 필요할 것으로 사료된다.
3. SAP 처리에 따른 홍화 새싹과 아마란스 새싹의 생육 및 기능성 물질
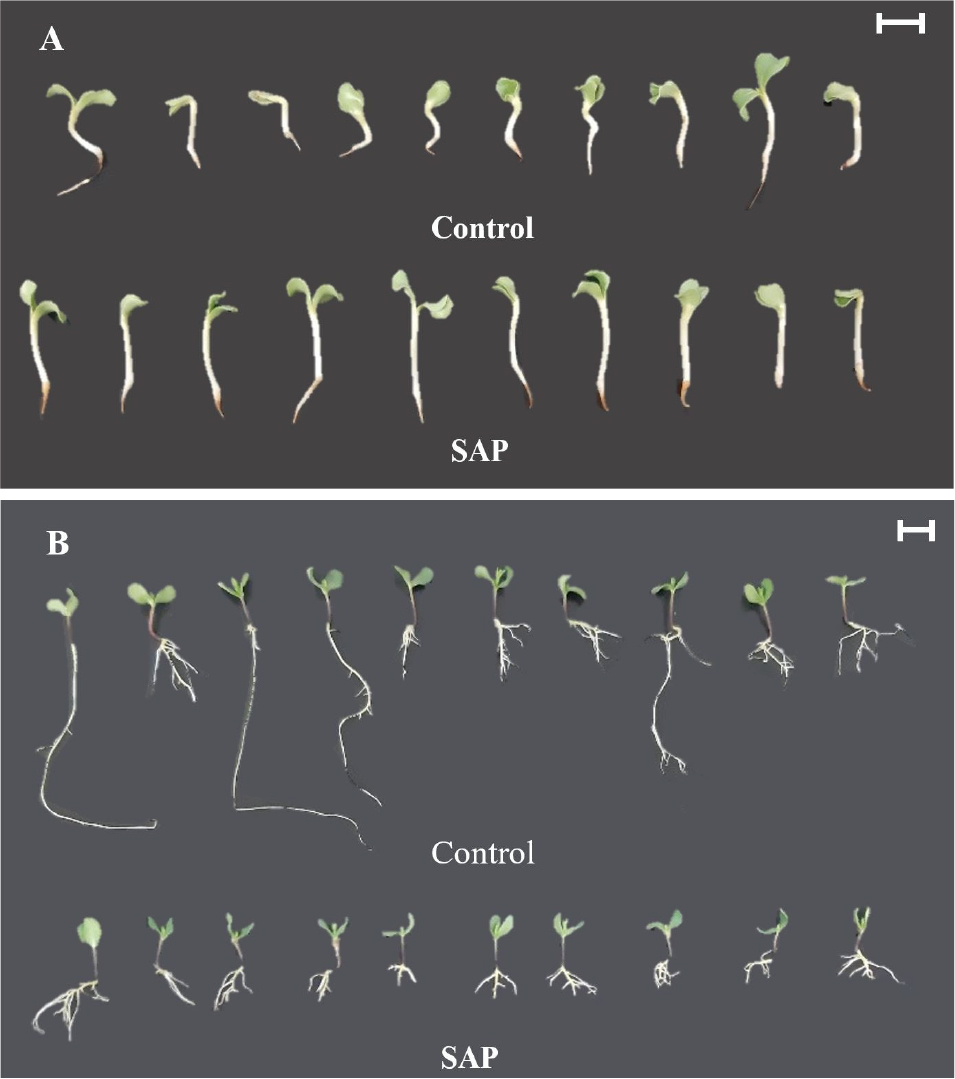
홍화 새싹 재배에서 무처리구와 SAP 처리구 사이에 발아율, 생체중, 건물중, 수분함량, 하배축, 직경, 기능성 물질에 큰 영향을 주지 않았다(Table 3, 4와 Figs. 4A, 5). 대조구에 비해 생육, 기능성 물질 면으로 효과는 없었으나 SAP배지로 충분히 새싹 재배가 가능(대조구: 일반 새싹재배기)한 것을 확인하였다. 또한 대조구에 비해 관수에 사용되는 용수 절약이 가능할 것으로 보여, 생육에 악영향을 주지 않으면서도 물을 아낄 수 있는 배지로 사용이 가능할 것으로 판단된다.
아마란스 새싹 재배에서는 생체중, 하배축, 직경이 SAP 처리구에서 미세하게 높았으나 유의적인 차이는 없었고, 건물중은 처리구에서 무처리에 비해 약 1.16배 높았다(Table 3). 한편, 생장 효과는 크게 볼 수 없었으나 대조구에 비해 SAP 처리구에서 자란 아마란스의 페놀함량 및 항산화도는 각각 약 1.4, 1.12배 높아 기능성 물질 향상에 효과를 보였다(Table 4). 이는 처리구에서 발아 후 SAP(gel)에 뿌리를 내려 생장하였고 SAP 내부의 미네랄 양이 적어도 내부에서 직접 흡수를 하는 것이 원인으로, Na와 Cl의 결합으로 인한 염분 스트레스로 방어기작을 통한 기능성 물질 향상으로 예상되지만, 추후의 연구에서 집중적으로 검토할 필요가 있을 것으로 사료된다.
Table 3.
Growth characteristics of safflower and amaranth sprouts grown under the control and super absorbent polymer (SAP) (n = 5).
| Plant | Treatment | Weights (g/10 plants) | Moisture content (%) | Hypocotyl length (mm) | Stem diameter (mm) | |
| Fresh | Dry | |||||
| Safflower | Control | 0.83 ± 0.03y | 0.12 ± 0.01 | 85.40 ± 0.29 | 8.82 ± 0.34 | 1.61 ± 0.05 |
| SAP | 0.91 ± 0.08 | 0.13 ± 0.01 | 85.26 ± 0.64 | 8.99 ± 0.96 | 1.62 ± 0.03 | |
| Significantz | NS | NS | NS | NS | NS | |
| Amaranth | Control | 0.29 ± 0.03 | 0.055 ± 0.001 | 80.06 ± 1.89 | 6.76 ± 0.34 | 0.72 ± 0.02 |
| SAP | 0.30 ± 0.01 | 0.064 ± 0.001 | 78.81 ± 0.81 | 7.11 ± 0.16 | 0.79 ± 0.03 | |
| Significant | NS | ** | NS | NS | NS | |
Table 4.
Total phenolic concentration and antioxidant capacity of safflower and amaranth sprouts grown under the control and super absorbent polymer (SAP) (n = 5).
| Plant | Treatment | Total phenolic concentration (mg GAE·g-1 FW) | Antioxidant capacity (mM TEAC·g-1 FW) |
| Safflower | Control | 0.297 ± 0.013y | 0.246 ± 0.004 |
| SAP | 0.311 ± 0.012 | 0.245 ± 0.001 | |
| Significantz | NS | NS | |
| Amaranth | Control | 0.105 ± 0.006 | 0.224 ± 0.001 |
| SAP | 0.148 ± 0.01 | 0.253 ± 0.001 | |
| Significant | * | *** |