서 론
우리나라는 지구온난화로 인한 기후변동성의 증가로 이상고온과 저온의 강도와 빈도가 증가하고 있다(KMA, 2019). 특히 고위도 지방의 경우 온난화의 영향으로 과수의 휴면타파기, 발아기와 개화기가 빨라지면서 봄철 저온 피해 위험이 더욱 증가할 것으로 전망된다(Heide, 1993). 최근 10년간 우리나라는 겨울철 강한 한파와 봄철 이상 저온에 의해 농작물 피해가 해마다 증가하고 있으며 사과, 배의 경우 2018년-2020년 3년간 연속하여 3-4월에 저온 피해가 발생하였다(RDA, 2020).
2018년 전남, 울산 지역을 중심으로 4월 7일, 8일경 -10℃ ~-8℃까지 온도가 떨어지면서 배 저온 피해가 심각하였으며, 사과는 충북 충주, 보은, 전북 장수, 경남 거창 지역을 중심으로 피해가 발생했다. 특히 3월 평균기온이 평년(5.5-6.3℃)보다 높은 8.1℃를 기록하며(기상청, http://www.kma. go.kr) 과수 개화기가 빨라져 피해가 더욱 가중되었다. 또한 2020년 사과, 배의 개화기는 각각 10일, 12일 빨라졌으며, 4월 초 -3℃이하 온도가 발생하여 일반적으로 생육단계가 빠른 품종의 피해가 심각할 것으로 예상되었으나 개화기가 늦은 ‘후지’가 개화기가 빠른 ‘홍로’에 비해 피해가 심하게 발생한 것으로 보고되었다(RDA, 2020).
현재까지 이러한 저온 피해를 막기 위해 많은 방법들이 개발되어 왔으며, 물을 이용한 미세살수법은 액체인 물이 결빙하면서 발생하는 잠열(latent heat)을 수체에 전달하는 방법이며, 온풍기, 톱밥 등의 연소를 통해 직접적으로 대기온도를 상승시켜 피해를 예방할 수 있다(Cheong과 Song, 2002; Choi 등, 2011; Jo 등, 2012). 또한 봄철 저온 피해 방지를 위해서는 무엇보다 과원의 위치, 과종 및 품종의 선택이 중요하며(Kang 등, 2014), 과원이 저지대나 평지에 위치해 있으면 냉기의 정체를 막기 위해 방상팬을 이용하여 저온 피해를 방지할 수 있다.
사과나무의 꽃눈은 휴면(dormancy)중 -35℃ 이하에서도 동해 피해를 입지 않지만 휴면이 타파되어 탈경화(de-hardening) 과정을 거치며 조직 내 생장 활동이 시작되면 저온에 취약해진다(Salazar-Gutiérrez 등, 2016). 특히 개화기 과수의 저온 피해는 과종, 꽃눈의 생육단계(phenology)에 따라 발생하는 한계온도가 다르며(Proebsting과 Mills, 1978), 온대과수는 대부분 휴면이 타파되고 발육이 진전될수록 내한성(cold hardiness)이 약해져 개화 전까지는 내한성이 비교적 강하나 개화 직전부터 낙화까지 매우 약해진다(Murray, 2020). 또한 개화기 저온 피해에 대한 내한성은 품종에 따른 고유한 유전적 특성, 생육단계, 환경조건, 재배방식에 이르기까지 매우 복잡하고 다양한 요인에 의해 영향을 받는다(Rodrigo, 2000).
온대과수의 내한성(cold hardiness)과 휴면(dormancy)은 유리당과 관련이 깊으며 겨울철 휴면이 진행되면서 내한성이 증가하며 가지(stem)나 수피(bark)에서 유리당 함량이 증가하고, 휴면이 타파되어 발아가 이루어지게 되면 감소하는 것으로 알려져 있다(Sivaci, 2006). 또한 sorbitol은 사과나무와 같은 장미과(Rosaceae) 식물의 1차 동화산물로 총 유리당의 대부분을 차지하고 있으며(Loescher 등, 1990), 특히 온도가 내려갈 때 꽃눈에서 함량이 증가하고 내한성에 중요한 역할을 하는 것으로 알려져 있다(Cindy와 Ashworth, 1995).
또한 식물 호르몬은 생물적(박테리아, 곰팡이, 바이러스)와 비생물적(가뭄, 더위, 냉해, 염류) 스트레스를 인식하고 신호전달 및 방어 반응을 하여 불리한 환경조건에 적응하는데 매우 중요한 역할을 하는 것으로 알려져 있다(Verma 등, 2016). 특히 식물호르몬의 복잡한 신호 네트워크는 외부 정보를 내부 발달 프로그램을 제어·조절하여 스트레스 반응 경로를 활성화하는데 사용되며, 겨울철 수체 내 호르몬은 저온 스트레스 신호를 전달하고 내한성을 조절하는데 중요한 역할을 하는 것으로 알려져 있다(Eremina 등, 2016). 스트레스 호르몬 중 하나인 ABA(abscisic acid)는 저온 스트레스에 의해 생합성이 증가하며, 대사체 연구에 따르면 저온 유도된 ABA는 CBF (C-repeat binding factor)-dependent와 CBF-independent 경로 모두를 통해 작용하여 내한성에 영향을 미친다(Ashraf와 Rahman, 2018). 그러나 식물호르몬이 저온 스트레스 반응의 중심 조절자 역할을 하는 것은 확실하지만 수체 내 생합성과 이동경로뿐만 아니라 각 호르몬에 대한 상호작용 등에 대한 연구는 미비한 실정이다.
따라서 본 연구는 사과 ‘후지’보다 개화기가 빠른 ‘홍로’가 저온 피해가 심한 것이 일반적이나 2020년 4월 충북 보은 지역에서의 저온 피해는 ‘후지’가 ‘홍로’에 비해 피해가 심한 현상이 발생하여 피해 현황을 조사하였다. 또한 이러한 원인으로 2019년 늦은 수확에 의한 저장양분 부족이 제시되어 타당성 검증을 위해 두 품종 간 저온 처리에 의한 피해율 및 유리당, 호르몬 함량을 비교 분석하여 내부물질에 대한 영향을 알아보고자 수행하였다.
재료 및 방법
1. 시험재료 및 처리방법
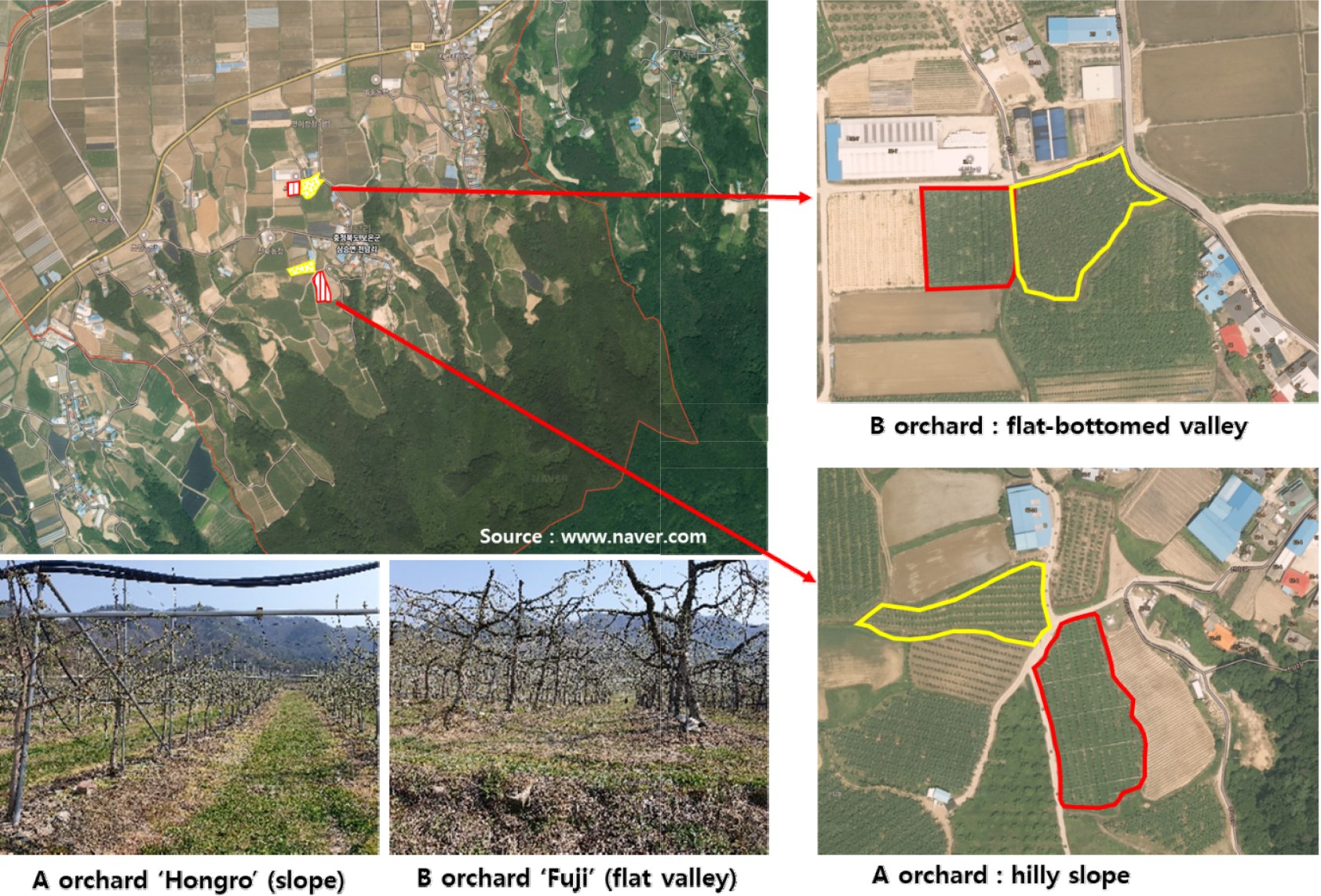
본 시험은 충북 보은군 삼승면(38° 22’36”N, 127°31’54”E)의 사과 과원 2곳(Fig. 1)에서 사과나무(Malus domestica Borkh) ‘후지’ 16년생, ‘홍로’ 6년생 2품종을 동시에 재배하고 있는 농가를 대상으로 2020년 4월에 시료를 채취하여 실시하였다. 본 과원들은 저온피해 방지를 위한 시설을 설치하지 않았으며, 현장 실태조사는 자연상태에서 저온에 노출되어 고사한 꽃눈의 피해율을 조사하기 위해 사과나무 꽃눈을 각 품종별 생육단계(Fig. 2)가 동일한 시료(tight cluster)를 100개 이상씩 3반복으로 채취하여 꽃눈을 횡단으로 절단하여 화총의 갈변율을 조사하였다. 또한 인위적으로 저온처리를 하기 위해 저온BOD 배양기(VS-1203P4S-3C, VISION Scientific CO., Korea)에서 1시간 동안 -2.0 ± 0.5℃, -4.0 ± 0.5℃에 노출 시킨 후 현장 피해율 실태조사와 같은 방법으로 100개 이상 3반복으로 화총의 갈변율을 조사하였다. 저온BOD 배양기 온도처리는 상온에서 0℃까지 시간당 2℃씩 하강시킨 후 0℃에서 목표온도인 -2.0 ± 0.5℃, -4.0 ± 0.5℃ 까지는 시간당 1℃씩 하강시켰다. 목표온도에서 1시간 동안 저온처리 후 다시 4℃까지 시간당 1℃씩 상승시켜 피해율 조사 및 분석시료 채취시까지 유지하였다.

Fig. 2
Sample’s development stages of apple flower buds. Red circles are the parts of samples (Murray, 2020).
2. 유리당 및 호르몬 분석
유리당 분석은 피해율 조사에 사용한 꽃눈과 동일한 조건의 시료를 선별하여 Kerepesi 등(1996)의 방법을 약간 수정하여 시료 0.5g 3반복으로 3차 증류수 25mL를 첨가하여 100℃에서 30분간 추출한 후 1분간 균질화 하였다. 4℃에서 10,000 × g 로 20분간 원심분리하여 얻어진 상징액을 C18 cartridges (Sep-Pak, Waters, USA)로 여과하여 분석에 사용하였다. UPLC (Waters, Ma, USA)로 유리당의 분리 및 정량 분석하였으며, 유리당 분리를 위한 컬럼은 Acquity UPLC BEH amide (100 × 2.1mm, 1.7µm, Waters, USA)으로 70℃에서 14분 동안 분석하였다. 이동상은 0.1% triethylamine이 포함된 85% acetonitrile을 이동속도 0.13µL·min-1로 유지하였다. ELSD 검출기의 이동상으로 질소 가스(40psi)를 사용하고 drift tube의 온도는 40℃, gain은 200으로 설정하였다. 최종 유리당 성분의 함량은 fructose, sorbitol, glucose, sucrose(Sigma- Aldrich Co. Ltd., USA) 각각의 표준품을 이용하여 검량선을 작성하였다.
호르몬 분석을 위해 Pan 등(2010)의 방법을 약간 수정하여 사용하였다. 각 시료를 액체 질소에서 분쇄하여 20mg 2-propanol/ H2O/HCl(2:1:0.022, vol/vol/vol)을 함유한 추출 용매 500μL를 첨가한 후 4℃에서 100rpm의 속도로 30분간 진탕하였다. Dichloromethane 1mL를 첨가한 후 4℃에서 30분간 반응시킨 후 13,000 × g로 5분간 원심분리하였다. 내부표준물질(ISTD)은 식물 호르몬 (±)9,10-Dihydrojasmonic acid(Sigma-Aldrich Co. Ltd., USA)를 사용하였다. 질량분석은 Agilent 1260 HPLC 시스템(Agilent Technologies, Boblingen, Germany)에 연결된 API4000 질량분석기(SCIEX, USA)에서 분석하였다. 호르몬 분리를 위해 Esclipe plus C18 column(4.6 × 50mm, 3.5µm, Agilent Technologies, Boblingen, Germany)에 시료 10µL를 주입하여 분석하였다. HPLC 분석 조건으로 solvent A는 0.1% formic acid를 포함한 methanol, solvent B는 0.1% formic acid를 포함한 water를 사용하였다. 이동상의 속도는 500µL·min-1, 컬럼 온도는 30℃를 유지하였다. 최종 정량 분석을 위해 2-cis,4-trans-Abscisic acid(ABA), indole- 3-acetic acid(IAA), salicylic acid(SA, Sigma-Aldrich Co. Ltd., USA) stock 용액을 100% methanol에 1mg·mL-1의 농도로 희석하여 사용하였다.
3. 통계분석
조사된 시험결과는 통계분석 패키지인 SAS Enterprise Guide 7.1(SAS Institute, Inc., Cary, USA)을 이용하여 이원분산분석(Two-Way ANOVA)을 통해 유의성을 검정하였으며, Duncan의 다중범위검정(Duncan’s multiple range test)으로 5% 유의수준에서 처리 평균 간 비교를 하였다.
결과 및 고찰
1. 저온 피해율 조사
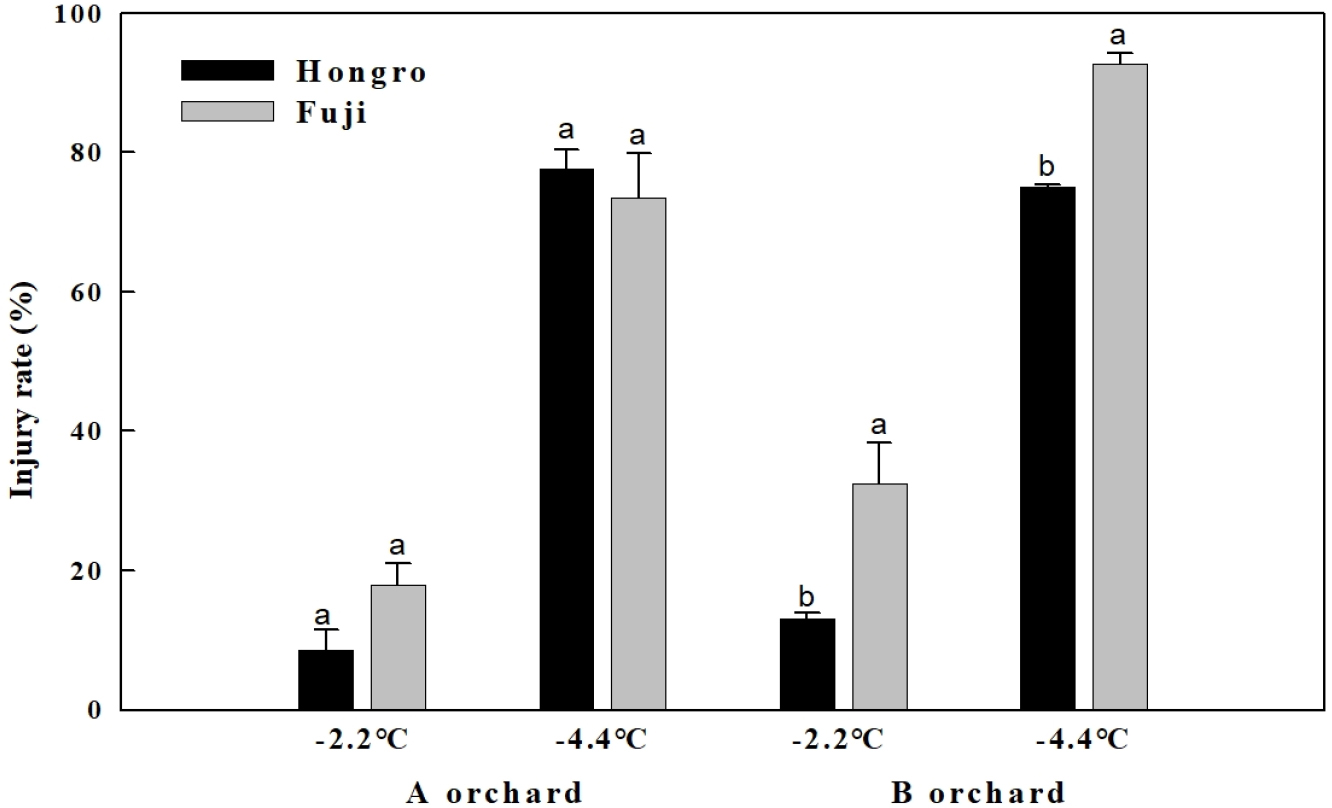
충청북도 보은군에서 생육단계별로 자연상태에서 저온에 노출되어 고사한 꽃눈의 저온 피해율 실태조사 결과(Table 1) 사과 ‘후지’의 평균 피해율은 A 농가에서 27.1%, B 농가 60.5% 로 ‘홍로’A 농가 5.7%, B 농가 25.8%보다 높았으며 품종 간 유의한 차이가 나타났다. 특히 B 농가의 경우‘후지’ 16년생(저지대, 평지)은 각 생육단계 모두에서 가장 높은 피해율을 나타냈으며, ‘홍로’, ‘후지’ 두 품종 모두 A, B 농가에서 생육단계가 진전될수록 저온 피해율은 높아지는 경향이었다. 이러한 품종 간 피해율 차이는 과수원의 입지조건, 나무의 수령 등에 영향을 받아 차이가 발생했을 것으로 판단된다. 특히 B 농가의 경우 계곡의 저지대 평탄지에 위치하고 있으며(Fig. 1) 개화기에 냉기가 정체되어 피해가 더욱 심하게 발생했을 것으로 추정된다.
Table 1.
Flower injury rate of ‘Fuji’ and ‘Hongro’ apple trees exposed to a natural low temperature event in April 2020.
| Orchard | Cultivar | Injury rate by growth stage (%) | |||
| Tight cluster | First pink | Full pink | Average | ||
| A | Hongro | 3.5 cz | 4.2 d | 9.6 c | 5.7 c |
| Fuji | 21.7 b | 44.8 b | - | 27.1 b | |
| B | Hongro | 12.8 cb | 21.4 c | 45.1 b | 25.8 b |
| Fuji | 54.0 a | 62.7 a | 75.4 a | 60.5 a | |
| ANOVA | |||||
| Orchard (A) | ** | ** | ** | ** | |
| Cultivar (B) | ** | ** | ** | ** | |
| A × B | ** | ns | ns | ** | |
또한 생육상태가 동일한(tight cluster) 사과 ‘후지’, ‘홍로’품종을 인위적으로 -2.0℃, -4.0℃ 저온 처리하여 비교한 결과에서도 두 농가 모두 품종 간 유의한 차이를 나타냈다(Fig. 2). 특히 B 농가의 경우 -2.0℃, -4.0℃ 처리구 모두에서 ‘홍로’보다 ‘후지’의 피해율이 높게 나타났으며, A 농가는 -2.0℃에서는 ‘홍로’보다 ‘후지’의 피해율이 높았으나 -2.0℃, -4.0℃ 처리구 모두에서 두 품종 간 유의한 차이는 없었다.
현장 실태조사와 실험실 내 인위적인 저온처리 모두에서 B 농가는 ‘후지’의 내한성이 ‘홍로’보다 취약했던 것을 확인 할 수 있었으며, A 농가는 품종 간 현장 실태조사에서 저온 피해율이‘후지’가 ‘홍로’보다 높게 나타났으나 인위적 저온처리에서는 유의한 차이가 없게 나타난 것은 지형, 지리적 특성과 재식방향 등 현장 상황의 영향으로 판단된다. 실제 개화기 전후의 꽃눈 내한성은 온도 변동에 따라 영향을 많이 받는 것으로 알려져 있으며(Lu과 Rieger, 1993; Salazar-Gutierrez 등, 2016), 또한 저온 발생 시 공기의 흐름에 따라 밀도가 높은 찬 공기가 저지대 평탄지에 정체되어 냉기가 지속적으로 머물러 피해를 가중시킬 수 있다(FAO, 2005). B 농가와 같은 지형의 과원에서는 이러한 냉기의 흐름을 원활히 하기 위하여 적극적으로 방상팬을 설치하고, 미세살수장치 등 저온 피해 경감시설을 설치하여 피해를 방지할 수 있을 것으로 판단된다.
2. 유리당 및 호르몬 변화 분석
사과 꽃눈의 유리당 함량을 분석한 결과(Table 2) 자연상태에서 저온피해율이 가장 높았던 B 농가 ‘후지’의 경우 total soluble sugar(TSS)는 44.1mg·g-1으로 가장 낮았으며, 피해율이 가장 낮았던 A 농가의 ‘홍로’ TSS는 98.2mg·g-1으로 가장 높게 나타났다. 특히 피해율이 가장 낮았던 A 농가 ‘홍로’에서는 fructose, sorbitol, glucose, sucrose 모든 유리당이 가장 높게 나타났으며, 피해율이 가장 높았던 B 농가 ‘후지’의 경우 이와는 반대로 모든 유리당 함량이 가장 적게 나타났다. Sucrose와 sorbitol은 세포막 단백질을 직접 보호하거나 탈수를 막기 위한 수소결합을 좀 더 단단히 하여 얼음 결정(ice nucleation)의 성장을 지연시키는 것으로 알려져 있으며, 이러한 작용으로 세포의 동결 중 갑작스러운 수분 손실로부터 세포막 단백질과 효소를 보호한다(Cindy와 Ashworth, 1995; Khanizadeh 등, 1989). 본 실험에서는 유리당과 저온피해율을 상관분석 하였으며 모든 유리당과 저온피해율은 유의한 부의 상관을 보였다(Fig. 3). 특히 sorbitol 함량과 저온 피해율은 결정계수가 r2 = 0.99로 매우 높은 부의 상관을 나타냈으며, glucose, sucrose 또한 0.94, 0.96으로 높은 부의 상관을 나타냈다. 이러한 결과는 앞선 연구들과 매우 유사한 경향이었으며, 유리당 함량이 높을수록 꽃눈의 내한성을 높여 저온 피해율이 낮게 나타난 것으로 판단된다.
Table 2.
Concentrations of soluble sugars in flower buds at tight cluster stage of ‘Fuji’ and ‘Hongro’ apple flower buds.
| Orchard | Cultivar | Concentration (mg·g-1 dry wt) | ||||
| Fructose | Sorbitol | Glucose | Sucrose | Total contents | ||
| A | Hongro | 35.6 az | 26.9 a | 31.2 a | 4.4 a | 98.2 a |
| Fuji | 13.0 c | 24.0 ab | 21.4 b | 3.8 bc | 62.1 bc | |
| B | Hongro | 27.0 b | 23.6 ab | 23.9 b | 3.9 ab | 78.5 ab |
| Fuji | 7.3 c | 18.7 b | 14.7 c | 3.3 c | 44.1 c | |
| ANOVA | ||||||
| Orchard (A) | ** | ** | ** | ** | ** | |
| Cultivar (B) | ** | ** | ** | ** | ** | |
| A × B | ns | ns | ns | ns | ns | |
본 연구에서 호르몬 분석 결과(Table 3), A 농가의 ABA (abscisic acid) 함량은 정상 조직에서 5.0ng·g-1으로 낮은 반면 손상된 조직에서는 ‘홍로’, ’후지’ 각각 9.1ng·g-1, 6.1ng·g-1으로 높게 나타났으며, B 농가 또한 손상된 꽃눈에서 ‘홍로’, ‘후지’ 11. 0ng·g-1, 8.9ng·g-1으로 높았다. 본 실험결과 손상된 조직에서의 ABA 함량은 앞선 연구결과와 유사한 경향으로 높았으며 저온피해율과 ABA 함량 사이 통계적으로 유의한 상관을 나타냈다. 특히 많은 식물에서 저온에 대한 반응으로 ABA 생합성이 증가하였으며, 인위적으로 ABA를 처리한 식물체와 ABA 함량을 변형한 돌연변이에서도 내한성이 증가하였다(Baron 등, 2012). 일반적으로 ABA는 가뭄, 염분, 냉해, 고온 등 환경 스트레스 조건에서 ABA 수준이 증가하여 비생물적 스트레스에 대한 식물 방어를 담당하는 것으로 알려져 있다(Zhang, 2006). ABA는 저온에 대한 반응으로 CBF(C-repeat binding factor) 전사를 제어하여 COR(Cold regulated) 유전자 발현에 영향을 미치는 것으로 추정된다(Eremina 등, 2016). 또한 과수의 휴면과 관련된 ABA의 수준은 생육 초기에 적은 상태였다가 휴면 초기에 최대가 되며 내재휴면에서 환경휴면으로 전환될 때 감소한다(Borkowska와 Powell, 1982).
Table 3.
Concentrations of ABA, IAA and SA in flower buds at tight cluster stage of ‘Fuji’ and ‘Hongro’ apple flower buds (unit: ng·g-1 dry wt).
| Cultivar | State | A orchard | B orchard | |||||
| ABAz | IAA | SA | ABA | IAA | SA | |||
| Hongro | Normal | 5.0 by | 2.0 ab | 5.3 b | 6.1 b | 1.8 c | 1075.2 b | |
| Injury | 9.1 a | 2.3 a | 18.3 b | 11.0 a | 2.4 b | 1881.2 a | ||
| Fuji | Normal | 5.0 b | 1.8 b | 631.7 a | 6.9 b | 2.0 c | 598.2 c | |
| Injury | 6.1 b | 2.0 ab | 354.8 a | 8.9 ab | 3.0 a | 678.1 bc | ||
| ANOVA | ||||||||
| Cultivar (A) | ** | ** | ** | ns | ** | ** | ||
| States (B) | ** | ** | ** | ** | ** | ** | ||
| A × B | ** | ns | ** | ** | ** | ** | ||
본 시험에서 auxins 중 하나인 IAA(indole-3-acetic acid)는 정상 꽃눈 조직에서 1.8-2.0ng·g-1 수준으로 낮은 경향이었으며 손상된 조직에서는 다른 호르몬과 유사하게 2.3-3.0ng·g-1으로 높아지는 경향을 나타냈다. Auxins은 적당한 환경조건 아래에서 식물의 생장과 발달의 거의 모든 부분을 조절하는 필수적인 역할에 관여하지만 저온 상태에서의 auxins에 대한 연구는 매우 적으며, 일부 애기장대에서 저온처리에 의해 꽃과 뿌리의 중력굴성(gravitropism)이 억제되고 auxins의 기관 내 세포 분배와 이동에 영향을 주는 것으로 알려져 있다(Rahman, 2013; Shibasaki 등, 2009).
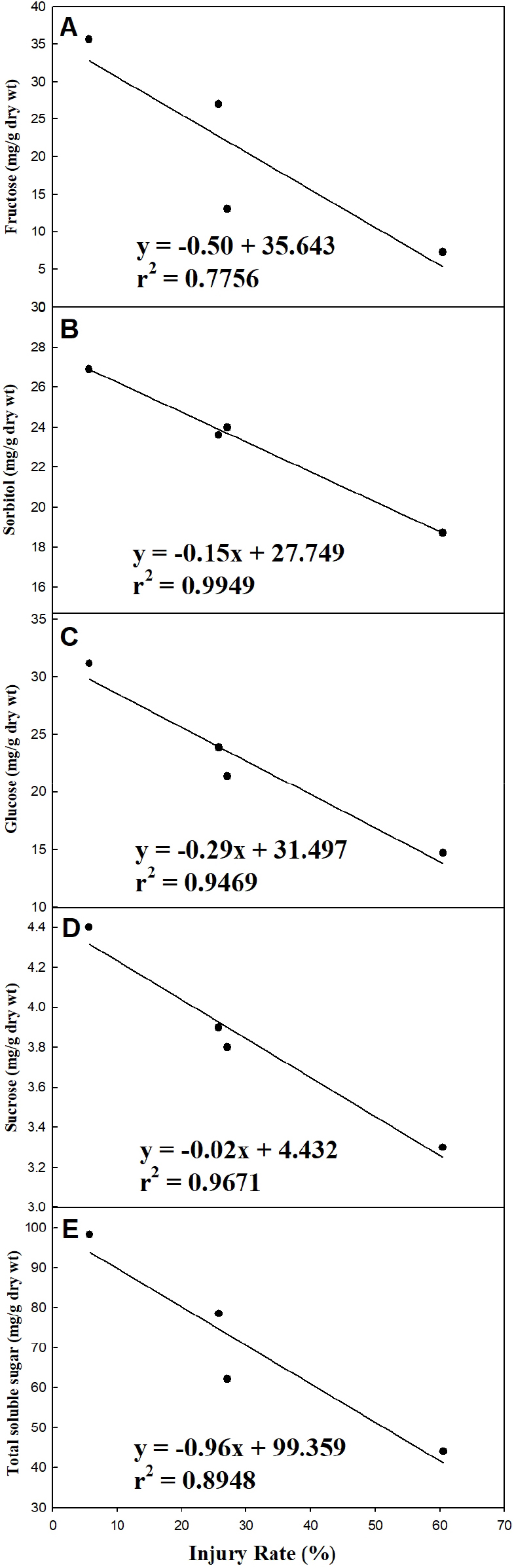
Fig. 4
Relationship between soluble sugar contents and average injury rate (in Table 1) of flower buds in ‘Fuji’ and ‘Hongro’ apple trees damaged to natural low temperature in both orchards. (A) fructose, (B) sorbitol, (C) glucose, (D) sucrose and total soluble sugar (E) contents.
Salicylic acid(SA)는 시험 결과 A 농가에서는 ‘홍로’ 품종보다 ‘후지’품종에서 매우 높게 나타났으나 B 농가에서는 이와는 반대로 ‘홍로’에서 매우 높은 수치를 나타났으며 ‘후지’는 A 농가와 비슷한 수준이었다. SA는 식물의 생장, 발달, 성숙과 병원균 성장을 억제하기 위해 auxin/IAA 발현을 조절하는 것으로 알려져 있으며(Dong 등, 2007), 특히 수분(water), 염류(salinity), 동해(cold)와 같은 환경스트레스에 반응하여 생장을 조절하는 중요한 역할을 한다(Miura와 Tada, 2014). 또한 저온상태에서 낮은 SA수준은 탄소 동화 및 sucrose, 프롤린(proline)과 같은 동결 보호제 합성을 위한 효소를 코딩하는 유전자의 발현을 감소시키고 광합성 효율 감소 및 세포막 손상을 증가시키는 것으로 알려져 있다(Dong 등, 2014). 일반적으로 낮은 농도의 SA는 식물의 항산화 능력을 향상시킬 수 있지만 높은 농도의 SA는 세포의 사멸이나 환경 스트레스에 대한 감수성을 유발할 수 있으며(Hara 등, 2012), 식물체 내에서 저온에 의해 SA 축적을 촉진하여 생장이 억제되고 저온에 반응하여 생장을 조절한다(Scott 등, 2004). 본 연구도 앞선 연구와 유사하게 SA는 정상 조직보다 특히 저온에 의한 피해를 입은 조직에서 높은 함량을 나타났으며, 꽃눈의 세포가 죽거나 저온에 반응하면서 높아진 것으로 추정된다.
본 연구 결과 사과의 꽃눈에서 유리당과 호르몬은 저온 스트레스에 반응하여 내한성을 증진시키는 역할을 하는 것으로 추정되며, 특히 환경 스트레스에 의해 반응하는 세포 수준에서의 호르몬 연구나 분자 수준의 생리적 대사 연구가 좀 더 필요하다.