서 론
재료 및 방법
1. 실험 재료 및 재배 조건
2. 생육조사 및 화아분화율 비선형 회귀분석
3. 통계분석
결과 및 고찰
1. 매리골드의 화아분화
2. 매리골드의 생육
3. 매리골드 화아분화를 위한 최적의 광주기
서 론
작물을 재배할 때, 연중 계획 생산은 매우 중요하다(Proietti 등, 2022). 특히, 화훼작물에서 개화의 조절은 계획적인 주년 생산을 가능하게 하고, 연중 공급량을 늘릴 수 있다(Armitage와 Laushaman, 1989; Hong 등, 2013). 광도와 광주기는 식물의 생장과 식물 내 다양한 물질 발현 조절뿐만 아니라(Nishimura 등, 2006; Nozue 등, 2010; Jo 등, 2016), 화아의 발달과 형성, 개화 시기를 조절하는 데 필수적인 환경 요소이다(Paradiso와 Proietti, 2022; Proietti 등, 2022). 식물은 개화를 유도하는 광주기에 따라 한계일장(Proietti 등, 2022)보다 명기가 짧은 조건에서 개화하는 단일식물, 반대로 한계일장보다 명기가 긴 조건에서 개화하는 장일식물, 그리고 광주기의 영향을 받지 않고 개화하는 중성식물로 구분할 수 있다(Runkle, 2002; Park 등, 2021). 한계일장은 작물마다 다르며 국화, 벼와 같이 생태형 또는 품종에 따라 한계일장이 다른 경우도 있다고 보고되었다(Mimoto 등, 1989; Collinson 등, 1992; Seo 등, 2016; Lee 등, 2019). 화훼 재배에서 개화 조절에 적용되는 광주기가 과도하게 길 경우, 인공광원의 에너지 이용 효율성이 떨어지고(Gao 등, 2020; Jin 등, 2022; Kim 등, 2022), 짧을 경우 작물의 생육이 부진하거나 품질이 저하되고, 생산량에 문제가 생긴다(Heo 등, 2006; Kwon 등, 2014).
Park과 Kim(2020)은 제어되지 않고 기후의 영향을 받는 온실 재배보다 인공적으로 환경조건을 통제할 수 있는 식물공장에서 국화를 재배하는 것에 관한 관심이 높아지고 있다고 보고했다. 식물공장은 밀폐된 공간에서 광, 온도, 습도, 이산화탄소, 배양액 등 다양한 환경조건을 인공적으로 제어하며 작물을 재배한다. 식물공장 중에서도 완전제어형 식물공장은 인공광만 이용하여 작물을 재배하기 때문에 초기 비용과 전력 비용이 많이 소요된다. 하지만 식물공장에서 재배되는 작물은 외부 환경의 영향을 받지 않으며 병.해충의 피해에서 자유롭기 때문에 고품질의 작물을 안정적으로 대량 생산할 수 있고, 생육 예측이 용이하다(Cha 등, 2014). 따라서 작물의 품질, 생산량, 에너지 소비량을 모두 고려한 최적의 광주기를 구명할 필요가 있고, 실제로 작물 생산량과 광의 상관관계를 기반으로 투입된 광 에너지 효율성을 높이는 연구가 전 세계적으로 이루어지고 있다(Im 등, 2013). 식물공장 관련 연구들은 엽채류에 집중되어 있었으나, 최근 들어 고부가가치 작물인 토종 약용식물이나 기능성 식물에 관한 연구도 수행되고 있다(Kim과 You, 2013; Lee 등, 2016a, 2016b; Hwang 등, 2016). 그러나 여전히 화훼작물에 관한 연구는 제한적이다(Park과 Kim, 2020).
꽃은 식물이 영양생장 때부터 축적해 온 모든 에너지의 총합체로, 화려한 형태를 가지고 있다(Lee 등, 2014). 식용화(edible flower)는 먹을 수 있는 꽃으로, 과채류, 엽채류와 같이 많은 항산화 물질이 함유되어 있다고 밝혀져 새로운 기능성 식품으로 각광받고 있다(Park과 Kim, 2017). 과거에 화훼작물은 식품으로 거의 이용되지 않았고(Park 등, 2005), 식용으로 사용하려면 무농약으로 재배해야 하기 때문에(Johansson 등, 2014; Dujmović 등, 2022) 식용화를 재배하는 농가가 많지 않았다. 현재는 식용화 재배 농가의 수도 증가하는 추세이며, 섭취 방법 또한 다양해지고 있다(Yoo 등, 2021). 식용화는 꽃차로 가장 많이 소비되며, 주로 국화과 식물이 차 가공품으로 가장 많이 이용된다(Lee, 2010; Oh 등, 2018).
프렌치매리골드(Tagetes patula L.)는 초롱꽃목, 국화과, 천수국속 식물로 영어로는 ‘French marigold’, 한국어로는 만수국이라 부른다(Park 등, 2017). 매리골드는 처음에 관상용 화훼 작물로 도입되었으나(Kim 등, 2021) 요즘은 기능성 작물로 많이 연구되고 있다. 매리골드는 눈 건강에 좋은 루테인이 총 카로티노이드의 91%로 함유되어 있고, 플라보노이드 함유량도 높아 항산화, 항염, 항암 효과를 보인다(Kishimoto 등, 2005; Meda 등, 2005; Muley 등, 2009; Siriamornpun 등, 2012; Bhave 등, 2020). Seo 등(2016)은 국화의 화아분화 한계일장과 최적일장이 생태형에 따라 다르다고 보고했다. 국화과 작물에 속하는 매리골드도 국화와 유사한 특징을 지녔을 것이라 생각된다. 광과 개화에 관련된 선행연구가 있는 다른 국화과 작물과는 다르게(Park과 Kim, 2020; Park과 Kim, 2021; Park과 Lee, 2021) 매리골드의 화아분화 또는 개화와 광주기의 상관관계에 관한 선행 연구는 미흡하다. 매리골드는 양적 단일식물로 한계일장이 개화에 큰 영향을 주지 않는다(Proietti 등, 2022). 따라서 매리골드를 식물공장 내에서 주년 재배하기 위해서는 화아분화가 일어나는 날까지의 최단 소요일수를 나타내는 최적의 광주기(optimum photoperiod)를 추정할 필요가 있다.
본 연구에서는 완전제어형 식물공장에서 매리골드를 연중 균일하게 효율적으로 재배하기 위해 화아분화에 영향을 주는 최적의 광주기를 구명하였다.
재료 및 방법
1. 실험 재료 및 재배 조건
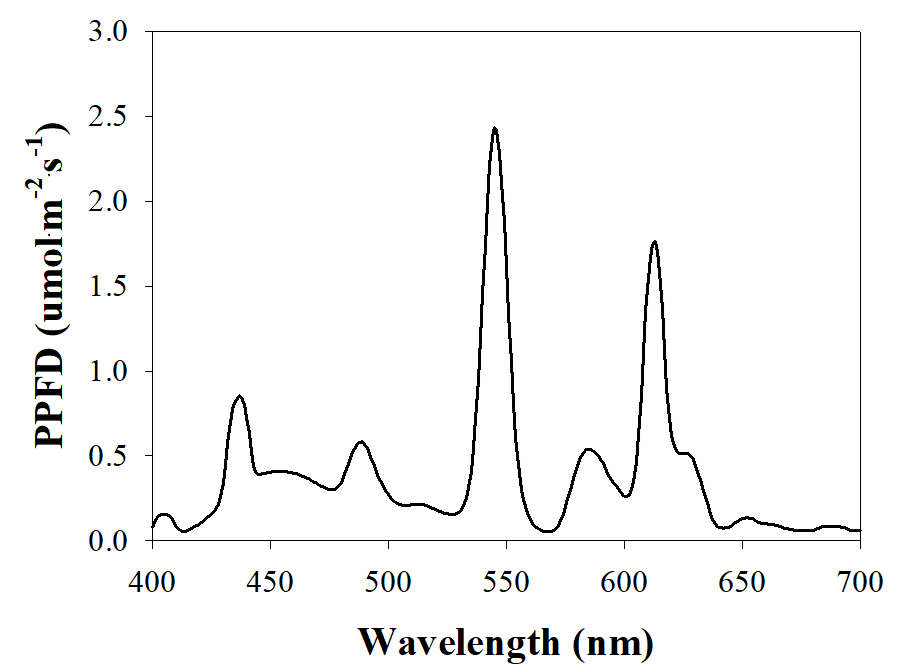
프렌치매리골드(Tagetes patula L.) ‘Durango Red’ 종자(Hanmi Seeds Co., Korea)를 우레탄 스폰지(3.5×3.5×3.0cm)에 파종한 직후부터 광처리를 하였다. 실험에 사용된 광주기는 모든 처리구가 오전 6시부터 시작하여, 명기/암기 시간을 각각 4/20시간, 8/16시간, 12/12시간, 16/8시간, 총 4가지로 설정하였다. 삼파장 형광등(PL-L 55W/865/4P, Philips, Korea)을 광원으로 사용하였으며, 각 처리구별 사용된 광원의 총 광합성유효광양자속밀도(photosynthetic photon flux density, PPFD)는 평균 118µmol·m-2·s-1였으며, 광질은 분광복사계(PG200N Spectral PAR Meter, UPRtek, Taiwan)로 분석하였다(Fig. 1).
실험은 처리별로 91개체씩 3반복으로 진행하였으며, 4시간 처리구을 제외한 나머지 처리구에서 화아분화가 60% 이상 일어난 DAS(days after sowing) 30일에 실험을 종료하였다. 배양액은 4가지 처리구 모두 EC 1.5dS·m-1의 Hoagland (Hoagland와 Arnon, 1950) 양액[Ca(NO3)2·4H2O 1,180g, KNO3 608.6g, NH4H2PO4 115g, MgSO4·7H2O 295.2g, Fe-EDTA 38.4g, CuSO4·5H2O 0.08g, H3BO3 2.86g, MnSO4· 5H2O 2.11g, ZnSO4·7H2O 0.22g, Na2MoO4·2H2O 0.03g]을 처리하였으며, 본엽이 1쌍(2매) 정도 전개되었을 때부터 공급하였다.
2. 생육조사 및 화아분화율 비선형 회귀분석
처리구 별 화아분화는 2-3일 간격으로 조사하였고, 육안으로 꽃봉오리가 보일 때(꽃봉오리가 약 2mm 이상일 때) 화아분화가 되었다고 정의하였다(Fig. 2A). 실험이 끝난 DAS 30일에 처리구별 무작위로 선발한 표본 30개를 대상으로 생육조사를 하였다. 조사 항목으로는 지상부의 생체중과 건물중, 초장, 엽면적을 조사하였다. 생체중과 건물중은 저울 BP61(Sartorius, Germany)을 이용하였고 드라이오븐(VS-1202D2, Vision Scientific, Korea)에 70℃로 72시간 이상 건조하여 측정하였다. 엽면적은 자엽을 제외한 본엽만 측정하였으며, 엽면적 측정기(Li3000C, Li-Cor Inc., USA)를 이용하였다.
동적 생장을 묘사하고 분석하기에 가장 적합한 Gompertz 생장함수를 이용하여 생장함수를 추정하고(Lee 등, 2022), 시계열에 따른 매리골드의 화아분화율을 분석하였다. 최적의 광주기는 추정된 값을 이용해 식물체의 50%가 화아분화 된 날을 기준으로 정의하였다. 화아분화가 진행되지 않은 4시간 처리구부터 8시간 처리구 사이의 화아분화율은 추정된 값을 역수로 취해 분석하였다.
등식 1에서 y는 화아분화율, x는 파종 후 일 수(DAS), 그리고 a, b, x0은 상수이다.
3. 통계분석
실험에 사용된 통계처리는 SAS 프로그램(SAS 9.1, SAS Institute Inc., USA)을 이용하였고, Duncan 다중검정법(Duncan’s multiple range test, p ≤ 0.05)으로 각 처리구 사이의 통계적인 유의성을 검정하였다. 모든 그래프는 SigmaPlot(10.0, Systat software, Inc., Chicago, IL, USA)프로그램을 이용하여 작성하였다.
결과 및 고찰
1. 매리골드의 화아분화
매리골드 ‘Durango Red’는 16시간 처리구에서 가장 먼저 60% 이상 화아분화하였으며, 12시간과는 유의차가 없었다(Fig. 3).
매리골드는 Hwang 등(2022)의 연구에서 사용된 배초향과 같이 단일 조건뿐만 아니라 명기가 긴 장일 조건에서도 개화하는 양적 단일식물이다(Proietti 등, 2022). 하지만 첫 개화까지의 소요일과 화서의 길이가 10시간 처리구에서 유의적으로 높은 결과를 나타낸 배초향과는 반대로 본 연구에 사용된 매리골드는 16시간 처리구에서 가장 먼저 화아분화가 일어났다. Park과 Lee(2021)는 단일식물인 스탠다드 국화 ‘백마’의 광주기처리 실험에서 8, 10, 12시간 단일조건 처리구 중 8시간 처리구에서 평균 출뢰소요일이 가장 늦었으며, 다른 조건들에 비해 광수준이 더 낮았기 때문에 이와 같은 결과가 나타났다고 보고했는데, 본 실험의 결과와 유사하였다. 호접란(Phalaenopsis)은 저조도 조건에서 C/N율이 낮아져 수상꽃차례의 형성과 개화가 억제되며(Tsai와 Chang, 2022), 매리골드는 일적산광량(daily light integral, DLI)이 높을수록 개화율, 화수, 꽃지름이 높게 나왔다고 보고되었다(Moccaldi와 Runkle, 2007). 선행 연구와 비교하였을 때, 매리골드의 화아분화 결과는 처리구별 광주기와 다른 환경 요소들이 상호 작용한 것으로 추측된다. 매리골드는 광주기가 길수록 꽃봉오리와 꽃의 개수가 줄어들고(Han과 Yeam, 1978), 작물은 다르지만, 참깨는 단일조건에서 개화가 촉진되나 영양생장이 제대로 이루어지지 않아 생산량이 줄어든다고 보고되었다(Shim 등, 2020). 후속 연구를 통해 광주기와 꽃 생산량의 상관관계에 관한 연구가 필요할 것으로 생각된다.
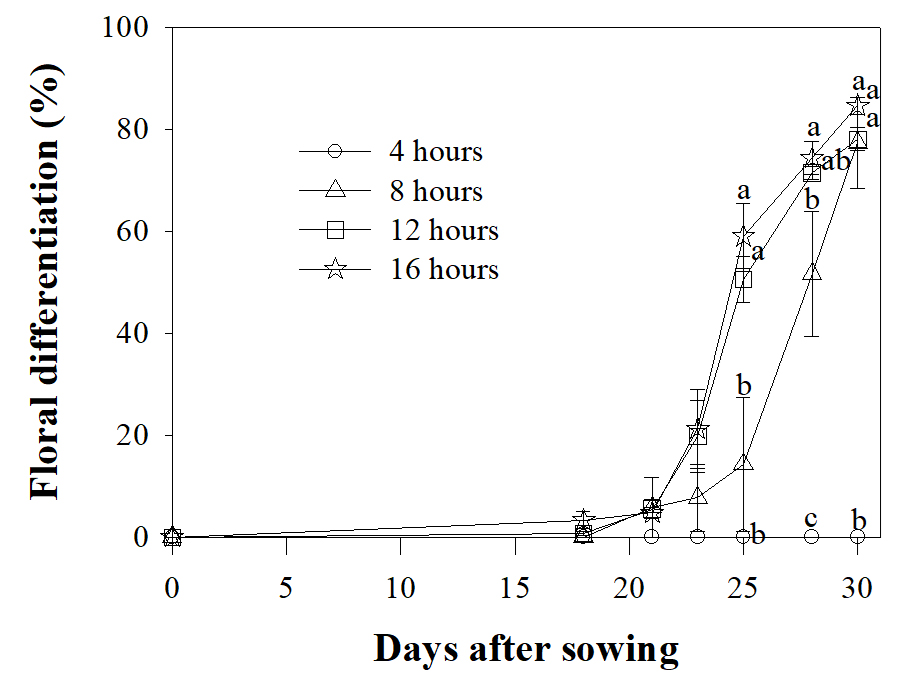
Fig. 3.
Changes in average floral differentiation rate of French marigold ‘Durango Red’ as affected by photoperiod after sowing. Vertical bars represent standard error of the means (n = 91). Within-graph means followed by the same letter are not significantly different by Duncan’s multiple range test at p ≤ 0.05.
2. 매리골드의 생육
실험이 끝난 DAS 30일에 측정한 매리골드 지상부의 생육량 결과는 Fig. 4와 같다. 16시간 처리구의 지상부 생체중 값이 2.6g으로 가장 높았으며, 2.3g인 12시간 처리구와는 통계적으로 차이가 없었다. 4시간 처리구는 지상부 생체중이 0.04g으로 가장 낮을 값을 나타냈다. 지상부의 건물중 결과도 생체중과 유사하게 4시간 처리구가 0.002g으로 가장 낮은 값을 보였고, 16시간 처리구가 0.2g으로 가장 높은 값을 보였다.

Fig. 4.
Fresh weight (A) and dry weight (B) of shoots of French marigold ‘Durango Red’ depending on photoperiod at 30 days after sowing. Vertical bars represent ±SE of the means (n = 30). Within-graph means followed by the same letter are not significantly different by Duncan’s multiple range test at p ≤ 0.05.
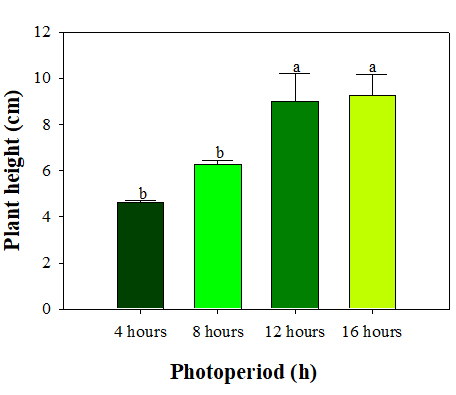
광주기에 따른 매리골드의 최종 초장은 명기의 증가에 따라 증가하였다(Fig. 5). 하지만 16시간과 12시간이 각각 9.3cm, 9.0cm로 유의적인 차이를 보이지 않았다. 이는 절화 국화 ‘백마’를 다양한 광주기 조건으로 처리하였을 때, 명기가 길수록 초장이 증가한 결과(Park과 Lee, 2021)와 동일하였다.
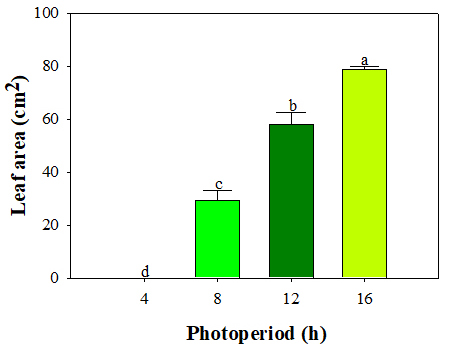
매리골드의 엽면적은 명기가 길수록 높아지는 정의 관계를 보였다(Fig. 6). 16시간 처리구가 78.81cm2로 가장 높았으며 다른 처리구와 유의한 결과를 보였다. Kim 등(2015)은 씀바귀의 영양기관 발달은 명기의 길이가 길수록 동화산물 합성에 의해 증가하며, Sul 등(2022)은 들깨의 생육량은 광량과 정의 관계를 가진다고 하였다. 4시간 처리구에서 본엽이 아예 발달하지 못한 것으로 보아 광합성 시간이 충분하지 않았고, 이로 인해 생육이 제대로 이루어지지 못했다고 판단된다. 본 실험과 비슷하게 진행된 Kim 등(2015)의 실험에서도 씀바귀는 광질과 상관없이 광주기가 짧을수록 생체중, 건물중, 엽면적의 값이 낮아졌다.
3. 매리골드 화아분화를 위한 최적의 광주기
생장이 지나치게 지연되어 실험을 중단한 4시간 처리구를 제외한 나머지 광주기 처리구에서 파종 후 일수에 따른 화아분화의 변화 경향은 모두 S자 생장곡선 패턴을 나타냈고, 모델식을 통해 예측된 상수값은 a = 288.4, b = 6.6, x0 = 31.8였다(등식 1). 개발된 예측 회귀 모델식을 이용하여 각 처리구별 매리골드의 화아분화가 50% 일어나는 파종 후 일수(DAS)의 예측값을 추정하고(Fig. 7A), 4시간부터 8시간 광주기 사이의 50% 화아분화가 일어난 날을 예측하기 위하여 역수를 취하였다(Fig. 7B). 화아분화가 진행되지 않은 4시간 처리구의 화아분화율은 정확히 알 수 없는 무한대이기 때문에 생장함수로 값을 추정하여 수치화 할 수 없다. 하지만 4시간 처리구의 값이 0이 되도록 역수를 취하면 4시간 처리구부터 8시간 처리구 사이의 데이터를 시각화 하고, 광주기에 따라 50% 화아분화가 일어난 날을 예측할 수 있다. 모델식을 통해 추정된 DAS는 8시간 광주기 조건에서 평균 27.6일, 12시간과 16시간 광주기에서는 8시간보다 3일 빠른 평균 24.6일이었고, 12시간과 16시간 간에는 유의차가 없었다.

Fig. 7.
Prediction days after sowing of 50% floral differentiation (A) and the inverse of days after sowing to 50% floral differentiation (B) in French marigold ‘Durango Red’. Values were calculated by the Gompertz growth model derivatives. Vertical bars represent standard error of the means of the three replications (n = 91). Within-graph means followed by the same letter are not significantly different by Duncan’s multiple range test at p ≤ 0.05.
본 연구에서 사용된 비선형 모델식은 예측값과 측정값을 99% 이상 유의적으로 설명하여 매리골드의 화아분화를 광주기별로 조절하기 위한 지표로 사용 가능하다고 판단된다. 그러나 광주기 조건을 더욱 다양하게 처리하여 모델식을 교정 및 검증하고, 완전제어형 식물공장에서 매리골드를 재배하기에 적합한 모델함수를 구명하는 후속 연구가 필요하다고 생각된다.
매리골드의 생육과 화아분화율이 가장 좋았던 처리구는 16시간 처리구였다. 하지만 건물중과 엽면적의 결과를 제외한 나머지 결과는 12시간 처리구와 유의하지 않았다. 완전제어형 식물공장은 인공광 사용으로 에너지 소비량이 많아 적합한 광조건을 선정하여 생산비를 낮추는 노력이 필요하다(Krijn 등, 2017; Sul 등, 2022). 따라서 식물공장에서 재배하는 작물의 광주기가 짧은 것이 경제적이라 생각된다. 이상의 결과를 바탕으로 완전제어형 식물공장에서 재배되는 매리골드의 화아분화에 영향을 주는 최적의 광주기는 12시간이라 판단된다. 본 연구에서는 광주기만을 제어하여 실험하였다. 식물의 화아분화에는 광, 온도, 이산화탄소 등 환경 요소들이 복합적으로 영향을 미치는데, 이를 고려하지 않았다. 추후 완전제어형 식물공장에서 매리골드 재배를 효율적으로 하기 위한 다양한 연구가 필요할 것으로 판단된다.