서 론
재료 및 방법
1. 고추 재배 및 살리실산 엽면살포
2. 광합성 측정
3. 단백질 정량 및 malondialdehyde(MDA), H2O2 함량 분석
4. 항산화효소 활성 분석
5. 생육 및 수량 특성 조사
6. 통계분석
결과 및 고찰
1. 광합성 특성 변화
2. MDA, H2O2 함량 변화
3. 항산화효소 활성 변화
4. 생육 및 수량 변화
서 론
고추(Capsicum annuum L.)는 대표적인 조미채소 중 하나로, 2021년 기준 국내 재배면적 33,373ha, 생산량 92,756톤으로 가장 많은 생산량과 경제적 규모를 가지는 중요 작물이다(KOSTAT, 2021). 우리나라에서는 온도가 높은 여름철 노지에서 대부분 재배되기 때문에 기상 조건의 영향을 많이 받는다. 특히 고온과 건조 스트레스에 노출 시 잎에서의 수분함량과 수분 포텐셜이 감소함에 따라 광합성 속도와 효율이 저하되고, 착화율과 착과율의 감소 및 기형과 발생률 증가로 생산량이 감소된다(Hwang과 Tae, 2001; Lee 등, 2014; Lee 등, 2018; Pagamas와 Nawata, 2008; Song 등, 2014; Song 등, 2016). 대사 이상과 생리장해의 대부분은 환경 스트레스 노출에 의해 세포 내의 superoxide(O2-), hydroxyl radicals(OH), hydrogen peroxide(H2O2)와 같은 활성산소가 축적되고, 이로 인한 세포 손상 및 광합성 억제로 인해 발생한다(Baxter 등, 2014). 한편, 식물은 과잉된 활성산소를 줄여 스스로를 보호하기 위해 ascorbate peroxidase(APX), catalase(CAT), peroxidase(POD), superoxide dismutase(SOD) 등과 같은 항산화 효소를 생성하거나 비타민, 식물성 화합물, 미네랄 등의 다양한 저분자 항산화물질을 이용하여 스트레스에 대한 저항성을 증가시킨다(Xie 등, 2019).
살리실산(SA, salicylic acid)은 식물의 생장과 발달, 증산 속도 감소, 기공변화 조절, 광합성 능력 향상, 이온의 흡수와 전달 등의 다양한 생리적 대사작용을 조절한다고 알려져 있다(Arfan 등, 2007; Khodary, 2004; Manaa 등, 2014). 특히 환경스트레스에 의한 방어 기작에 관여하는 신호 전달 물질로서 항산화효소들의 기능을 조절하여 스트레스에 의한 저항성을 증진시킨다(Elwan과 El-Hamahmy, 2009; Kawano와 Bouteau 2013; Khanna 등, 2016; Parashar 등, 2014). 최근 살리실산을 이용한 환경스트레스에 대한 내성을 증가시키는 실험이 수행되어, 처리 효과가 구명되고 있다. 특히, 고온 또는 건조 스트레스 조건에서 고추, 토마토, 오이 등 과채류의 살리실산 처리는 작물의 광합성 능력과 항산화효소 활성 향상, 전해질 유출량 감소 등의 생리작용을 통해 스트레스 저항성을 증가시켰다(Bahram, 2010; Jahan 등, 2019; Kaya, 2021; Lobato 등, 2021; Mardani 등, 2012; Zhang 등, 2020). 또한 일반 재배환경에서 고추와 토마토의 살리실산 처리는 항산화효소 활성의 증가와 대략 20% 정도 수량을 높이는 것으로 보고되었다(Dobón-Suárez 등, 2021; El-Hady 등, 2021). 고온・염 혼합 스트레스 조건 시 고추의 살리실산 처리에 의한 스트레스 저항성이 보고되었으나(Otálora 등, 2020), 고온・건조 조건에서의 연구는 미흡한 실정이다. 따라서 본 실험은 이상기상 현상으로 인한 고추의 수급불안을 극복하기 위해서 고온・건조 조건 시 살리실산의 경엽처리가 고추의 생육 및 생리활성반응에 미치는 영향을 분석하여 피해 경감 효과를 확인하고자 하였다.
재료 및 방법
1. 고추 재배 및 살리실산 엽면살포
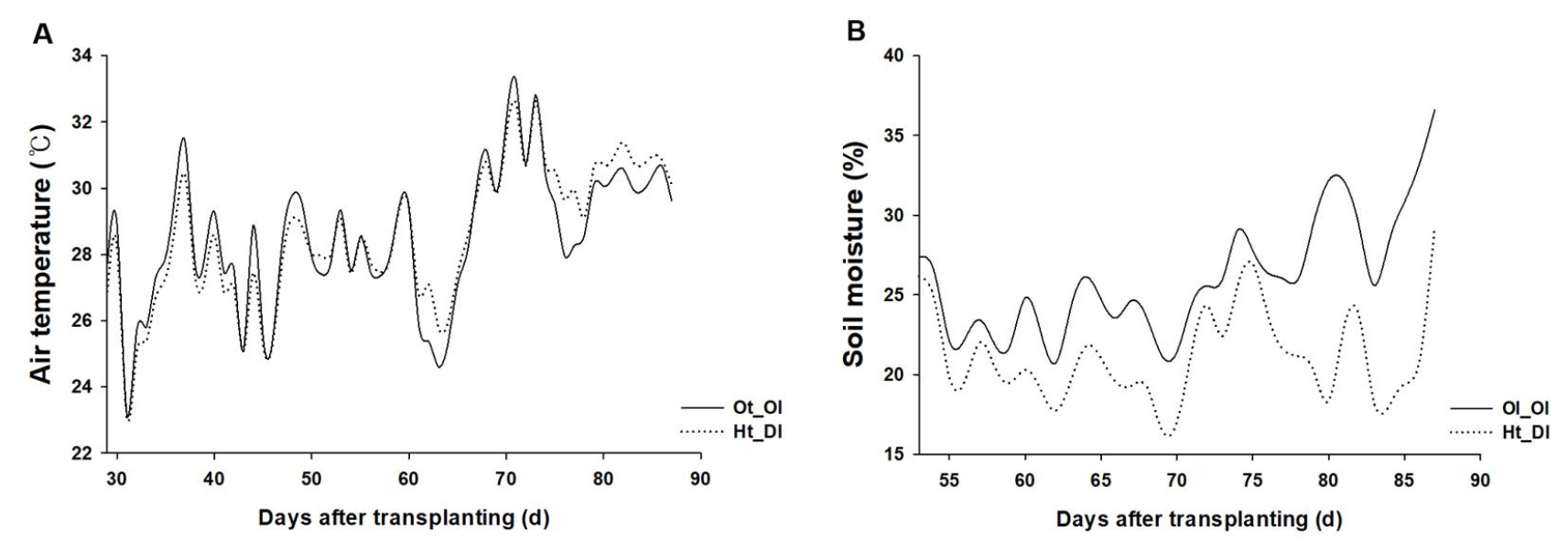
본 실험의 식물 재료로는 ‘수퍼마니따’ 고추(Capsicum annuum L. cv. Supermanita, Nongwoo Bio Co., Ltd., Korea)를 사용하였다. 2021년 3월 3일에 시판용 바이오상토 1호(Hungnong Seed Co., Korea)를 72구 육묘용 플러그트레이(50mL/셀)에 충전하고 종자를 1립씩 파종 후 평균기온이 25°C로 유지되는 온실에서 자연광 하에 62일간 육묘하였다. 5월 4일에 자동 측창 제어와 쿨링 시스템(Aircool, Paru, Korea)이 설치된 비가림하우스(40m × 8m)에 120cm × 45cm 간격으로 정식 하였고 8월 12일(정식 후 100일)까지 실험을 수행하였다. 정식 후 농촌진흥청 표준 영농재배법(RDA, 2016)에 준하여 관리하였으며, 점적호스를 이용하여 충분히 관수 하였다. 정식 후 14일부터 비가림하우스의 환기 팬과 쿨링 시스템을 28°C/(적온, Ot)와 31°C(고온, Ht)로 설정하였고, 생육 중기(정식 후 62일)에 관수량을 조절하여 토양 건조 조건을 구현하였다(Fig. 1). 정식 후 68일에 살리실산(salicylic acid, Sigma-aldrih, Darmstatd, Germany)을 100mg·L-1 농도로 주당 200mL를 4일 간격으로 3회 엽면살포하였고, 대조구는 물을 처리하였다. 재배기간 동안의 토양수분(S-SMx-M005, Oneset, USA), 일사량(S-LIA-M003, Oneset, USA), 기온과 상대습도(S-THB- M002, Onset, USA)는 데이터로거(H21-USB, Onset, USA)를 활용하여 1시간 간격으로 수집하였다.
2. 광합성 측정
광합성 특성은 광합성 측정기(LI-6400, LI-COR Inc., NE, USA)를 이용하여 살리실산 엽면살포 후 4일에 각 처리구당 6주를 대상으로 생장점에서 4번째 마디의 잎에서 측정하였다. 측정 조건은 기온 25°C, 상대습도 40-60%, 이산화탄소 농도 400μmol·mol-1, 광도(PPFD) 1,000μmol·m-2·s-1로 하였다.
3. 단백질 정량 및 malondialdehyde(MDA), H2O2 함량 분석
살리실산 경엽처리 4일 후에 생장점에서 4번째 마디의 시료를 혼합 채취한 후 액체질소를 사용하여 마쇄하였다. 각 시료 100mg에 1mL PBS(potassium phosphate buffer saline, pH 7.0)를 혼합하여 4°C, 13,000rpm에서 30분간 원심 분리 후 상등액을 추출하였다. 단백질은 Bio-rad protein assay(Bio-rad, USA) 시약을 이용하여 Bradford(1976) 방법으로 정량하였다. MDA와 H2O2 함량은 EZ-Lipid peroxidation(TBARS) assay kit(DoGenBio Co., Korea)와 EZ-Hydrogen Peroxide/ Peroxidase Assay Kit(DoGenBio Co., Korea)를 사용하여 각 제조사의 사용설명서에 의거하여 분석하였다(Lee 등, 2021).
4. 항산화효소 활성 분석
고추의 ascorbate peroxidase(APX), catalase(CAT), peroxidase(POD) 및 superoxide dismutase(SOD) 효소 활성은 각각 ascorbate peroxidase activity assay kit(Elabscience Biotechnology Inc., USA), Amplex® Red Catalase Assay Kit(Molecular Probes, USA), Amplex® Red Hydrogen Peroxide/Peroxidase Assay Kit(Molecular Probes, USA), SOD determination kit(Sigma-aldrich, USA)을 사용하여 각 제조사의 사용설명서에 의거하여 분석하였다(Lee 등, 2021).
5. 생육 및 수량 특성 조사
고추의 생육은 초장, 엽면적, 생체중, 건물중 등을 정식 100일 후에 조사하였고, 엽록소 함량은 엽록소함량 측정기(SPAD 502, Minolta Co., Ltd., Osaka, Japan)를 사용하여 SPAD 값을 측정하였다. 고추의 수량은 각 처리구당 36주를 대상으로 정식 후 72일부터 3일 간격으로 최종 생육조사 시점까지 과수, 과중을 누적하여 조사하였고, 병과, 열과 등 비정상 과실을 별도로 조사하였다. 소과의 기준은 과장 5cm 미만이었다.
6. 통계분석
실험구 배치는 난괴법 6반복으로 하였고, 통계분석은 SAS 프로그램(SAS 9.2, SAS Institute Inc., USA)을 이용하여 분산분석(ANOVA)을 실시하였다. 평균 간 비교는 Duncan의 다중검정을 이용하여 5% 유의수준에서 각 처리 간 유의성을 검증하고, 그래프는 SigmaPlot 프로그램(SigmaPlot 12.5, Systat Software Inc., USA)을 이용하여 나타냈다.
결과 및 고찰
1. 광합성 특성 변화
고추의 광합성 속도는 고온・건조 시 감소하는 경향을 보였으나 살리실산 처리 결과 무처리(Ht_DI) 대비 5.6-10.7% 증가하였고, 3회차 처리에서 증가 폭이 가장 컸다(Fig. 2A). 기공전도도, 세포 내 CO2 함량 및 증산속도는 1, 2회차 처리에서는 무처리구와 유사하였으나, 3회차에 각각 71.4, 6.0, 19.2% 유의하게 증가하였다(Fig. 2B-2D). 고온 스트레스는 작물의 광합성 속도를 감소시키고, 증산작용으로 잎 온도를 내리기 위해 기공전도도와 증산 속도를 높인다(Mittler와 Blumwald, 2010; Rajametov 등, 2021). 반면 토양수분이 부족하면 잎의 포텐셜이 낮아져 기공은 닫히게 되고 세포 내 이산화탄소가 정상적으로 공급되지 못하여 기공전도도와 세포내 CO2 농도가 감소한다(Ou 등, 2011; Shao 등, 2011; Widuri 등, 2020). 고추의 광합성 특성은 고온・건조 처리 시 전반적으로 감소하였는데(Fig. 2), 이는 건조가 고온보다 우세한 스트레스 요인으로서 고추와 토마토의 광합성 속도, 기공전도도 및 증산 속도가 감소하였다는 연구보고(Lee 등, 2017; Lee 등, 2018; Zhou 등, 2017)와 일치하였다. 환경 스트레스 조건에서 살리실산 처리 시 과채류 작물의 광합성 속도, 기공전도도 및 증산 속도가 증가하는 경향을 보였고(Jahan 등, 2019; Lobato 등, 2021; Otálora 등, 2020; Zhang 등, 2020), 높은 루비스코 활성과 카르복실화율을 유지하여 광합성 속도의 회복을 가속화함으로써 스트레스에 의한 피해를 완화시켰다(Aires 등, 2022; Wang 등, 2010). 따라서 고온・건조 조건에서 살리실산 처리 시 고추의 광합성 특성이 전반적으로 증가하였는데(Fig. 2), 이는 살리실산 처리가 고추의 광합성 효율을 효과적으로 향상시킨다는 것을 보여준다.
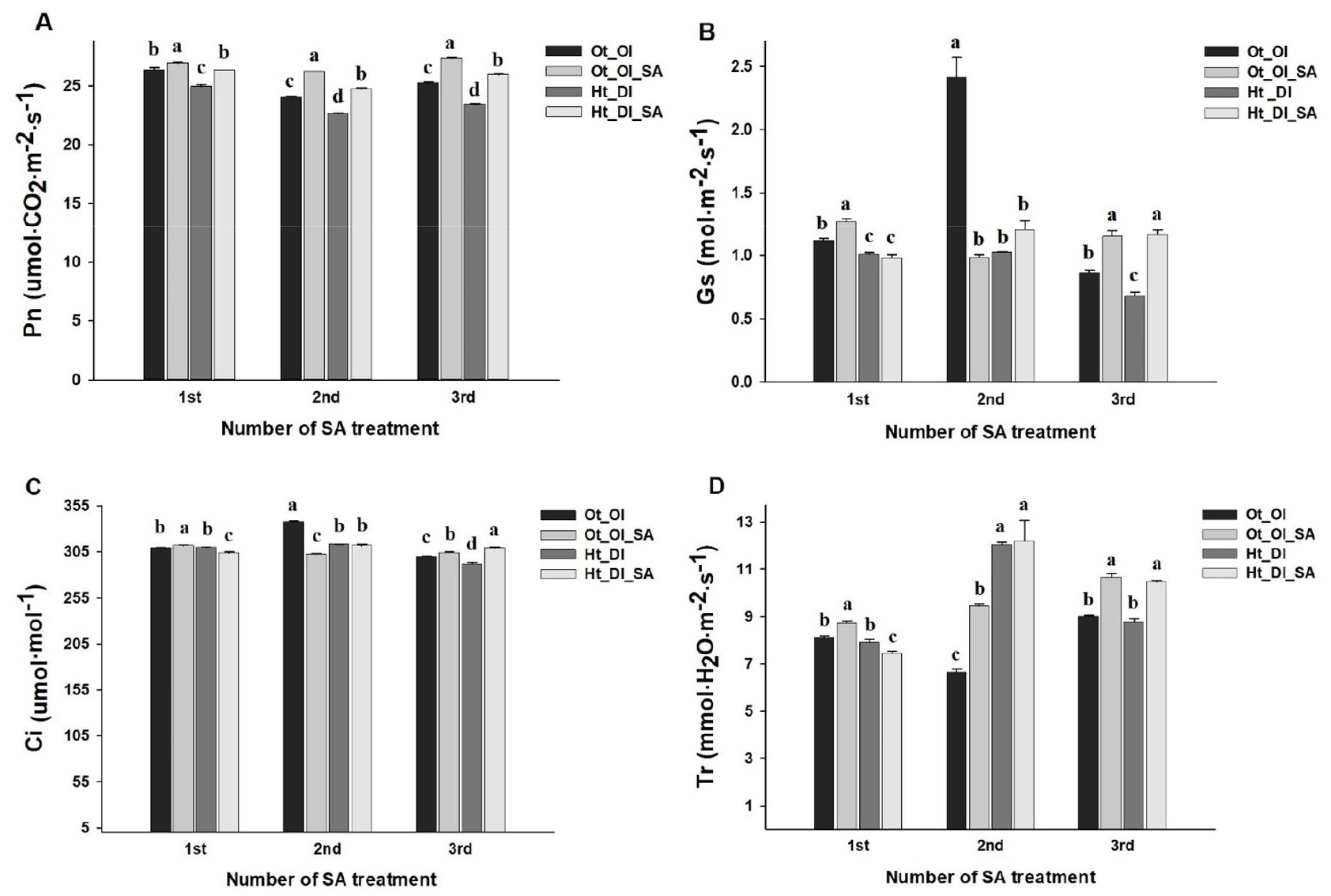
Fig. 2.
Comparison of photosynthetic rate (Pn, A), stomatal conductance (Gs, B), intracellular CO2 concentration (Ci, C), and transpiration rate (Tr, D) of chili pepper leaves as affected by treatment with salicylic acid (SA) under exposure to high-temperature and water deficient conditions. Vertical bars represent the standard error of means from six replications. Different letters indicate significant differences determined by Duncan’s multiple range test at p < 0.05.
2. MDA, H2O2 함량 변화
고온・건조 조건에서 살리실산 처리 시 고추의 MDA와 H2O2 함량이 전반적으로 감소하는 경향을 보였고, 3회차 처리에서 무처리 대비 16%, 8% 유의한 차이를 보이며 감소하였다(Fig. 3). 식물이 환경 변화에 의한 산화 스트레스를 받았을 때 세포 내 활성산소가 증가하게 되며, 증가한 활성산소는 세포막 구성 지질 분자의 과산화 반응을 유도하여 세포막 파괴가 일어나고, 세포 내용물의 누출로 인해 세포 손상이 더욱 가속화된다(Dhindsa 등, 1981). 이러한 산화적 스트레스에 의한 지질과산화의 피해는 MDA 함량으로 확인할 수 있다(Chomkitichai 등, 2014). 고온 또는 건조 시 살리실산 처리는 고추, 토마토, 오이 등 과채류의 MDA와 세포 내 H2O2 함량을 감소시켜 산화 스트레스를 완화시켰다(Jahan 등, 2019; Kaya, 2021; Lobato 등, 2021; Mardani 등, 2012; Zhang 등, 2020). 또한 Fayez와 Bazaid(2014)에서는 건조와 염 혼합스트레스 조건에서 살리실산 처리 시 작물의 MDA 함량이 감소하고 산화 스트레스에 의한 피해가 완화되었다. 따라서 고온・건조 조건에서 살리실산 처리 시 고추의 MDA와 H2O2 함량이 감소하였고(Fig. 3), 이는 살리실산 경엽처리에 의해 고추의 산화 스트레스가 완화된 것으로 사료된다.
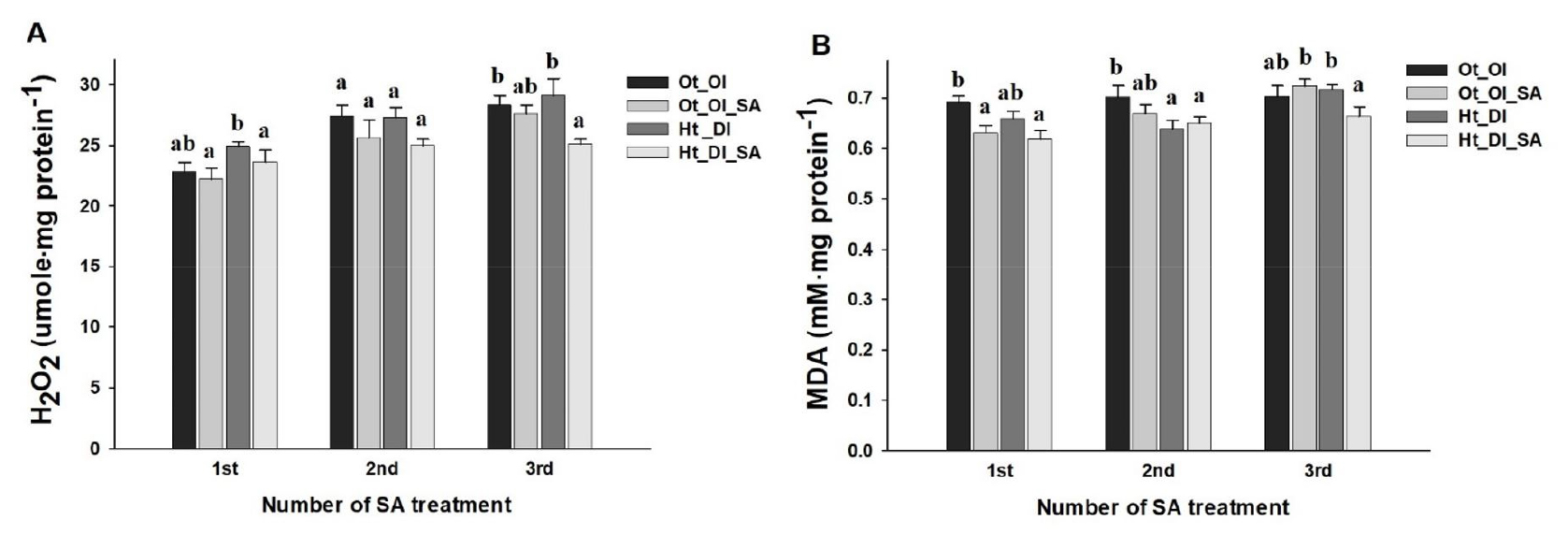
Fig. 3.
Measurement of H2O2 (A) and malondialdehyde (MDA, B) contents in chili pepper leaves as affected by treatment with salicylic acid (SA) under exposure to high-temperature and water deficient conditions. Vertical bars represent the standard error of means from six replications. Different letters indicate significant differences determined by Duncan’s multiple range test at p < 0.05.
3. 항산화효소 활성 변화
식물은 고온 및 건조 스트레스를 포함한 환경 스트레스 조건에 노출되면 과다한 활성 산소종의 증가에 의한 산화 스트레스가 유발되는데, 이에 본 연구에서는 살리실산 처리 조건에서 고추의 과산화수소 제거 관련 항산화효소 활성 변화를 조사하였다. 고온・건조 조건에서 고추의 APX, CAT, POD 및 SOD 활성은 전반적으로 증가하는 경향을 보였으며, 살리실산 처리 시 무처리 대비 최대 247, 318, 55 및 54% 증가하였다(Fig. 4). 특히, APX와 CAT 활성의 증가 폭이 컸으며, 2회차 처리 시 가장 높았다. 반면, 3회차 처리에서는 다소 증가하였으나 유의차가 인정되지 않았다(Fig. 4A, 4B). SOD는 superoxide anion radical(O2-) 제거 작용(2O2 + 2H → H2O2 +O2)을 하는 효소로써 활성산소종에 대한 1차적 방어 작용을 하는 대표적 활성 저해제이다(Bannister 등, 1987). APX, CAT 및 POD는 환경 스트레스 조건 시 활성이 증가된 SOD에 의해 생성되는 과산화수소를 물 분자와 산소 분자로(2H2O2 → O2 + 2H2O) 분해함으로써 과다한 활성 산소종에 의한 피해를 감소시키는 것으로 알려져 있다(Kang 등, 1998). 이러한 항산화효소의 활성은, 스트레스를 받은 식물의 방어기작에서 활성산소종의 생산과 세포 해독 과정의 균형을 조절하여 단백질, 지질, DNA 및 세포에 대한 손상을 방지하는 살리실산의 역할을 확인할 수 있다(Chandrakar 등, 2016; Demidchik, 2015). 고온 또는 건조 조건에서 살리실산 처리 시 고추, 토마토, 오이 등 과채류의 항산화효소 활성이 전반적으로 증가하였고, 각 항산화효소 활성의 증가 정도가 다양하게 나타났다(Bahram, 2010; Jahan 등, 2019; Kaya, 2021; Lobato 등, 2021; Zhang 등, 2020). 본 연구결과, 살리실산 처리는 고추의 고온・건조에 의한 산화 스트레스를 완화시키기 위해 항산화효소 활성을 증가시킨 것으로 판단된다. 한편, Zhang 등(2020)에 의하면 살리실산 처리 후 항산화효소 활성은 지속적으로 증가하여 3일차에 가장 높았고, 시간이 경과함에 따라 감소한다고 보고되었다. 본 연구에서는 살리실산을 4일 간격으로 3회 엽면살포하였고, 2회차 처리에서 가장 높은 항산화효소 활성을 보였다(Fig. 4). 이에 살리실산의 중복처리가 단일 처리보다 효율적이라 예상되며, 살리실산 처리 횟수와 간격에 따른 스트레스 피해 경감 효과 연구가 필요하다고 사료된다.
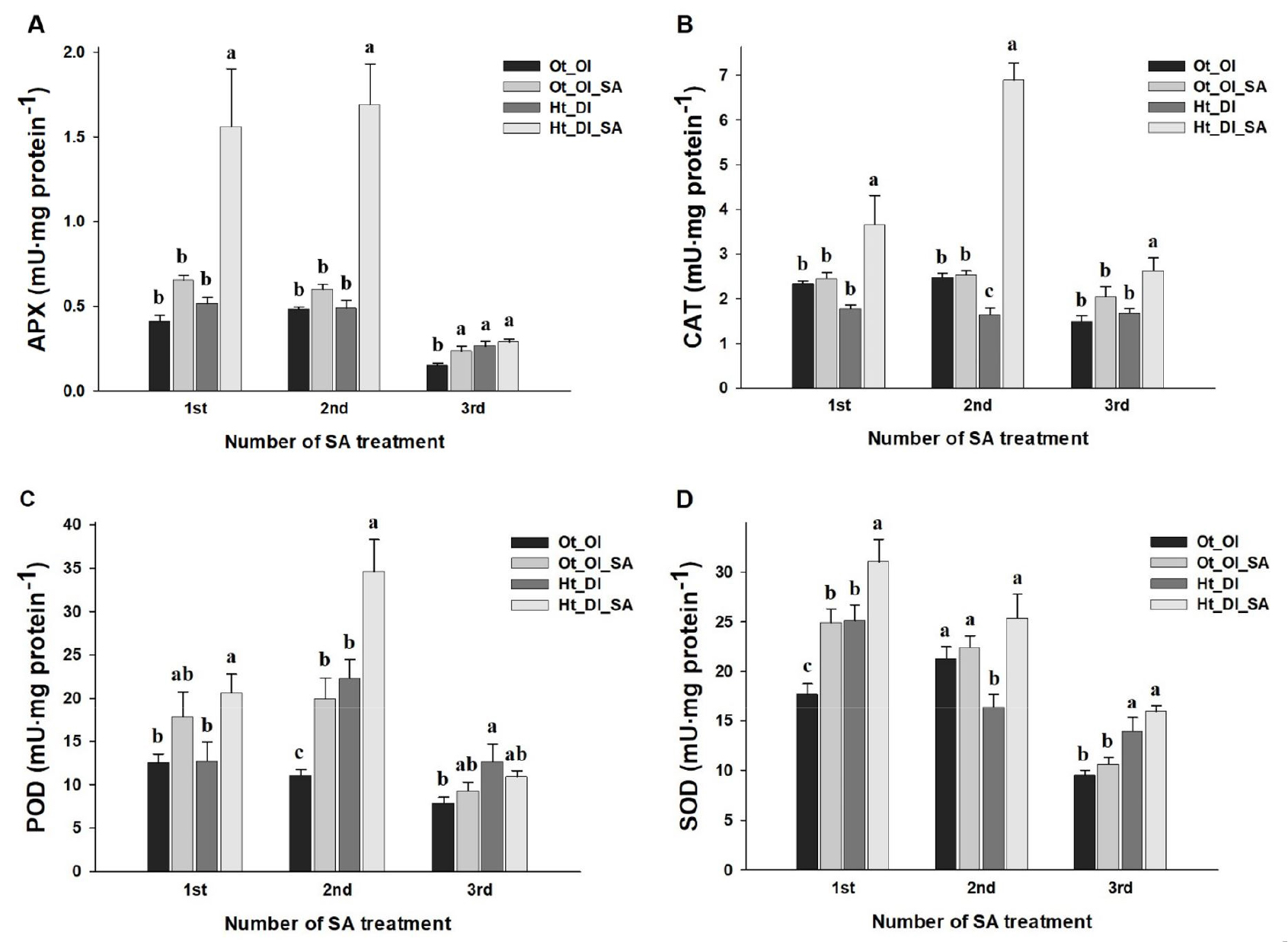
Fig. 4.
Comparison of ascorbate peroxidase (APX, A) catalase (CAT, B), peroxidase (POD, C), and superoxide dismutase (SOD, D) activity levels in chili pepper leaves as affected by treatment with salicylic acid (SA) under exposure to high-temperature and water deficient conditions. Vertical bars represent the standard error of means from six replications. Different letters indicate significant differences determined by Duncan’s multiple range test at p < 0.05.
4. 생육 및 수량 변화
고온・건조 조건에서 살리실산 엽면살포 후 고추의 생육과 수량 특성을 조사하였다(Table 1과 Table 2). 살리실산 처리 시 고추의 초장, 분지수, 엽면적, SPAD, 생체중, 및 건물중은 각 처리 간 통계적인 차이를 보이지 않았다. 반면에 주당 수확 과수, 과중 및 수량은 무처리 대비 증가하는 경향을 보였고, 상품 수량은 3,260kg/주로 무처리 2,844kg/주에 비해 15% 정도 증가하였다. 고온・건조 조건에서 고추의 수량 특성은 온도보다는 토양수분 함량에 의한 영향이 크고(Lee 등, 2018), 토양의 함수량이 낮아질수록 상품 과수와 중량이 감소하였다(Abayomi 등, 2012). 한편, 스트레스 조건에서 살리실산 처리에 의한 고추의 수량 변화에 대한 연구는 미흡하지만, 일반 환경 조건에서는 수량이 10-20% 정도 증가한다는 연구가 보고되었다(Dobón-Suárez 등, 2021; Elwan과 El-Hamahmy, 2009). 고온・건조 조건에서 살리실산 처리 시 고추의 상품 수량이 증가하였고(Table 2), 이는 살리실산의 경엽처리가 고추의 산화 스트레스에 의한 수량 감소를 경감시킨다는 것을 보여주었다.
Table 1.
Growth of chili pepper as affected by foliar application of salicylic acid (SA) and exposure to high-temperature and water deficient conditions at 100 days after transplanting.
| Temperaturez |
Soil moisturey |
Foliar application |
Plant height (cm) | No. of branches |
Leaf area (cm2/plant) |
Chlorophyll (SPAD) |
Fresh weight (g/plant) |
Dry weight (g/plant) |
| Ot | OI | H2O | 175.1 ax | 18.0 a | 23,503 a | 70.3 a | 1,270.9 a | 276.5 a |
| SA 100 mg·L-1 | 181.0 a | 19.3 a | 22,921 a | 70.3 a | 1,248.5 a | 272.5 a | ||
| Ht | DI | H2O | 173.6 a | 18.3 a | 20,074 a | 66.5 a | 1,084.1 a | 233.1 a |
| SA 100 mg·L-1 | 164.6 a | 18.2 a | 20,143 a | 69.2 a | 1,060.6 a | 225.4 a |
Table 2.
Fruits weight and marketable yield of chili pepper as affected by foliar application of salicylic acid (SA) and exposure to high-temperature and water deficient conditions.
| Temperaturez |
Soil moisturey |
Foliar application |
No. of fruits per plant |
Fruit weight (g/plant) |
Yieldx (kg/10a) |
Marketable ratew (%) |
Marketable yield (kg/10a) | Yield index |
| Ot | OI | H2O | 265.3 av | 2,492 a | 4,360 a | 85.6 | 3,732 | 100 |
| SA 100 mg·L-1 | 268.5 a | 2,486 a | 4,350 a | 87.6 | 3,810 | 102 | ||
| Ht | DI | H2O | 217.9 c | 1,855 c | 3,247 c | 87.6 | 2,844 | 76 |
| SA 100 mg·L-1 | 241.8 b | 2,136 b | 3,739 b | 87.2 | 3,260 | 87 |
따라서, 고온・건조 조건에서 살리실산의 경엽처리는 고추의 광합성능력을 향상시키고, 세포내 과산화수소와 이에 의한 세포 손상을 감소시켰다. 또한 항산화효소의 활성을 증가시킴으로써 산화 스트레스를 완화시켰으며, 결과적으로 고추의 수량을 증가시켰다. 이 결과로 살리실산 처리가 고추의 생리적 활성을 증대하여 스트레스에 의한 피해를 완화시킨다고 사료되며, 이상기상에 대응하는 피해경감 기술로 활용될 수 있을 것이라 기대된다.