서 론
재료 및 방법
1. 재배 및 재배 환경
2. 실험 처리
3. 측정항목과 측정방법
4. 수질분석
5. 식물체 분석
6. 통계
결과 및 고찰
1. 사육수 수온, pH, 및 EC 변화
2. 사육수 무기이온 농도 변화
3. 식물생육
4. 잎의 무기이온 함량 변화
서 론
세계 인구는 지속해서 증가추세에 있고 그에 따른 식량 수요는 계속 증가하고 있다(Harris, 2001). 현재까지의 농업은 단위 면적당 생산성을 극대화하기 위해 많은 양의 비료와 농약을 사용해 작물을 재배해 왔다. 이러한 생산 활동은 토지와 수질오염, 이산화탄소 배출 증가의 문제가 크게 심화 되었고, 소비자에게는 식품의 안전성 문제가 심각하게 인식되었다(Yoon, 2009). 따라서 도시화 및 세계화로 인한 가용 토지 감소, 천연자원의 고갈, 지속 가능한 식량 생산에 대한 종합적인 해결책이 필요하다(Tilman 등, 2002). 따라서, 증가하는 식량 수요를 충족시키고 식품의 신선도와 안전성을 확보하면서 환경친화적인 농업기술이 필요하다. 아쿠아포닉스(Aquaponics)는 물고기 사육 수조의 영양분이 식물재배에 필요한 영양소를 공급함으로써 양어(Aquaculture)와 수경(Hydroponics)이 통합된 재배 방식으로 자연 생태계와 흡사한 영양 순환 시스템이며(Francis 등, 2003), 지속 가능한 농업 시스템의 하나이다(Lehman 등, 1993). 기존의 식품 생산 시스템보다 질소 배출량과 물의 양을 줄이고, 농약과 비료를 사용하지 않아 환경오염을 감소시키고, 유기재배 상품으로써 부가가치를 가진 식물을 생산할 수 있다(Rakocy 등, 2006).
식물 성장에 필요한 16개의 필수영양소 중 수소(H), 산소(O) 및 탄소(C)로 공기와 물을 통해 공급되고, 인(Phosphorus, P), 칼륨(Potassium, K), 칼슘(Calcium, Ca), 마그네슘(Magnesium, Mg), 황(Sulphur, S) 붕소(Boron, B), 구리(Copper, Cu), 철(Iron, Fe), 염소(Chloride, Cl), 망간(Manganese, Mn), 몰리브덴(Molybdenum, Mo), 아연(zinc, Zn), 니켈(Nikel, Ni)은 토양용액에서 식물의 뿌리를 통해 흡수된다(Epstein과 Bloom, 2005). 토양과 달리 아쿠아포닉 시스템에서는 공급된 사료를 어류가 섭취하여 소화와 대사과정을 통해 배출한 배설물(아가미 배설, 소변 및 대변)이 용해되고, 미생물이 배설물을 가용화하여 식물이 흡수 가능한 영양분 형태로 만든다. 어류 사육수 및 식물의 뿌리에 위치한 박테리아, 고세균, 곰팡이, 원생동물 등과 같은 미생물 군집들의 탈질 및 무기질화 과정은 어류를 건강하게 성장시킬 수 있는 수질의 안정화와 식물체로의 영양공급에 중요한 역할을 한다(Goddek 등, 2016; Munguia-Fragozo 등, 2015; Joyce 등, 2019; Bittsanszky 등, 2016). 어류를 통해 배설된 소변과 아가미 배설물에 의해 생성된 독성이 있는 암모니아(NH4+)가 질산화균에 의해 질산염(NO3-)으로 산화되는 중간 단계에서 Nitrosomonas와 Nitrosococcus속에 속하는 암모니아산화균에 의해 NH4+에서 NO2-로 전환되고 Nitrobacter와 Nirospira속의 아질산산화균에 의해 NO2-에서 NO3-로 전환된다(Graber와 Junge, 2009; Zou 등, 2016). 아쿠아포닉스에서 NO3- 외에 K, Fe, Ca 및 P 농도는 식물 생육에 충분하지 않아(Goddek 등, 2015; Rakocy 등, 2004; Rakocy 등, 2006; Savidov 등) 수확량과 품질이 낮다고 하였다(Yang과 Kim, 2019). 아쿠아포닉스 시스템 내 영양분은 어류 체중을 높이기 위한 사료로만 공급된 결과이기 때문에 식물생육에 필요한 영양분과 부합되지 않을 수 있으므로 효율적으로 관리하여 아쿠아시스템 내 영양분 이용효율을 향상시켜야 한다고 하였다(Yang과 Kim, 2019). 아쿠아포닉스의 영양분 농도는 기존의 수경 시스템보다 낮지만, 앞선 연구에서 두 시스템은 비슷한 수준의 생산성이 보고 되었다(Nozzi 등, 2018). Tyson (2007)은 물고기 밀도가 높아지고 공급 속도가 늘어나면서 많은 양의 영양소가 제공되어 지속가능성을 높일 수 있다 하였고, Pineda 등(2017)는 물고기 종류, 밀도, 재배 식물의 종류에 따라 사육수 내 영양소의 농도, 식물체 내 무기이온 함량 및 식물 성장에 미치는 영향과 같은 생산에 영향을 미치는 다양한 요인을 연구하는 것이 필요하다고 하였다. 아쿠아포닉스 시스템으로 재배 중인 작물의 영양분 농도와 양어 사육수 내 영양분 농도를 알면 최적의 식물 생육 요구 사항에 부합하는 데 필요한 영양소 첨가를 예측할 수 있다고 하였다(Goddek 등, 2015).
따라서 본 연구는 아쿠아포닉스 시스템에서 고품질 채소 생산을 위한 기초 연구자료를 얻고자 하이드로볼 배지경 아쿠아포닉스에서 상추의 엽과 근권의 무기이온 함량 변화를 구명하고자 수행하였다.
재료 및 방법
1. 재배 및 재배 환경
실험 1은 스마트팜 온실 벤치에 설치한 간이 박막수경(NFT, Nutrient Film Technique, NFT) 재배기(KSP-1000, Gafatech Ltd., Gyunggi, Korea, 46×32×24cm)에 며칠간 받아 둔 수돗물을 15.0L를 채우고 24시간 동안 사육환경이 안정화 된 것을 확인 후 3W의 인공여과기(submersible filtration pump) (HJ-311B, Zhejiang Sensen Industry Co., Ltd, Zhoushan, China)를 장착하고 물고기를 투입하여 4일간 사육하였다. 식물 무처리구는, 하이드로볼(Greenstar 300G, Kellan Inc., Seoul., Korea) 200g을 네트포트에 넣고 식물 없이 아크릴(463mm(L)×325mm(W)×240mm(H)) 6구(∅7.8) 정식판에 넣었다. 식물재배 처리구는 로메인 상추(Lactuca sativa L.) 종자를 버미큐라이트(vermiculite)에 파종하여 본엽 3~4장 자란 모종을 하이드로볼이 담긴 네트포트에 정식하였다.
실험 2는 간이 박막수경 재배기의 상단 재배조에 하이드로볼(Saengtoeball, Saengtoewon, Jinju, Korea) 8.0kg을 채우고 흑백 필름으로 덮었으며, 하단 사육조에는 18W 에어 펌프(SWT-20, LSK TECH, Busan, Korea)에 연결된 호스를 코너 스펀지 필터(SF-290, Amazon, China) 2개를 연결하여 설치하였다. 실험 2에 사용한 사육수는 실험 70일 전 물고기를 사육한 후 그 물의 50%와 며칠간 받아 둔 수돗물 50%를 섞어 사육 탱크에 준비하였고 물고기를 입어 후 10일간 사육한 후 식물을 정식 하였다. 상추(Lactuca sativa L. ‘Crispinet’) 종자는 파종 스펀지(3×3cm)에 파종한 후 본엽 3~4장 자란 모종을 하이드로볼에 정식하였다. 백색 LED 광도가 식물 높이에서 140μmol·m-2·s-1(ZVAS-02-0300, Sunghyun Hightech Co. Ltd, Hwaseong, Korea)으로 조절된 벤치에 수조를 배치하여 재배하였다. 모든 실험 기간 증발로 인해 손실된 물 보충은 24시간 이상 받아 둔 수돗물로 주 1회 증발량을 측정 후 보충되었다.
본 실험에 사용된 물고기는 크기가 3~4cm, 평균 어체중은 5.77±2g인 잉어목, 잉어과 금붕어계 열대어 진주린(Carassius auratus)을 도매상에서 구입하여 사료(Premium 1C, Woosung Inc., Seoul, Korea)를 1일 2회 어체중의 1%를 공급하면서 사육하였다. 사료 성분은 수분 8.8% 이하, 조단백질 47.21%, 조지방 6.82%, 조섬유 1.21%, 조회분 10.93%, Ca 2.62%, P 1.91%, Mg 0.22%, K 0.08%, Fe 0.04%이며 동물성 단백질류(어분, 어즙흡착사료) 배합비율은 64% 이상, 식물성 단백질류(대두박, 옥수수글루텐) 20% 이상, 곡류(소백분) 10% 이하, 보조사료(비타민(C, E), 염화콜린, 유화제) 5% 이하, 유지류(어유) 1.0% 이상으로 구성되었다.
2. 실험 처리
실험 1은 간이 NFT 시스템에 여과기를 장착한 후 물고기 12마리 사육한 처리구(F12)와 여과기 없이 하이드로볼 배지를 장착하고 물고기 12마리를 재배한 처리구(H12), 과기를 장착하고 하이드로볼에 본엽 3~4장 자란 상추 모종 6주를 심고 물고기 12마리를 재배한 처리구(FHP12)와 여과기 없이 하이드로볼에 상추 6주를 심고 물고기 12마리를 재배한 처리구(HP12)로 설정하였다. 실험 2는 간이 NFT에 여과기를 장착하고 하이드로볼을 장착한 후 식물 없이 물고기 15마리 사육한 처리구(FH15)와 여과기를 장착하고 하이드로볼에 본엽 3~4장 자란 상추 6주를 심고 물고기 15마리를 사육한 처리구(FHP15)로 설정하였다(Fig. 1).
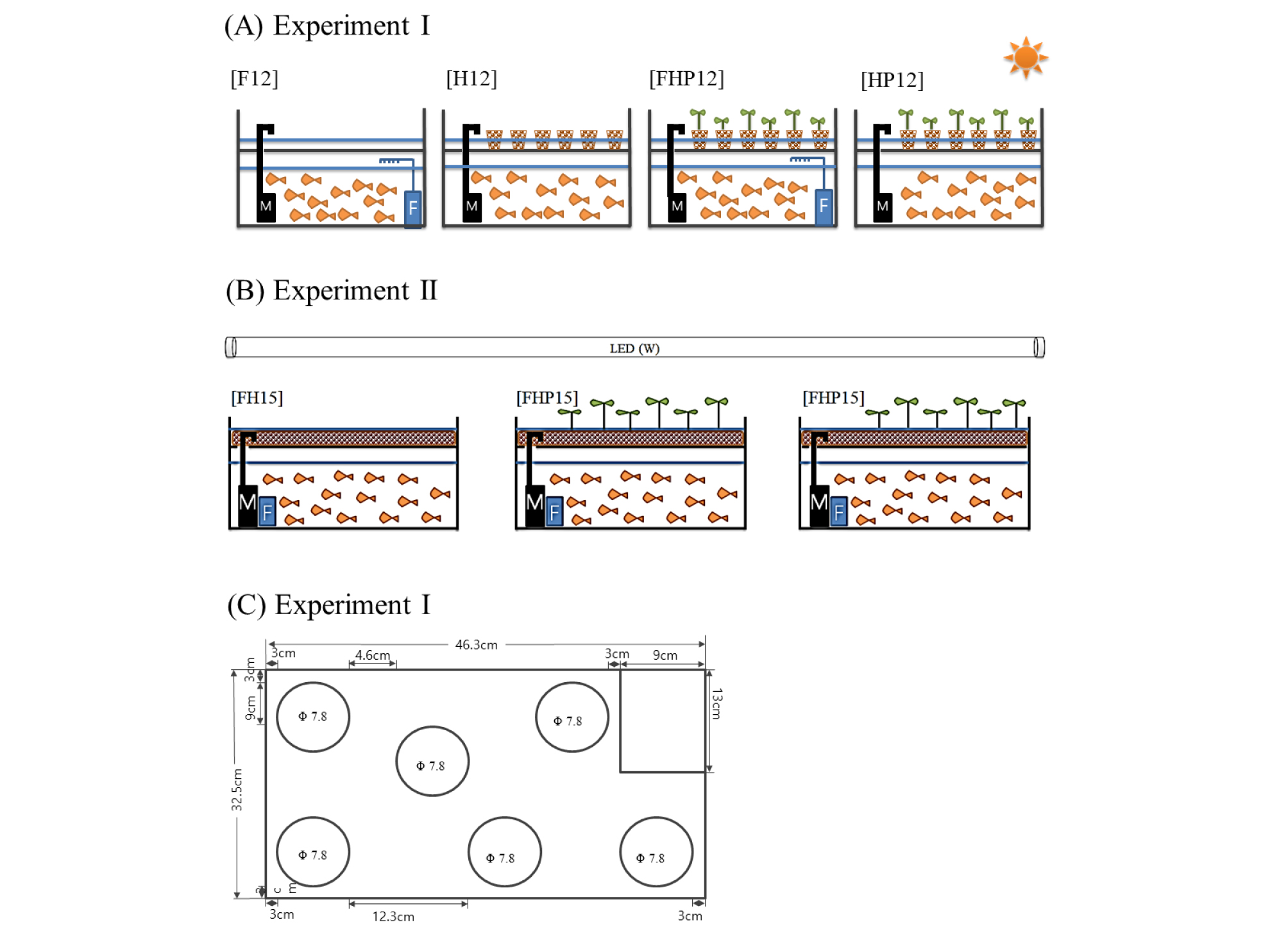
Fig. 1.
Diagrams of experimental treatments; (A) Experiment I with F12 (12 fishes, filter, no hydroball, no plant), H12 (12 fishes, no filter, hydroball, no plant), FHP12 (12 fishes, filter, hydroball, 6 plants) and HP12 (12 fishes, no filter, hydroball, 6 plants); (B) Experiment II with FH15 (15 fishes, filter, hydroball, no plants), FHP15 (15 fishes, filter, hydroball, 6 plants); (C) Small-scale NFT (Nutrient Film Technique) system.
3. 측정항목과 측정방법
실험 1은 정식 전과 최종 수확일에 실험 2는 정식일과 14일 간격으로 엽장, 엽폭, 엽수, 뿌리 길이, 생체중, 건물중을 측정하였다. 생체중은 수확 후 지상부와 지하부로 분리하여 전자저울(HS410A, Yousheng, Shanghai, China)로 측정하였고, 생체중 측정 후 건물중은 65℃ 건조기(HB-504F-0, Hanbaek Science Inc., Bucheon, Korea)에 72시간 동안 건조 후 무게를 측정하였다. 지상부 지하부 건물중을 이용해 상대생장율 (RGR=(lnW2-lnW1)/(t2-t1))을 측정하였다.
4. 수질분석
실험 1은 사육수의 pH, EC, 온도는 매일 1회 Multiparameter (PC Tester 35, Oakton, IL, USA)를 이용하여 측정하였으며, 용존산소량(DO, dissolved oxygen)은 수질측정키트(EZ Water Monitoring Test Kit, Ecosaver, Seoul, Korea)를 이용하여 정식 후 7일 간격으로 2회 반복 측정하였고, 질소(NH4- N, NO2-N, NO3-N), 인산(PO4-P), 칼륨(K+), 칼슘(Ca2+), 마그네슘(Mg2+)은 7일 간격으로 채취한 시료를 여과(No. 6)한 후 이온 크로마토그래프 1(Ion Chromatograph 1, Dionex, USA)를 사용하여 분석하였다.
실험 2의 사육수 pH, EC는 매일 1회 Multiparameter(PC Tester 35, Oakton, IL, USA)를 이용하였고, 온도는 Watchdog (3686WD, Spectrum Technologies, Inc., IL, USA)으로 30분간격으로 측정하였고, 무기성분(NH4-N, NO3-N, PO4-P, K+, Ca2+, Mg2+)은 무기이온 측정기(Auto CG200, Cleangrow, UK)로 1일 1회 주 6회 측정하였다.
5. 식물체 분석
질소는 건조된 식물체를 마쇄한 후 0.3g을 CN분석기(Variomax CN, ELEMENTAR, Germany)로 질소와 헬륨을 사용하여 1200°C의 고온에서 연소 후 컬럼을 통한 TCD 검출기로 질소 가스 피크를 정량분석하였다. P, Ca, K, Mg, Fe은 마쇄한 시료를 0.5g 취해 10 ml 질산을 넣고, microwave로 분해, 여과(No. 6)하여 ICP로 정량분석하였다.
6. 통계
각 처리마다 6 반복한 평균값으로 각 처리간의 통계적 유의성 검정은 SAS(Statistical Analysis System, V9.4, Cry, NC, USA)프로그램을 이용하여 분산분석하여 검증하였다.
결과 및 고찰
1. 사육수 수온, pH, 및 EC 변화
실험 1에서 사육수 일평균 수온은 26.1℃(±0.86)였고, 최저 23.5℃, 최고 29.2℃ 였으며(Fig. 2A), 실험 2의 사육수 일평균 수온은 22.1℃(±1.59)이고, 실험동안 16.4∼26.1℃ 수준으로 유지되었는데(Fig. 2B) 이는 물고기 성장에 적합한 온도(18∼30℃)와 질산화균 Nitrosomonas 성장의 최적온도(10∼30℃) 범위였다(Park, 2001). 실험 1의 경우 상추의 최고한계지온 보다는 약간 높았는데 이는 광이 풍부한 스마트 온실에서 진행한 결과이다.
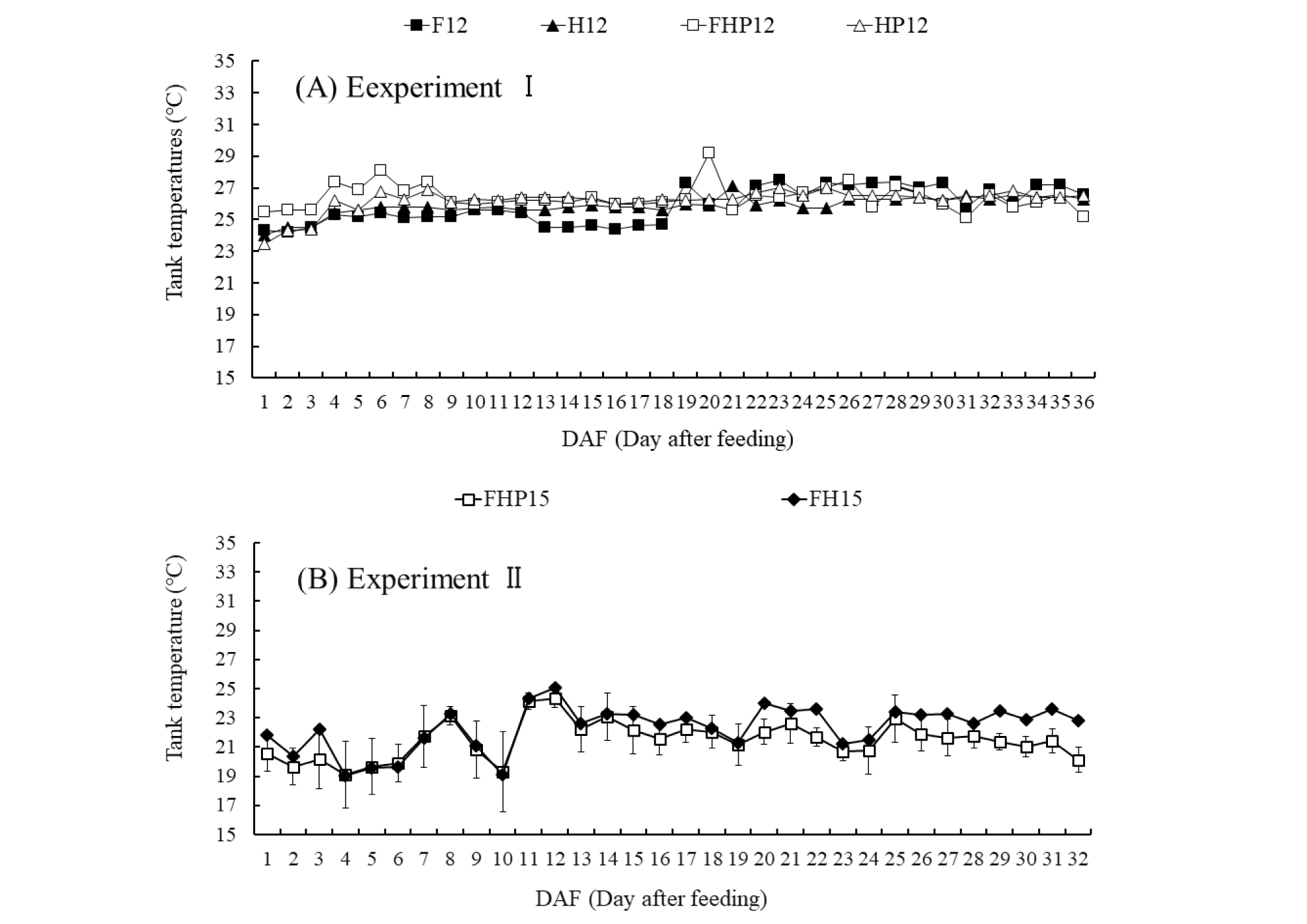
Fig. 2.
Changes of temperatures in the water under different treatments. (A) temperatures in the Expt. I; (B) averaged daily temperatures in Expt. II. Vertical bars indicate standard deviation of means (n=2). (A) Expt. I with F12 (12 fishes), H12 (12 fishes, hydroball), FHP12 (12 fishes, filter, hydroball, 6 plants) and HP12 (12 fishes, hydroball, 6 plants); (B) Expt. II with FH15 (15 fishes, filter, hydroball), FHP15 (15 fishes, filter, hydroball, 6 plants).
실험 1과 2의 모든 처리구에서 실험 동안 사육수 pH가 낮아지는 것을 알 수 있고(Fig. 3) 이 결과는 본 연구팀의 선행연구 결과와 일치된다(Choi 등, 2019). 실험 1에서 실험 동안 pH는 9.0에서 6.0 수준으로 떨어졌고 실험 2에서는 실험 70일 전 물고기를 사육한 후 그 물의 50%와 며칠간 받아 둔 수돗물 50%를 섞어 물고기를 입어하여 10일간 사육한 후 식물을 정식 하였기 때문에 pH가 정식 후 6.0에서 5.0 수준으로 변화되었다. 실험 1에서 필터+하이드로볼+식물 처리구(FHP12)에서 필터(F12) 또는 하이드로볼(H12)만 장착된 처리구보다 더 빠르게 pH가 낮아졌다(Fig. 3A). 실험 2에서는 식물 무재배구(FH15)와 재배구(FHP15) 간의 큰 유의차는 없었다. 아쿠아포닉스에서 질산화 박테리아 활동을 위해 순환되는 물의 적정 pH는 7.5~9.0 수준인 것으로 알려져 있는데(Hochheimer와 Wheaton, 1998) 물고기 숫자가 많아짐에 따라 pH가 적정 수준 이하로 유지된 이유는 다량의 물고기 배출물이 함유한 유기태질소가 질산화균에 의해 질산태질소로 전환되는 과정에 H+를 다량 방출하게 된 것과 관련이 있는 것으로 보인다(Schreier 등, 2010). 또한, 상추가 암모니아태질소(NH4-N)를 흡수하는 경우 근권의 pH를 낮추게 되는 것과 관련이 있다(Marschner, 1995).
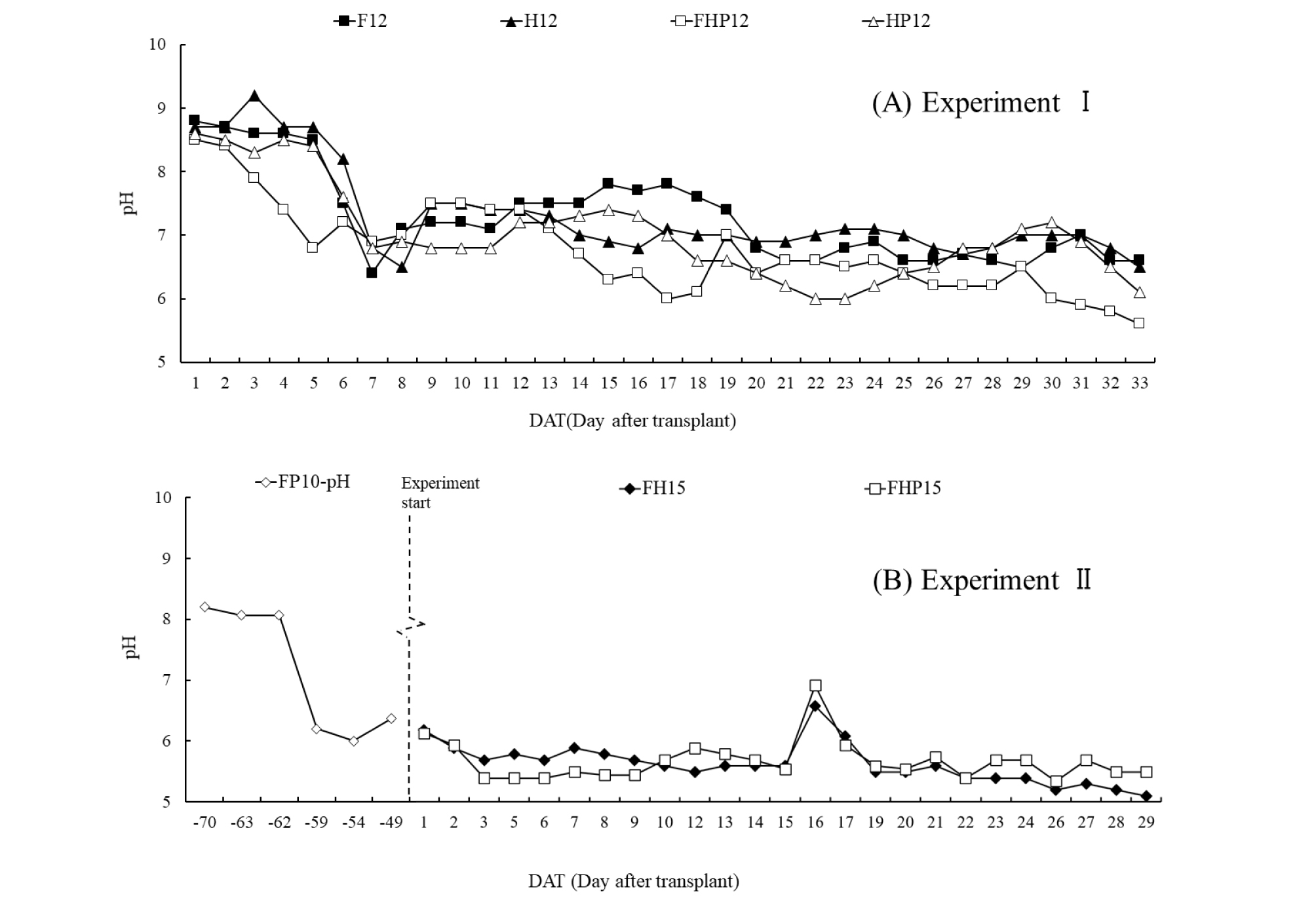
Fig. 3.
Changes of pH in the water under different treatments. (A) Expt. I; (B) Expt. II. Vertical bars indicate standard deviation of means (n=2). (A) Expt. I with F12 (12 fishes), H12 (12 fishes, hydroball), FHP12 (12 fishes, filter, hydroball, 6 plants) and HP12 (12 fishes, hydroball, 6 plants); (B) Expt. II with FH15 (15 fishes, filter, hydroball), FHP15 (15 fishes, filter, hydroball, 6 plants).
사육수 EC(Electrical conductivity)는 사육수 물량을 보정하는 시점에 잠시 낮아지는 것 외에는 실험 1에서는 약 3배(400∼1200μS·cm-1) 실험 2는 약 2배(600~1200μS·cm-1)까지 증가되었다(Fig. 4). 실험 1에서 사육수 EC는 필터만 장착한 처리구(F12)에서 하이드로볼만 장착한 처리구(H12)보다 높았는데 이는 하이드로볼보다 인공여과기 필터에 더 많은 미생물이 군집되어 나타난 결과로 보인다. 박테리아는 자갈, 경석, 플라스틱과 같은 서식하기 위한 표면이 필요한데(Thorarinsdottir, 2015), 필터와 하이드로볼은 물고기 배설물을 변환하는 박테리아 서식지를 제공하고(Somerville 등, 2014), 배지를 활용하는 아쿠아포닉스가 NFT 방식이나 Floating Raft 방식보다 배지가 미생물에 더 많은 표면적을 제공하여(Lennard와 Leonard, 2006) 질소를 활용하는 측면에서 효율이 높다고 하였다. 실험 1에서 사육수 EC는 하이드로볼+식물 처리구(HP12)에서 1,100μS·cm-1로 가장 낮았고 실험 2에서도 필터+하이드로볼+식물 처리구(FHP15)에서 1,027μS·cm-1로 가장 낮아 식물이 수질 내 이온화된 영양분을 흡수한 결과로 보인다.
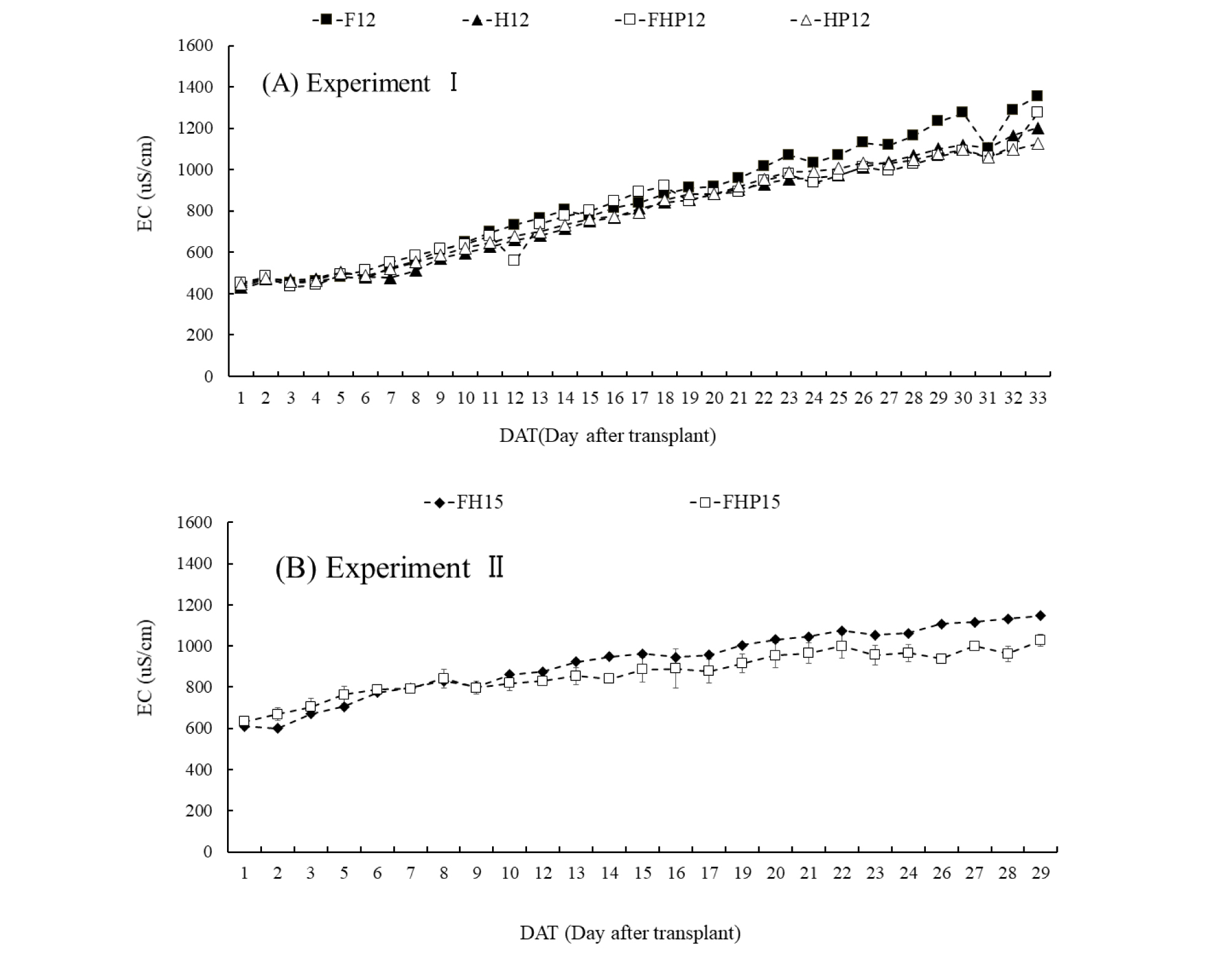
Fig. 4.
Changes of EC in the water under different treatments. (A) Expt. I; (B) Expt. II. Vertical bars indicate standard deviation of means (n=2). (A) Expt. I with F12 (12 fishes), H12 (12 fishes, hydroball), FHP12 (12 fishes, filter, hydroball, 6 plants) and HP12 (12 fishes, hydroball, 6 plants); (B) Expt. II with FH15 (15 fishes, filter, hydroball), FHP15 (15 fishes, filter, hydroball, 6 plants).
2. 사육수 무기이온 농도 변화
근권 내 무기이온 농도는 식물재배 여부와 필터 또는 하이드로볼만 장착한 조건에 따라 유의차를 보였다. 실험 1과 2 모두 K 이온만 식물 재배구에서 무재배구보다 급격히 감소되는 결과를 보여 물고기 사료 내 K이 0.08%이고 이를 흡수한 후 배출된 배설물로부터 용해된 영양분이 식물에 요구되는 양을 충족시키지 못하는 것을 알 수 있고 그 외 영양분은 지속해서 공급이 이루어지는 것으로 보인다.
실험 1에서 NH4-N는 모든 처리구에서 20.6~75.4mg·L-1범위로 지속해서 증가하였고 식물 재배구(FHP12, HP12)에서 무재배구(F12, H12)보다 약 20% 낮은 수준을 보였다(Fig. 5). 질산태질소(NO3-N)는 정식 후 12일까지 식물 재배구(FHP12, HP12)에서 빠르게 증가하였는데 사육수 pH가 식물 재배구에서 급격히 낮아진 결과와 일치되고 이 결과는 식물 뿌리에 서식하는 미생물 작용으로 인한 질산화 전환이 빠르게 이루어졌기 때문이라고 판단된다(Luis, 2019). NO3-N 농도가 하이드로볼만 장착한 처리구(H12)에서 필터만 장착한 처리구(F12)에 비해 천천히 증가한 결과는 사육수 EC가 하이드로볼만 장착한 처리구에서 필터만 장착한 처리보다 낮았던 결과와 일치되는데 이는 앞서 언급한 데로 하이드로볼보다 인공여과기 필터에 더 많은 미생물이 군집되어 나타난 결과로 보인다. 정식 33 DAT에 NO3-N 농도는 식물 재배 여부와 관계없이 모든 처리구에서 유사한 농도를 보여 질산태질소는 지속해서 공급된 것으로 판단된다. 하지만 K는 식물 재배구(FHP 12, HP12)에서 급격히 낮아져 식물 요구량 보다 수조에서 공급되는 양이 부족한 것으로 보이고 Ca은 하이드로볼만 장착된 처리구(H12)에서 가장 낮았는데 이는 하이드로볼이 가지는 양이온 교환 용량(47±8meq/100g)(Ho와 Wang, 2015) 때문으로 판단된다. PO4-P은 필터만 장착한 처리(F12)에서 매우 높았는데 이는 유일하게 하이드로볼이 없는 처리구이고 다른 하이드로볼 장착 처리구는 하이드로볼 배지에 인산이 흡착(Buhmann 등, 2015)되고 침전(Johansson-Westholm, 2006)된 결과로 보인다.
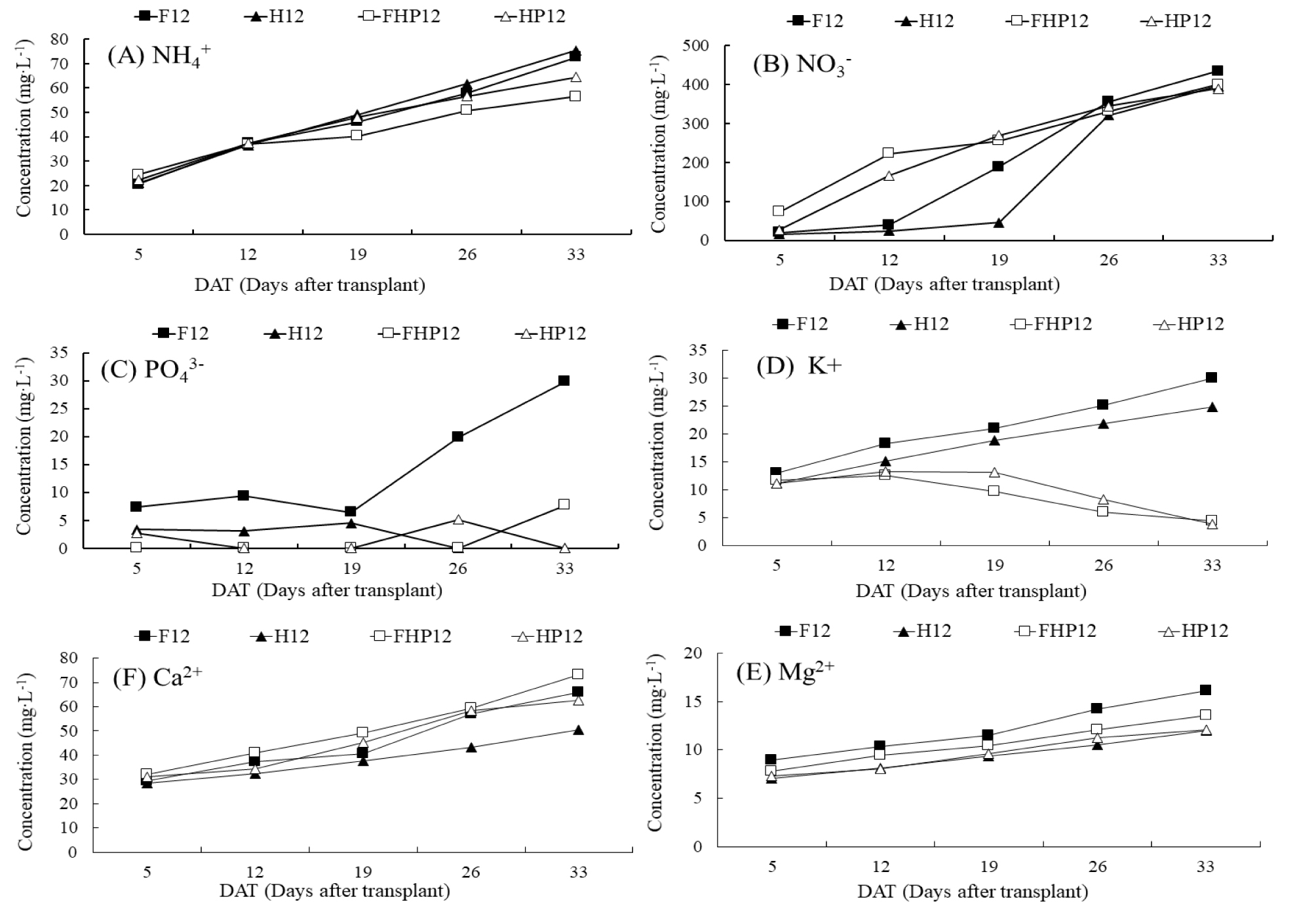
Fig. 5.
Changes of ammonium nitrogen (NH4-N), nitrate nitrogen (NO3-N) and phosphorus (PO4-P), potassium (K), calcium (Ca) and magnesium (Mg) concentrations in the water of the Expt. I with F12 (12 fishes), H12 (12 fishes, hydroball), FHP12 (12 fishes, filter, hydroball, 6 plants) and HP12 (12 fishes, hydroball, 6 plants).
실험 2에서도 K 이온만 식물 재배구에서 무재배구보다 급격히 감소되어 사육수 내 영양분이 식물에 요구되는 K 함량을 충족시키지 못한 것을 알 수 있다. NH4+-N는 10.76~21.45mg· L-1, NO3—N는 20~148.15mg·L-1범위로 측정되었다. K은 식물 재배구(FHP15)가 무재배구(FH15)에 비해 2/3수준으로 낮았고, Ca은 모든 처리구가 소폭 증가하였으며, Mg은 두 처리 모두가 실험 시작 시점 보다 약 2배 축적되었다. PO4-P은 지속적으로 증가하였지만, 정식 후 15~19일경 일시적으로 식물 재배구(FHP15)에서 무재배구보다 낮은 농도를 보였는데 이는 이 시기에 상추 생육이 빨라져 흡수가 급격히 일어난 것으로 보인다(Fig. 6).
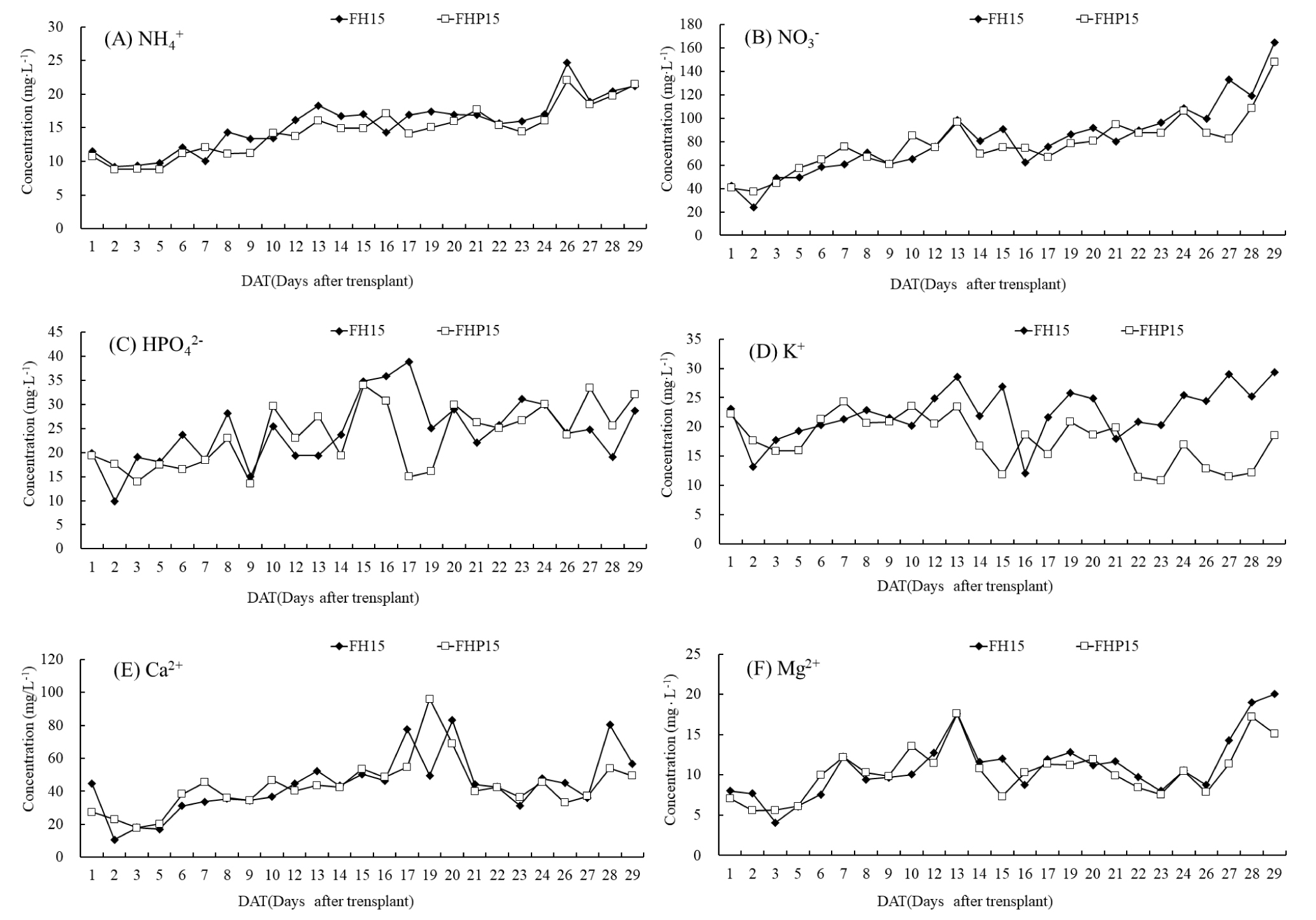
Fig. 6.
Changes of ammonium nitrogen (NH4-N), nitrate nitrogen (NO3-N), phosphorus (HPO4), potassium (K), calcium (Ca) and magnesium (Mg) concentrations in the water of the experiment II with FH15 (15 fishes, filter, hydroball), FHP15 (15 fishes, filter, hyroball, 6 plants). Vertical bars indicate standard deviation of means (n=2).
실험 2에서 관찰된 사육수 무기이온 농도와 앞서 발표된 기존 아쿠아포닉스 연구 결과에서 도출된 무기이온 농도를 수경재배 양액의 무기이온 표준 농도와 비교하였을 때 사육수 이온 농도가 낮은 것으로 나타났다(Table 1). Pineda 등 (2017) 연구에서 물고기 밀도가 20kg·m-3일 때 사육수 무기이온 함량을 수경재배 양액의 무기이온 표준 농도(Lee 등, 2015)와 비교하면 Mg을 제외한 모든 이온이 현저히 낮았고 특히, K이 매우 낮았다(Table 1, Reference II). Nozzi 등(2018) 연구에서도 물고기 밀도가 50kg·m-3일 때 Ca과 Mg을 제외한 모든 이온이 수경재배 양액의 무기이온 표준 농도보다 현저히 낮았다(Table 1, Reference I). Bittsanszky 등(2016) 연구에서도 아쿠아포닉스와 수경 시스템으로 토마토를 재배하였을 때 아쿠아포닉스 무기양분(Cu2+, SO42-, Ca2+를 제외하고) 농도가 수경재배의 양액 농도보다 현저히 낮았고 그 중 Fe 농도가 가장 낮았다고 발표하였다. 본 연구의 실험 2의 FHP15 처리구의 NO3-N과 P 농도는 수경재배 양액 농도보다 높았고 그 외 K는 수경양액농도의 16%, Ca은 49%, Mg은 82% 수준이었고 Fe 농도는 불검출 수준이었다. 이 결과는 앞서 발표된 연구 결과(Nozzi 등, 2018; Pineda 등, 2017)에서 제시된 사육수 농도보다는 높았는데 이는 실험 2의 FHP15 처리구 어류밀도를 1톤 단위로 환산하면 60kg·m-3이고 이는 다른 두 연구에서 처리한 밀도보다 높고 상추를 m2당 25포기 재배하여 나타난 결과로 보인다. 하지만 식물 생육에 필수영양소인 K, Ca, 및 Fe 농도가 수경재배 양액농도에 비해 현저히 낮았다.
Table 1.
Comparison of nutrients in the fish feed and fish growing water resulted from three different aquaponics experiments for lettuce cultivation.
z: Expt. II with FHP15 (15 fishes, filter, hyroball, 6 plants) at 29 DAT
y: data from Nozzi 등 (2018) at 33 DAT
x: data from Pineda 등 (2017) at 30 DAT
w: mean value for 2 replicates
v: data not shown in the reference
u: data from Lee 등 (2015)
3. 식물생육
수확한 식물체는 엽장, 엽폭, 엽수, 뿌리길이, 지상부와 지하부 생체중, 건물중 및 상대생장율을 측정하였다(Table 2). 실험 1에서 33 DAT에 측정된 생육은 뿌리길이를 제외하고 필터+하이드로볼+식물(FHP)와 하이드로볼+식물(HP) 두 처리는 유의차가 없었고 상대생장율(Relative growth rate, RGR)도 지상부는 0.07g·g-1·day-1, 지하부는 0.06g·g-1·day-1로 유사한 결과를 보였으며 실험 2에서는 10 DAT에 측정된 RGR보다 20 DAT에 측정된 RGR이 낮아 후반기에 생육이 둔화된 것으로 나타났다(Fig. 7). 실험 1과 2에서 수확된 상추 생체중은 일반 상품 상품성 중량(100g·plant-1)의 1/5(24g)과 1/3(38g) 수준이었는데 이는 본 실험에서 사육수 내 식물 생육에 필수영양소인 K, Ca, Fe 농도가 현저히 낮았던 것과 관련이 있다. 사육수의 무기이온의 농도는 물고기 밀도와 사료 내 영양소와 관련이 있는데 Pineda 등(2017)는 틸라피아 밀도를 10에서 25kg·m-3까지 높여 상추를 재배하였을 때 물고기 밀도가 증가할수록 상추 바이오메스는 증가하였지만 25kg·m-3 밀도에서는 더 증가하지 않았고, Pantanella 등(2010)는 아프리카메기 1.0kg·m-3에 상추 0.8m2(25 plants·m-2, 0.8m2 = 20 plants)를 재배하는 것이 적합하다고 하였다. Nozzi 등(2018)는 틸라피아를 재배하며 사료외 K, Fe, P, Mg, S 등 무기영양소를 첨가한 처리구와 무첨가 처리구를 비교하며 식물을 재배하였을 때 무첨가된 처리구에서 느린 성장을 보이며 낮은 생체중의 결과를 보였지만 사료외에 무기영양소를 첨가한 처리구에선 수경재배(313g)보다 아쿠아포닉스(340g) 생체중이 증가되고 생산성이 향상되었다고 하였다. 이 결과는 K는 뿌리 발달을 촉진하여 식물\의 크기와 품질에 중요한 역할을 하고, Fe는 광합성과 호흡에 중요한 요소로(Rincon, 2008; Pineda 등, 2017) 상추 생육에 큰 영향을 준 것으로 판단된다. Rakocy(2006); Cerozi와 Fitzsimmons(2017)는 아쿠아포닉스에서 식물에 필요한 필수영양소는 물고기 배설물에 존재하지만, 일부 부족한 영양소, 특히 Ca, K 및 Fe은 식물 생육을 저해할 수 있다고 보고하였다.
Table 2.
The length and width of leaf, leaf number, root length and fresh and dry weights of shoot and root at each experiment.
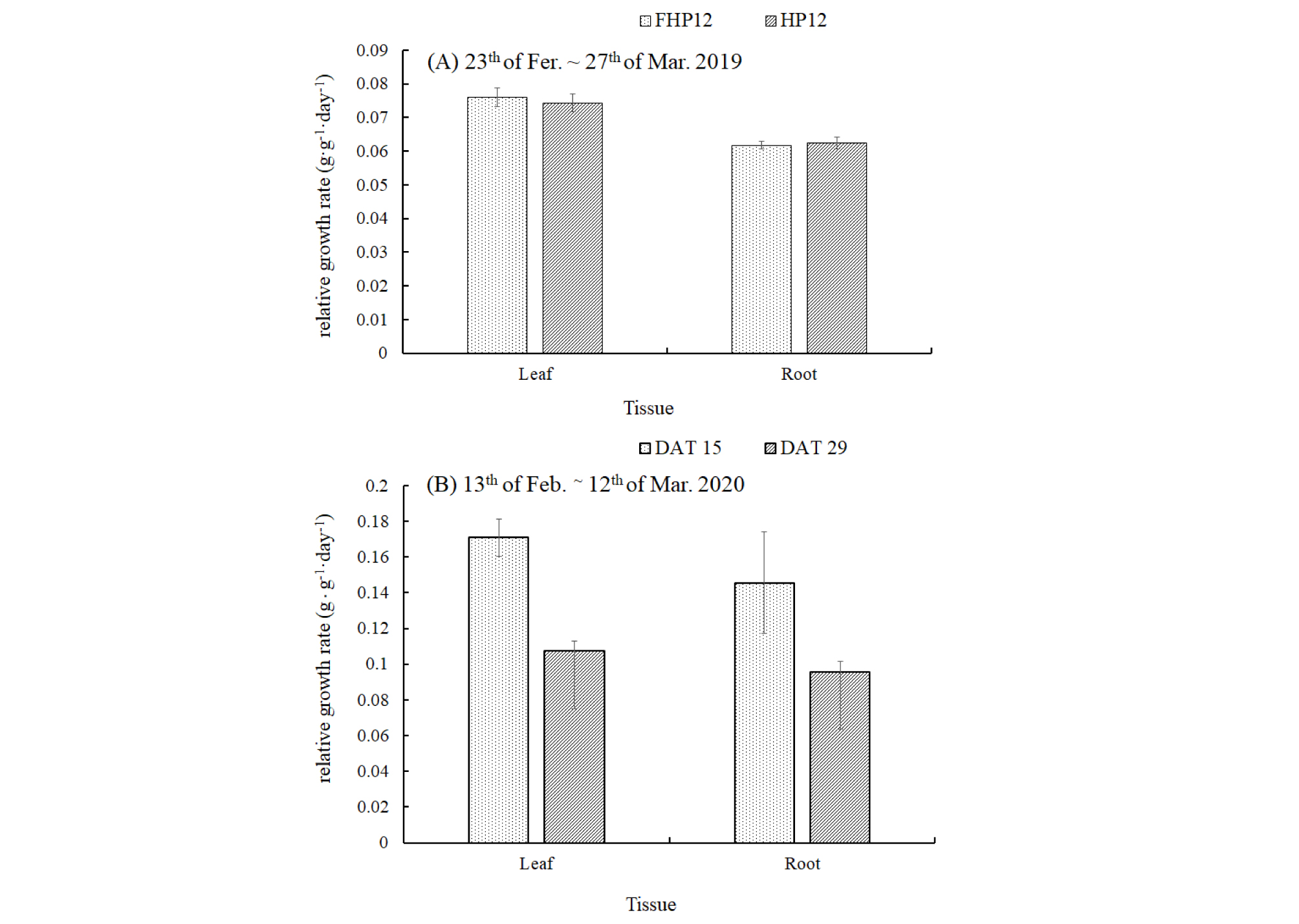
Fig. 7.
The relative growth rate of lettuce in the experiment I with FHP12 (12 fishes, filter, hydroball, 6 plants) and HP12 (12 fishes, hydroball, 6 plants) (A) and in the experiment II with FHP15 (15 fishes, filter, hyroball, 6 plants) (B). Bars represent standard error for 3 replications. Relative growth rate(RGR) = (ln W2 - ln W1)/(t2-t1)), ln = natural logarithm, t1 = time one (in days), t2 = time two (in days), W1 = Dry weight of plant at time one (in grams), W2 = Dry weight of plant at time two (in grams)
4. 잎의 무기이온 함량 변화
실험 1에서 엽내 무기이온 함량을 Jones 등(1991)이 제시한 로메인 상추잎의 무기이온 함량과 비교하면 P을 제외한 다른 무기이온 함량은 낮았다(Table 3). 상추 엽내 P 적정함량은 0.45~0.8% 수준인데 실험 1에서 1.25%로 높아 사육조 P 농도가 0~7.7mg·L-1 수준으로 낮게 측정된 결과와 일치한다(Fig. 5). 실험 2에서도 잎의 T-N과 P 함량은 적정수준에 근접한 결과를 보였는데 이는 물고기 밀도(60kg·m-3)가 높아 사육수 NO3-N와 P의 농도가 높게 유지된 결과로 보인다. K 함량은 적정함량인 5.5~6.2%의 1/4 수준인 1.49%인데 이는 실험 1보다 더 낮은 함량으로 실험 2에서 재배한 상추 품종이 상대생장율이 높고 엽수가 많았던 것과 관련이 있다. Ca 함량은 실험 1, 2에서 모두 적정함량인 2.0~2.8%의 1/2 수준이었다. FAO(2014)는 잎이 많은 채소는 더 많은 Ca과 K을 공급해야 한다고 하였고 식물양분흡수율은 성장률과 영양소 요구도에 의해 조절된다고 하였다(Clarkson, 1985). 실험 1, 2에서 엽내 무기이온이 적정함량보다 낮았지만 결핍증상은 나타나지 않았는데 특히 실험 2에서 엽내 K 함량이 1.49%로 매우 낮았지만, 결핍증상은 관찰되지 않았다. 실험 2에서 엽내 Fe 함량이 11.0mg·kg1로 매우 낮은데 결핍증상이 나타나진 않은 것은 주성분이 황토인 하이드로볼이 산화철(Fe2O3) 6.46~11.26%, 마그네슘 2~4%를 보유하고 있어(Kim 등, 2000) 식물이 황토의 산화철을 이용한 것으로 보이고 앞으로 세밀한 연구가 필요할 것으로 생각된다. 낮은 K 함량의 상추는 신장 기능이 손상된 환자들이 선호할 수 있지만(Renna 등, 2018), 식물 생육을 저조하게 하여 생산성이 낮아질 수 있다. Robaina 등(2019)는 아쿠아포닉스에서 식물 영양 부족을 해결하기 위해 물고기에게 맞춤형 사료를 공급하여 식물이용가능 영양분을 증가시킬 필요가 있다고 하였다. 본 연구결과를 종합하면 소규모 아쿠아포닉스로 고품질 엽채류 생산을 위해 금붕어를 사용할 경우 아쿠아포닉스 규모에 따라 적합한 어류밀도를 적용하는 것과 물고기와 식물 영양을 충족시키는 수준의 K, Ca, Fe이 배합된 사료개발도 필요할 것으로 보인다.
Table 3.
Mineral contents in leaf harvested from the experiment I (FHP12 and HP12) and experiment II (and mineral contents in the reference I and II.
z: FHP12: 12 fishes, filter, hydroball, 6 plants
y: HP12: 12 fishes, hydroball, 6 plants
x: data from Jones 등 (1991) for nutrient contents in the leaf of lettuce
w: FHP15: 15 fishes, filter, hydroball, 6 plants
v: data from Pineda 등 (2017) for lettuce grown under 20kg·m-3 fish density
u: mean value for 2 replicates




