서 론
재료 및 방법
1. 실험 재료 및 종자 특성
2. 수분함량
3. 온도 및 광 처리에 따른 발아율
4. 통계처리
결과 및 고찰
1. 종자 특성 및 수분함량
2. 온도 및 광 처리에 따른 발아율
3. 온도 및 광 처리에 따른 발아세, 평균 발아 일수 및 평균 발아 속도
서 론
수직농장은 광, 온도, 습도, 이산화탄소, 양액 등의 식물 재배 환경 조건을 체계적으로 제어하여 밀폐된 공간에서 식물 재배를 위한 첨단 기술을 활용하는 현대식 농업 시스템이다(Luna-Maldonado 등, 2016; Kozai 등, 2019). 기후 변화에 따라 안정적인 농작물 생산의 위협으로 인해 수직농장에 대한 관심이 높아지고 있다(Heo 등, 2010; Lee와 Cha, 2015; Lee 등, 2016). 수직농장은 인공 조명, 환경 제어 및 정밀한 관개 시스템을 통해 식물 재배에 최적 조건을 조성하여 기후 변화와 관계없이 연중 안정적인 식물을 재배할 수 있으며 운송 및 농약 사용의 필요성을 줄일 수 있다(Kozai와 Niu, 2015; Kalantari 등, 2018; SharathKumar 등, 2020; Kobayashi 등, 2022; Ji 등, 2023). 또한, 태양광이 없는 실내 환경에서 수직의 다층구조로 작물을 재배하는 시스템 특징을 가지고 있어(Kozai, 2018; van Delden 등, 2021; Bunge 등, 2022), 30cm 미만인 식물에 적합하여 단위 면적당 식물 생산성을 높일 수 있다(Goto, 2012; Kozai와 Niu, 2015).
수직농장은 고부가가치작물 선정 및 최적 재배 환경을 제공하는 기술 개발을 통해 경제성 확보가 필수적이다(Kim과 You, 2013). 그렇기에 수직농장 관련 연구들은 엽채류 재배에서 최근에 약용작물이나 기능성 작물 등의 고부가가치 소재에 대한 연구가 수행되고 있다(Zobayed, 2020). 약용작물인 Crepidiastrum denticulatum의 생장과 기능성 증진을 위해 수직농장 내 최적 환경 조건으로 재배가 가능하다(Bae 등, 2017). 그러나 약용작물을 포함한 야생의 식물들은 종자 휴면성의 차이와 깊이에 의해 종자 발아특성이 다를 수 있고(Baskin과 Baskin, 1998; Nikolaeva, 1999), 환경 조건(온도, 습도, 광) 및 환경 스트레스도 종자 발아에 영향을 준다(Satendra 등, 2016). 또한 배의 미숙, 종피의 불투수성, 휴면 유도물질의 존재 등 종자 발아를 제한하는 요인은 매우 다양하게 나타난다(Baskin과 Baskin, 1998). 따라서, 작물의 수직농장 도입 및 안정적인 생산을 위해 효율적인 종자 발아 조건을 구명하는 것이 필요하다(Merritt 등, 2007).
본 연구는 수직농장에서 고부가가치 작물인 약용작물을 재배하기 위한 기초 자료로 제공하고자 약용작물의 종자 형태 및 온도, 광 처리에 따른 종자 발아에 미치는 영향에 대한 연구를 수행하였다. 따라서, 수직농장에서 재배에 효율적인 약용작물 선정하기 위해 수직농장에서 기본적으로 종자 발아에 효율적인 종을 선정하고자 본 연구를 실시하였다.
재료 및 방법
1. 실험 재료 및 종자 특성
실험 재료는 감초(Glycyrrhiza uralensis Fisch. ex DC., Danong Seed Co., Ltd., Namyangju, Korea), 결명자[Senna tora (L.) Roxb., Aram Seed Co., Ltd., Seoul, Korea], 당귀(참당귀, Angelica gigas Nakai, Sungwoo Seed Co., Ltd., Seoul, Korea), 더덕[Codonopsis lanceolata (Siebold & Zucc.) Benth. & Hook.f. ex Trautv., Dongwonnongsan Seed Co., Ltd., Yongin, Korea], 식방풍(갯기름나물, Peucedanum japonicum Thunb., Dongwonnongsan Seed Co., Ltd., Yongin, Korea), 엉겅퀴[Cirsium japonicum Fisch. ex DC. var. maackii (Maxim.) Matsum., Aram Seed Co., Ltd., Seoul, Korea], 우슬(쇠무릎, Achyranthes bidentata Blume var. japonica Miq., Aram Seed Co., Ltd., Seoul, Korea) 및 황기[Astragalus penduliflorus Lam. var. dahuricus (DC.) X.Y.Zhu, Sungwoo Seed Co., Ltd., Seoul, Korea]로 총 8종의 약용 종자를 시판 구매 후 4°C 냉장고에 보관하여 사용하였다. 종자 특성은 버니어캘리퍼스로 종자의 길이와 폭을 측정하여 비율을 계산하였고, 백립중을 저울(PAG214C, Ohaus, Seoul, Korea)을 이용하여 측정하였다.
2. 수분함량
종별 선별된 100립의 종자를 15mL 갈색 코니컬 튜브에 넣고 증류수를 채워 4°C 냉장고에서 보관하였다. 이후 매일 동일한 시간에 종자 표면의 수분을 제거한 다음 종자의 무게를 저울로 측정하였으며, 7일차 측정 후 70°C에서 72시간 동안 건조(Horizontal Flow Oven, DAIHAN Scientific, Wonju, Korea)하여 종자의 건물중으로 계산하였다. 종자의 건조 전과 후의 무게를 기준으로 일별 측정된 값을 사용하여 수분함량(moisture content)을 다음의 수식으로 계산하였다(Baskin과 Baskin, 2003).
Moisture content (%) = [(Wh-Wi)/Wi] × 100
(Wh: 각 일자별 백립중, Wi: 종자 건중량)
3. 온도 및 광 처리에 따른 발아율
발아테스트를 위하여 페트리디쉬(90 × 15mm)에 필터 페이퍼(90mm diameter, Toyo Roshi Kaisha Ltd., Tokyo, Japan)를 2장 깔고 증류수를 5mL 공급하였다. 각 페트리디쉬에 선별한 종자를 100립을 파종한 다음 광도 105.2 ± 0.8 μmol·m-2·s-1, 온도 15, 20, 25°C(12h), 25/15°C(16/8h, light/dark)로 설정된 생장 챔버(VS-91G09M-4R, Vision Scientific Co., Ltd., Daejeon, Korea)에 각각 배치하였다. 암발아 조건은 페트리디쉬에 호일을 감싸주었다. 매일 발아된 개체들을 계수 후 제거하였으며, 수분이 부족할 시 증류수를 1mL 추가 관수하였다. 총 18일간의 발아율을 확인하였으며, 발아율(germination rate), 발아세(germination energy), 평균 발아 일수(mean daily germination), 평균 발아 속도(mean germination time)를 아래의 식으로 계산하였다(Choi 등, 2019; Hwang 등, 2023).
Germination rate = (N/S) × 100
Germination energy = (N9/S) × 100
Mean daily germination = N/T
Mean germination time = ∑(TxNx)/N
(N: 총 발아 종자 수, S: 파종한 종자 수, N9: 9일까지 발아한 총 종자 수, T: 총 조사 일수, Tx: 치상 후 조사 일수, Nx: 조사 당일의 발아 종자 수)
4. 통계처리
종자 특성은 종자의 길이 및 너비를 5반복으로, 백립중은 3반복으로 조사하였으며 수분함량, 온도 및 광 처리에 따른 발아율은 3반복으로 진행하였다. 통계 분석은 SPSS 프로그램(SPSS 27.0, SPSS IBM, Armonk, USA)을 이용하였으며, 발아세, 평균 발아 일수 및 평균 발아 속도는 온도와 광 처리 간의 비교를 위해 two-way ANOVA로 실시하였다. 사후 검정은 Duncanʹs multiple range test를 시행하였다(p < 0.05).
결과 및 고찰
1. 종자 특성 및 수분함량
약용작물 8종의 종자 형태 특성을 살펴보기 위해 종자의 길이, 너비 및 길이와 너비의 비율과 백립중을 나타내었다(Table 1). 종자의 길이는 당귀(참당귀)가 5.51 ± 0.23mm로 가장 길었으며, 더덕이 2.28 ± 0.10mm로 가장 짧았다. 감초의 종자 너비는 2.69 ± 0.18mm로 가장 길었으며, 우슬(쇠무릎)의 종자 너비는 1.24 ± 0.05mm로 가장 짧게 나타났다. 당귀에서 종자의 길이/너비의 비율이 3.73 ± 0.17로 가장 컸으며, 감초에서 1.18 ± 0.02로 가장 작았다. 종자의 백립중은 결명자가 1.56 ± 0.03g으로 가장 무거웠으며, 더덕과 엉겅퀴에서 0.18g으로 가장 가벼웠다.
Table 1.
Seed characteristics of 8 species of medicinal seeds.
| Scientific name | Length (mm) | Width (mm) | Length/width ratio | Weight (g)z |
| Glycyrrhiza uralensis Fisch. ex DC. | 3.17 ± 0.16y | 2.69 ± 0.18 | 1.18 ± 0.02 | 1.03 ± 0.04 |
| Senna tora (L.) Roxb. | 4.60 ± 0.27 | 2.26 ± 0.26 | 2.13 ± 0.26 | 1.56 ± 0.03 |
| Angelica gigas Nakai | 5.51 ± 0.23 | 1.48 ± 0.07 | 3.73 ± 0.17 | 0.23 ± 0.01 |
| Codonopsis lanceolata (Siebold & Zucc.) Benth. & Hook.f. ex Trautv. | 2.88 ± 0.10 | 1.64 ± 0.04 | 1.75 ± 0.06 | 0.18 ± 0.00 |
| Peucedanum japonicum Thunb. | 4.93 ± 0.38 | 2.53 ± 0.12 | 1.96 ± 0.15 | 0.43 ± 0.01 |
| Cirsium japonicum Fisch. ex DC. var. maackii (Maxim.) Matsum. | 3.77 ± 0.20 | 1.52 ± 0.03 | 2.49 ± 0.10 | 0.18 ± 0.00 |
| Achyranthes bidentata Blume var. japonica Miq. | 4.40 ± 0.06 | 1.24 ± 0.05 | 3.56 ± 0.13 | 0.27 ± 0.00 |
| Astragalus penduliflorus Lam. var. dahuricus (DC.) X.Y.Zhu | 3.23 ± 0.10 | 2.61 ± 0.10 | 1.24 ± 0.04 | 0.59 ± 0.02 |
종자 발아의 수분함량을 7일 동안 조사한 결과(Fig. 1), 감초, 결명자, 더덕, 식방풍(갯기름나물) 및 우슬은 초기 수분함량(0일차)이 10% 이하였으며, 모든 약용작물 종자에서 침지 1일차에 종자 수분함량이 유의적으로 증가하였다. 특히 결명자, 우슬 및 황기 종자는 2-3일차에, 이를 제외한 5종의 약용작물 종자에서는 1일차에 급격한 수분함량의 증가를 보였다.

Fig. 1.
Moisture content of 8 species of medicinal seeds (n = 3). A: Glycyrrhiza uralensis Fisch. ex DC., B: Senna tora (L.) Roxb., C: Angelica gigas Nakai, D: Codonopsis lanceolata (Siebold & Zucc.) Benth. & Hook.f. ex Trautv., E: Peucedanum japonicum Thunb., F: Cirsium japonicum Fisch. ex DC. var. maackii (Maxim.) Matsum., G: Achyranthes bidentata Blume var. japonica Miq., and H: Astragalus penduliflorus Lam. var. dahuricus (DC.) X.Y.Zhu.
종피의 수분 투과성은 화학적 조성과 구조적 특성에 의해 결정되며(Wada와 Reed, 2011), 발아를 위한 적정 침지 시간은 식물 종에 따라 차이를 보인다(Cho 등, 2014; Choi 등, 2018). 종자의 물리적 휴면은 수분이 종자 내부로 흡수되지 못하여 발아가 지연되는 것으로 24시간 안에 수분함량이 20% 이상의 증가를 보이는 종자는 물리적 휴면이 없는 종자로 판단한다(Baskin과 Baskin, 2003; Ko 등, 2022). 본 연구에서는 약용작물 종자 8종의 적정 침지 시간이 종에 따라 일부 차이를 보였으며, 24시간의 감초(38.65%), 결명자(31.75%), 당귀(43.03%), 더덕(42.96%) 및 식방풍(46.24%) 종자는 초기 수분함량 대비 20% 이상 수분함량의 증가를 보이므로 물리적 휴면이 없는 종자로 판단된다. 24시간의 종자 수분함량은 초기 수분함량 대비 엉겅퀴(16.14%), 우슬(16.43%) 및 황기(19.13%) 종자에서 20% 이상의 수분함량을 보이지 못하므로 물리적 휴면이 있는 종자로 판단된다.
2. 온도 및 광 처리에 따른 발아율
약용작물 8종의 온도 및 광 처리에 따른 발아율은 다르게 나타났다(Fig. 2). 발아율이 50% 이상이 되는 작물은 당귀, 더덕, 식방풍 및 우슬 종자였으며, 특히 당귀 종자는 25/15°C에서만 50% 이상의 발아율을 보였다. 우슬 종자는 15, 25/15°C에서 50% 이상의 발아율을 보였다. 더덕 종자는 모든 온도에서 발아율이 50% 이상으로 나타났고, 식방풍 종자는 15, 20, 25°C에서 50% 이상의 발아율을 보여, 비교적 넓은 발아 범위를 가지고 있다.
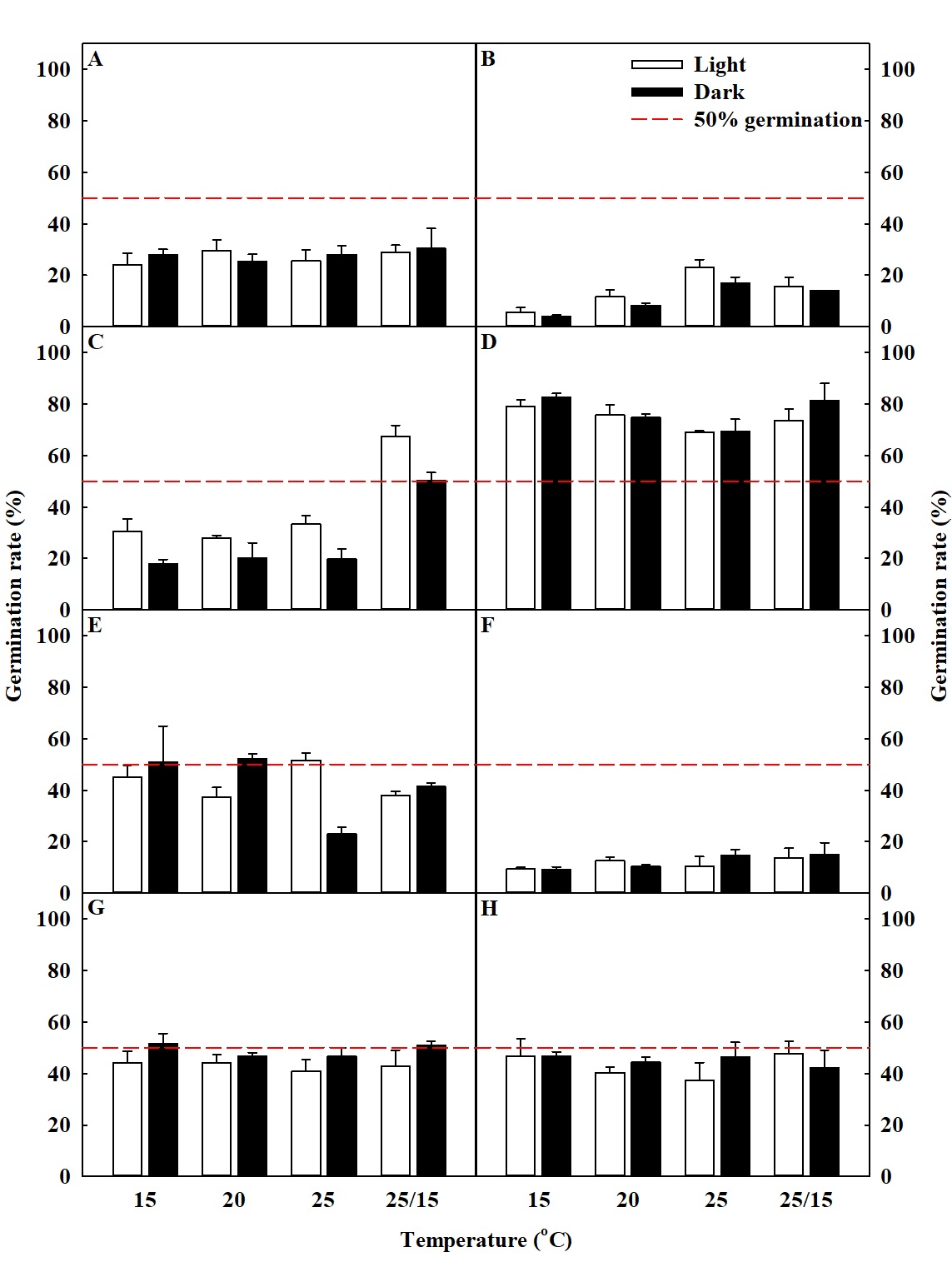
Fig. 2.
The germination rate of 8 species of medicinal seeds at the 18-day (n = 3). A: Glycyrrhiza uralensis Fisch. ex DC., B: Senna tora (L.) Roxb., C: Angelica gigas Nakai, D: Codonopsis lanceolata (Siebold & Zucc.) Benth. & Hook.f. ex Trautv., E: Peucedanum japonicum Thunb., F: Cirsium japonicum Fisch. ex DC. var. maackii (Maxim.) Matsum., G: Achyranthes bidentata Blume var. japonica Miq., and H: Astragalus penduliflorus Lam. var. dahuricus (DC.) X.Y.Zhu.
감초, 결명자, 당귀, 더덕 및 식방풍 종자는 광 조건에 치상 하였을 때 암 조건에 비해 발아율이 높았다. 일반적으로 작물 재배에 유용한 발아 온도인 25/15°C에서 감초, 당귀, 엉겅퀴 및 황기 종자는 각각 30.34 ± 7.84%, 67.34 ± 4.38%, 15.00 ± 4.59% 및 47.67 ± 4.85%로 나타났다. 결명자 종자는 25°C에서 발아율이 23.00 ± 3.06%로 가장 높았으며, 더덕, 식방풍 및 우슬 종자는 15°C에서 각각 82.67 ± 1.46%, 51.00 ± 13.87% 및 51.67 ± 3.79%로 가장 높은 발아율을 보였다.
광의 유무에 따른 발아율의 차이를 분석한 결과, 감초 및 결명자 종자는 광 조건이 암 조건에 비해 더 높은 발아율을 보였으며, 20°C와 25°C에서 각각 4.33%, 6% 높게 나타났다. 당귀 및 더덕 종자도 25/15°C에서 광 조건이 암 조건에 비해 각각 17%, 7.67% 더 높은 발아율을 보였으며, 식방풍 종자는 25°C에서 광 조건이 암 조건보다 28.67% 더 높은 발아율을 보였다. 반면 엉겅퀴, 우슬 및 황기 종자는 암 조건이 광 조건에 비해 더 높은 발아율을 보였으며, 각각 25°C에서 4.33%, 25/15°C에서 8.33%, 25°C에서 9% 더 높게 나타났다.
가을에 탈리되어 봄 또는 여름에 발아하는 많은 초본 식물은 인공적으로 초여름의 온도를 구현한 25/15°C에서 높은 발아율을 보인다는 것으로 보고되었으며(Baskin과 Baskin, 1998), 본 연구의 결과에서도 8종 중 4종의 약용작물 종자에서 다른 온도에 비해 25/15°C에서 높은 발아율을 보였다. 감초는 20-30°C의 광조건에서 31%의 발아율을 보여(Mao 등, 2008), 본 연구 결과와 유사한 발아율을 보였다. 결명자, 더덕 및 우슬은 25°C에서 각각 50%, 90% 및 80% 이상의 발아율을 보였다(Um 등, 2017; Choi, 2003; Kim 등, 2015). 20°C에서 식방풍 및 엉겅퀴는 각각 24.4%(광 조건) 및 50% 이상(광암 조건)의 발아율을 보였다(Lee 등, 2014; Madakadze 등, 1993). 당귀 종자의 경우는 광 조건에서 암 조건보다 발아가 양호하다는 결과가 보고되어(Yu 등, 1995), 본 연구의 결과와 일치하였다. 한편, 본 연구의 결과(25/15°C, 최대 67.34%)와 달리 일당귀(Angelica acutiloba Kitagawa)는 20°C에서 최대 99.5%의 발아율을 보였다(Lee 등, 2019). 또한, 황기 종자는 25°C에서 80%의 발아율을 보였고(Choi 등, 2013), 발아 적합 온도가 20-25°C인 광무관계종자로 광 조건이나 암 조건 모두 발아가 양호한 것으로 보고되었다(Kim 등, 2001). 위의 선행 연구들의 결과를 토대로 본 연구에서 사용된 종자는 시판 종자 임에도 채종 일자, 종자의 품질 등의 차이로 인하여 보고된 발아율과 상이한 결과를 보인 것으로 판단된다.
3. 온도 및 광 처리에 따른 발아세, 평균 발아 일수 및 평균 발아 속도
온도 및 광 처리에 따른 약용작물 8종의 종자 발아세, 평균 발아 일수 및 평균 발아 속도는 종 및 처리에 따라 다르게 나타났다(Table 2, 3, 4). 파종 후 9일 째에 발아세를 분석한 결과, 더덕 종자는 25/15°C 암 조건에서 74.00 ± 4.94%로 높은 결과를 보였고 당귀 종자는 15°C 암 조건에서 0%로 최저 발아세를 나타냈다(Table 2). 발아세의 광 처리에 따른 통계적인 차이는 더덕 및 우슬에서, 온도에 따른 통계적인 차이는 결명자, 당귀, 식방풍 및 엉겅퀴에서 나타났으며 온도 및 광 처리의 복합적인 요인에 대한 통계적인 차이는 모든 종에서 나타나지 않았다.
Table 2.
Germination energy of 8 species of medicinal seeds under light conditions and different temperatures.
| Treatments | Glycyrrhiza uralensis Fisch. | Senna tora (L.) Roxb. | Angelica gigas Nakai | Codonopsis lanceolata ex Trautv. | Peucedanum japonicum Thunb. | Cirsium japonicum Fish. | Achyranthes bidentata Blume | Astragalus penduliflorus Lam. | |
| Light | Temperature (%) | ||||||||
| Light | 15 | 19.00 ± 3.61z | 2.67 ± 0.89 ey | 0.67 ± 0.34 b | 63.00 ± 0.58 b | 0.00 ± 0.00 b | 1.67 ± 0.34 b | 39.00 ± 4.59 | 46.34 ± 6.57 |
| 20 | 23.67 ± 1.67 | 9.00 ± 1.74 cd | 6.67 ± 1.77 ab | 67.34 ± 4.67 ab | 5.34 ± 1.21 ab | 6.67 ± 0.34 ab | 41.67 ± 2.67 | 40.00 ± 2.52 | |
| 25 | 24.00 ± 3.61 | 19.34 ± 2.97 a | 6.00 ± 2.09 ab | 65.34 ± 0.34 ab | 10.00 ± 3.79 a | 10.00 ± 4.00 a | 39.34 ± 3.53 | 37.34 ± 6.89 | |
| 25/15 | 25.00 ± 2.31 | 11.67 ± 2.73 bc | 7.67 ± 4.26 ab | 66.00 ± 1.53 ab | 0.34 ± 0.34 b | 8.67 ± 1.77 ab | 40.00 ± 6.66 | 47.67 ± 4.85 | |
| Dark | 15 | 18.34 ± 0.34 | 46.67 ± 1.77 e | 0.00 ± 0.00 b | 73.34 ± 0.89 a | 2.67 ± 0.89 b | 2.00 ± 1.00 b | 46.67 ± 5.90 | 1.67 ± 0.34 |
| 20 | 23.34 ± 1.34 | 44.34 ± 2.03 de | 3.34 ± 0.89 ab | 68.34 ± 1.86 ab | 5.67 ± 0.67 a | 7.34 ± 0.89 ab | 45.34 ± 1.34 | 7.67 ± 2.19 | |
| 25 | 25.67 ± 4.06 | 46.34 ± 5.79 ab | 4.67 ± 0.89 ab | 66.34 ± 3.72 ab | 16.34 ± 2.61 ab | 11.67 ± 2.41 a | 46.34 ± 3.39 | 5.67 ± 1.46 | |
| 25/15 | 24.34 ± 4.38 | 42.34 ± 6.75 bc | 10.34 ± 4.49 a | 74.00 ± 4.94 a | 12.67 ± 0.89 b | 11.34 ± 3.39 a | 48.67 ± 2.19 | 1.67 ± 1.21 | |
| Significancex | |||||||||
| Light (L) | NS | NS | NS | * | NS | NS | * | NS | |
| Temperature (T) | NS | *** | ** | NS | *** | ** | NS | NS | |
| L × T | NS | NS | NS | NS | NS | NS | NS | NS | |
Table 3.
Mean daily germination of 8 species of medicinal seeds under light conditions and different temperatures.
| Treatments | Glycyrrhiza uralensis Fisch. | Senna tora (L.) Roxb. | Angelica gigas Nakai | Codonopsis lanceolata ex Trautv. | Peucedanum japonicum Thunb. | Cirsium japonicum Fish. | Achyranthes bidentata Blume | Astragalus penduliflorus Lam. | |
| Light | Temperature (%) | ||||||||
| Light | 15 | 6.19 ± 0.26z aby | 9.40 ± 2.64 a | 13.71 ± 0.39 | 7.49 ± 0.11 a | 14.94 ± 0.15 a | 12.92 ± 0.31 a | 7.34 ± 0.15 a | 2.85 ± 0.22 a |
| 20 | 5.29 ± 0.88 bc | 5.45 ± 0.64 ab | 12.67 ± 0.81 | 6.07 ± 0.08 c | 12.84 ± 0.10 de | 8.86 ± 0.17 c | 4.74 ± 0.22 b | 2.11 ± 0.22 bc | |
| 25 | 3.38 ± 0.60 d | 4.25 ± 0.38 ab | 12.75 ± 0.52 | 5.71 ± 0.11 d | 12.14 ± 0.44 ef | 6.17 ± 0.23 e | 4.02 ± 0.18 cd | 1.79 ± 0.16 c | |
| 25/15 | 4.49 ± 0.63 bcd | 5.87 ± 0.71 ab | 12.45 ± 0.45 | 6.40 ± 0.11 bc | 13.27 ± 0.28 cd | 7.41 ± 0.42 de | 4.28 ± 0.21 bcd | 1.90 ± 0.16 c | |
| Dark | 15 | 7.61 ± 0.34 a | 6.26 ± 3.48 ab | 12.99 ± 0.19 | 6.65 ± 0.11 b | 14.32 ± 0.29 ab | 11.55 ± 0.20 b | 7.17 ± 0.21 a | 2.61 ± 0.11 ab |
| 20 | 4.50 ± 0.58 bcd | 6.70 ± 1.00 ab | 12.89 ± 0.19 | 5.36 ± 0.12 e | 11.92 ± 0.36 f | 7.68 ± 0.50 d | 4.49 ± 0.11 bc | 2.08 ± 0.19 bc | |
| 25 | 3.97 ± 0.40 cd | 3.23 ± 0.59 b | 12.21 ± 0.30 | 5.28 ± 0.11 e | 12.39 ± 0.20 ef | 6.15 ± 0.58 e | 3.80 ± 0.24 d | 1.90 ± 0.18 c | |
| 25/15 | 5.06 ± 0.64 bcd | 4.36 ± 0.50 ab | 12.30 ± 0.56 | 6.23 ± 0.13 c | 13.78 ± 0.20 bc | 6.20 ± 0.49 e | 4.65 ± 0.02 b | 1.73 ± 0.11 c | |
| Significancex | |||||||||
| Light (L) | NS | NS | NS | *** | NS | ** | NS | NS | |
| Temperature (T) | *** | NS | NS | *** | *** | *** | *** | *** | |
| L × T | NS | NS | NS | * | NS | NS | NS | NS | |
발아에 소요되는 평균 발아 일수는 황기에서 가장 짧았으며, 25/15°C 암 조건에서 1.73 ± 0.11일로 나타났다(Table 3). 반면 식방풍 종자 15°C 광 조건에서 14.94 ± 0.15일로 가장 긴 평균 발아 일수를 보였다. 통계적인 차이를 비교한 결과, 더덕 및 엉겅퀴 종자는 온도에 따라 통계적으로 차이를, 감초, 더덕, 식방풍, 엉겅퀴, 우슬 및 황기 종자는 광 처리에 따른 통계적인 차이를 보였다. 한편 더덕 종자는 온도 및 광 처리에 따라 평균 발아 일수에서 통계적으로 차이를 보였다.
평균 발아 속도는 결명자 종자가 15°C 광 조건에서 0.76 ± 0.23으로 가장 빨랐으며, 황기 종자는 25/15°C 광 조건에서 34.19 ± 4.71로 가장 느렸다(Table 4). 평균 발아 속도는 광 처리에 따라 당귀 및 더덕 종자에서 통계적으로 차이를 보였으며, 감초, 결명자, 당귀, 더덕, 엉겅퀴 및 우슬 종자는 온도에 따라 유의적인 차이를 보였다. 식방풍은 온도 및 광 처리의 단일 요인에서는 유의적인 차이가 없었으나 복합적인 요인에 대한 유의적인 차이를 보였다.
Table 4.
Mean germination time of 8 species of medicinal seeds under light conditions and different temperatures.
| Treatments | Glycyrrhiza uralensis Fisch. | Senna tora (L.) Roxb. | Angelica gigas Nakai | Codonopsis lanceolata ex Trautv. | Peucedanum japonicum Thunb. | Cirsium japonicum Fish. | Achyranthes bidentata Blume | Astragalus penduliflorus Lam. | |
| Light | Temperature (%) | ||||||||
| Light | 15 | 5.93 ± 1.30z by | 0.76 ± 0.23 b | 2.26 ± 0.32 cd | 11.22 ± 0.25 c | 3.07 ± 0.30 bc | 0.78 ± 0.06 b | 6.44 ± 0.64 c | 21.93 ± 2.71 |
| 20 | 10.71 ± 2.11 a | 3.99 ± 1.47 b | 2.39 ± 0.09 cd | 13.91 ± 0.84 ab | 3.05 ± 0.25 bc | 1.70 ± 0.21 ab | 11.26 ± 0.59 ab | 26.38 ± 3.65 | |
| 25 | 13.43 ± 1.48 a | 12.30 ± 2.40 a | 2.79 ± 0.33 c | 13.35 ± 0.23 ab | 4.44 ± 0.08 a | 1.95 ± 0.78 ab | 13.15 ± 1.71 a | 27.93 ± 4.76 | |
| 25/15 | 12.02 ± 0.78 a | 5.37 ± 1.70 b | 5.67 ± 0.20 a | 12.86 ± 0.63 bc | 2.97 ± 0.17 bc | 2.22 ± 0.47 ab | 11.53 ± 2.11 ab | 34.19 ± 4.71 | |
| Dark | 15 | 5.45 ± 0.38 b | 1.34 ± 0.63 b | 1.43 ± 0.13 d | 13.00 ± 0.35 bc | 3.79 ± 0.85 ab | 0.83 ± 0.10 b | 7.59 ± 0.76 bc | 23.93 ± 1.42 |
| 20 | 9.19 ± 1.44 ab | 2.28 ± 0.19 b | 1.61 ± 0.46 d | 15.36 ± 0.56 a | 4.61 ± 0.22 a | 1.54 ± 0.15 ab | 11.39 ± 0.26 ab | 29.56 ± 2.94 | |
| 25 | 13.90 ± 2.03 a | 9.99 ± 2.15 a | 1.70 ± 0.31 d | 14.42 ± 0.80 ab | 1.99 ± 0.27 c | 3.05 ± 0.52 a | 15.20 ± 1.75 a | 32.58 ± 6.20 | |
| 25/15 | 12.15 ± 1.73 a | 5.42 ± 0.29 b | 4.38 ± 0.53 b | 14.60 ± 1.00 ab | 3.12 ± 0.18 bc | 3.05 ± 0.81 a | 12.82 ± 0.28 a | 31.26 ± 5.41 | |
| Significancex | |||||||||
| Light (L) | NS | NS | *** | ** | NS | NS | NS | NS | |
| Temperature (T) | *** | *** | *** | ** | NS | ** | *** | NS | |
| L × T | NS | NS | NS | NS | *** | NS | NS | NS | |
결과적으로 본 연구에서 사용된 약용작물의 종자는 온도 및 광 조건에 대한 다양한 발아 특성의 차이를 보였기 때문에, 이러한 종자별 발아 특성 분석은 수직농장에서 생산하기 위한 작물 선정에 반드시 필요한 과정임을 시사한다. 수직농장에서 약용작물 및 기능성 작물 도입을 위한 기초적인 연구들이 수행되고 있으나(Jang 등, 2023; Park 등, 2022), 종자의 발아 특성 연구 보다는 대부분 재배 중점의 연구를 수행하였다. 이와 같이 노지 또는 하우스에서 재배되는 약용작물의 종자 특성, 수분 함량 및 발아 조건을 수직농장에서 재배하기 위한 기본적인 연구가 필요하다. 따라서, 본 연구를 통해 수직농장 내 온도 및 광 조건을 고려한다면 효율적인 종자 발아 관리가 용이한 당귀, 더덕, 황기를 적용하는 것이 적합할 것으로 판단된다.




