서 론
재료 및 방법
1. 배양재료 준비 및 치상
2. 생장조절제 및 sucrose 배지 제조
3. 배양환경 및 생육조사
4. 최소생장 기내보존 조건
5. 통계분석
결과 및 고찰
1. 마디배양에 미치는 생장조절제의 영향
2. 고체 및 액체배지에서 sucrose의 영향
3. 무병묘 생존에 미치는 최소생장 기내보존의 영향
서 론
메꽃과의 덩굴성 식물인 고구마(Ipomoea batatas)는 광범위한 지역에 적응력이 높고, 척박한 토양에서도 잘 자라며 단위면적당 수량도 높아 중요한 구황작물로 이용되어 왔다. 특히 고구마에는 칼륨, 안토시아닌, 베타카로틴, 토코페롤 및 식이섬유 등 기능성 성분이 풍부하여, 건강식 및 가공식품 원료로 소비자들에게 인기가 높을 뿐만 아니라, 사료용이나 주정용 및 바이오에탄올 등과 같은 농‧산업용으로도 널리 이용되고 있다(Teow 등, 2007).
영양번식을 하는 고구마는 바이러스에 감염되면, 세대가 진전될수록 수량감소와 함께 표피 퇴색 및 터짐, 얼룩무늬 등과 같은 상품성 저하가 심하게 나타난다(Karyeija 등, 1998). 이에 따라 감자, 딸기, 마늘 등에서와 마찬가지로 고구마 바이러스 피해를 예방하기 위해서는 분열조직배양을 통한 바이러스 무병묘를 재배하는 것이 바람직하다. 바이러스 무병묘 재배는 수량 및 상저비율이 증가하고, 표피색이 선명해지며 육색은 황색도가 증가하므로 농가수익을 높일 수 있다(Yoo와 Lee, 2013).
국내에서도 고구마 무병묘의 기내대량증식을 위한 연구도 활발하여, 분열조직 유래 무병 식물체의 획득 및 증식을 위한 생장조절물질, 배지조성 및 배지 물리성(Eun 등 2002; Nam 등, 2016), LED 광원(Yoo와 Lee, 2017) 등의 영향이 보고되었다. 생장조절물질은 BA, kinetin 등의 시토키닌 단독 또는 NAA와 같은 옥신과 혼용하는 것이 효과적이며, 품종 및 배양부위에 따라 반응이 다르다(Santa-Maria 등, 2009; Alam 등, 2010; Yang, 2010). 탄소원으로 이용되는 sucrose는 무병묘 생장 및 증식에 필수적인 요소이다((Alam 등, 2013)). Sucrose- free 배지에서는 부정아가 형성되지 않으며, 과도한 sucrose 첨가는 삼투압 증가로 오히려 부정아 발달 및 생장을 억제하기도 있다(Nowak 등, 2004; Karim 등, 2007). 따라서 배지의 생장조절물질 및 탄소원 농도는 식물의 종이나 genotype에 따라 필요로 하는 적정량이 다르기 때문에, 국내 고구마 품종의 기내급속증식을 위한 적정농도 구명이 필요하다. 또한 고구마 무병묘를 농가에 공급하기 위해서는 정식적기까지 일시에 많은 묘가 필요하므로, 수개월 전부터 기내급속증식이 필요하다. 따라서 전년도 가을부터 증식된 무병묘를 겨울동안 최소생장 기내보존을 하였다가, 봄철 정식기에 맞춰 증식‧순화시키는 것이 바람직하다(Yoo와 Lee, 2017). 최소생장 기내보존을 위해서는 0-15°C 저온 또는 저온과 함께 삼투압, 배지 지지물, ABA 첨가 등과 같은 배지조성이나 광 등을 조절하여 생장을 억제시켜 계대배양 없이 기내보존을 유도한다(Kovalchuk 등, 2009; Gopal과 Chauhan, 2010).
본 연구는 고구마 바이러스 무병묘의 기내급속증식을 위한 적정 생장조절물질 및 sucrose 농도와 최소생장 기내보존에 미치는 광의 영향을 구명하기 위하여, 고체 및 액체배지에서 생장조절물질 및 sucrose 농도에 따른 기내생장 특성과 15°C 저온에서 기내배양 유식물체의 최소생장 기내보존 기간 등을 조사하였다.
재료 및 방법
1. 배양재료 준비 및 치상
육질이 분질인 ‘맛나미’와 주황색 점질로 생식용인 ‘신황미’의 정단 분열조직 유래의 무병 식물체를 MS기본배지(Murashige와 Skoog, 1962)에서 5cm 크기로 증식하여 재료로 사용하였다. 정단배양은 원줄기 상부 약 10mm를 잘라 치상하였고, 마디배양은 정단을 제거한 상위 마디를 10mm 크기로 잘라 샬레당 6개체씩 치상하였다.
2. 생장조절제 및 sucrose 배지 제조
무병묘 마디배양을 위한 적정 생장조절제 농도를 구명하기 위하여, MS기본배지에 0, 0.05, 1.0mg·L-1 NAA (1-naphthaleneacetic acid)와 0.2, 0.5, 1.0mg·L-1 BA (6-benzyladenine)를 조합한 8종의 0.8% 한천배지를 1회용 샬레(90×20mm)에 25mL 씩 분주하여 사용하였다. 또한 배지물리성에 따른 적정 sucrose 농도를 구명하기 위하여, 0.2mg·L-1 BA를 첨가한 한천배지(0.8%)와 액체배지에 각각 0, 3, 5, 7, 9% sucrose를 첨가하여 사용하였다.
3. 배양환경 및 생육조사
치상이 끝난 샬레는 랩 3겹으로 싸서, 적색(660nm) + 청색(460nm) = 7:3 혼합 LEDs (DyneBio Co., Korea) 하에서 배양하였다. 광량은 20cm 거리에서 150±5μmol·m-2·s-1 photosynthetic photon flux density (PPFD)를 유지하였으며, 명기:암기는 16:8 시간, 배양온도는 25±1°C로 조절하였다. 배양 4주 후에 줄기길이, 줄기두께, 잎수, 뿌리수, 생체중 및 건물중 등을 측정하였다. 건물중은 65°C의 열풍순환건조기(VS- 4300D, Vision Scientific Ceo., Ltd., Daejeon, Korea)에서 48시간 이상 건조하여 측정하였다.
4. 최소생장 기내보존 조건
기내보존 배지는 0.2mg·L-1 BA를 첨가한 MS배지에 투명도를 높이기 위하여 0.4% Gelrite (Sigma Chemical Co., USA)를 첨가하여, ‘맛나미’와 ‘황미’의 정단(10mm)을 샬레당 10개체씩 밀식하여 치상하였다. 치상이 끝난 샬레는 수분증발을 억제하기 위하여 파라필름(Parafilm M, American Can Co., USA) 1겹과 랩 3겹으로 싸서, 25°C, 27μmol・m-2・s-1 형광등 하에서 1주 동안 발근시켰다. 발근된 식물체는 암조건과 적색:청색(660nm:460nm=7:3) 혼합 LED (150±5μmol·m-2·s-1 PPFD, 명기:암기=16:8hrs.)를 설치한 저온항온기에 보존하였다. 기내보존 온도는 배양실 온도보다 낮은 15°C로 조절하였다(Lee와 Kwon, 2013). 기내보존 후 1개월 간격으로 6개월까지 생존율을 조사하였고, 최소생장 기내보존 전과 5개월 후의 줄기길이, 줄기두께, 잎수, 뿌리수, 뿌리길이 등을 측정하였다.
5. 통계분석
시험구 배치는 완전임의배치 5반복으로 하여, 반복당 10개체의 생육특성을 조사하였고, 최소생장 기내보존의 생존율은 반복당 30개체를 조사하였다. 데이터 분석은 SAS 통계프로그램(statistical analysis system, V 9.1, SAS Institute Inc., USA)을 이용하여, ANOVA (analysis of variance) 및 던컨의 다중검정분석(Duncan’s multiple range test) 과 T-test로 p≤0.05수준에서 각 처리 평균 간의 유의차를 비교하였다.
결과 및 고찰
1. 마디배양에 미치는 생장조절제의 영향
고구마 바이러스 무병묘 증식을 위한 마디배양에 미치는 생장조절제의 영향을 배양 4주 후에 조사한 결과, 0.2-0.5mg·L-1 BA 첨가배지에서 ‘맛나미’와 ‘신황미’ 모두 줄기길이, 줄기직경, 잎수, 생체중 및 건물중이 가장 양호하였다(Table 1). 마디배양에 미치는 NAA와 BA 혼합배지의 영향은 절단면에 캘러스를 형성하여 줄기생장에 효과적이지 않았으며, BA함량이 높을수록 캘러스 및 shoot 발달은 빠른 경향을 보였다. 소식물체의 생육은 BA 단독첨가 배지에서 양호하였다. 0.2-0.5 mg· L-1 BA 첨가배지에서 가장 좋은 생육을 보였는데, 0.5-1 mg· L-1 의 BA 첨가배지에서는 절단면에 캘러스가 발생하는 문제가 있었다. 또한 생장조절제를 첨가하지 않은 MS배지에서는 줄기길이, 생체중, 건물중 등이 유의하게 낮았다. 품종간에는 ‘맛나미’보다 ‘신황미’의 소식물체 생육이 양호한 특성을 보였으며, ‘맛나미’와 ‘신황미’ 모두 BA 0.2-0.5mg·L-1 첨가배지에서 줄기길이, 줄기직경, 잎수, 생체중 및 건물중 등이 양호하였다. 반면 잎수와 뿌리수는 두 품종 간에 유의한 차이를 보이지 않았다. 고구마 정단배양에서도 BA 단독배지에서 신초발달이 가장 효과적이었고(Yang, 2010), 고구마 마디 또는 생장점 배양에서도 kinetin 단독첨가가 신초형성 및 생장이 양호한 것으로 나타나(Alam 등, 2010), 본 실험과 유사하였다. 그러나 연구자에 따라 생장점 배양에서 NAA와 BA 혼합배지가 신초형성에 효과적이었다는 결과와(Santa-Maria 등, 2009), 정단배양에서 뿌리발달은 BA와 NAA 혼합배지에서 왕성하였다는 결과(Yang, 2010)등으로 보아 배양재료에 따라서 차이가 있는 것으로 나타났다. 또한 고구마 잎과 마디배양에서도 NAA와 BA 혼합 첨가시에 BA 농도가 높을수록 캘러스 발달이 왕성하였고, BA 농도가 낮으면 뿌리 발달이 양호하다(Carswell과 Locy, 1984). 이상과 같이 고구마 무병묘 증식을 위한 마디배양 배지는 캘러스 형성이 없으면서 줄기신장, 줄기직경, 잎수, 뿌리수, 생체중 및 건물중 등이 양호한 0.2mg·L-1 BA 첨가배지가 적합하였다.
Table 1. Effect of 1-naphthaleneacetic acid (NAA) and 6-benzyladenine (BA) on in vitro single-node culture of virus-free sweet potato at 4 weeks after culture.
2. 고체 및 액체배지에서 sucrose의 영향
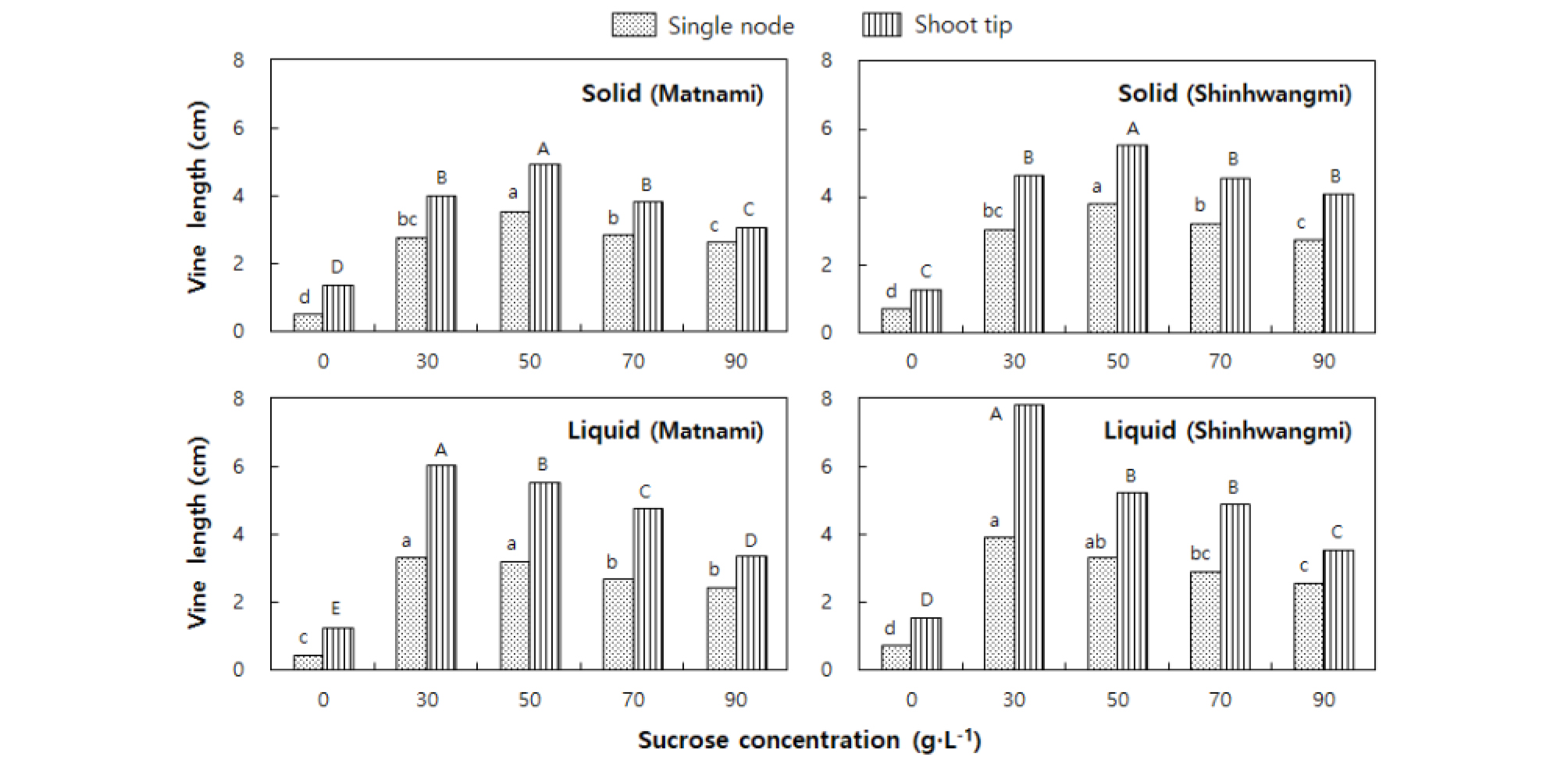
무병묘 기내증식을 위한 배지 물리성 및 sucrose 농도의 영향을 비교하기 위하여, sucrose 농도를 달리하여 정단 및 마디배양을 한 결과, 신초생육은 고체배지보다 액체배지에서 양호하였다(Fig. 1). 배지 물리성에 따른 sucrose 농도는 액체배지는 3%, 고체배지는 5% 에서 줄기신장이 가장 양호하였다. (Nam 등(2016))은 생장조절제를 첨가하지 않은 MS배지의 고구마 마디배양에서 초장, 잎수 및 생체중 등이 고체배지보다 액체배지에서 양호하였다고 하였으며, (Ndagijimana 등(2014))은 고구마 마디배양에서 신초신장이 150mM sucrose 첨가배지에서 가장 양호하다고 하여, 본 연구결과와 같았다. 다만 본 연구에서는 고체배지보다 액체배지에서 개체간 생장이 불균일하였으며, 특히 마디배양에서 심한 경향이었다. 또한 sucrose 무첨가배지에서는 배양부위에 관계없이 생육이 극히 불량하였으며, 배양부위에 따라 액체 및 고체배지에서 적정 sucrose 농도는 다른 것으로 나타났다. 고체배지에서 줄기직경, 잎수, 생체중 및 건물중은 배양부위, 품종 및 sucrose 농도에 따른 유의한 차이를 보였으며, 뿌리수 및 뿌리길이는 sucrose 농도에 따라 유의한 차이를 보였다(Table 2). 액체배지에서 잎수는 품종 간에 유의한 차이가 없었으며, 뿌리수, 생체중 및 건물중 등이 배양부위, 품종 및 sucrose 농도에 따른 유의한 차이를 보였고, 줄기직경 및 뿌리길이는 품종과 sucrose 농도에 따라 유의한 차이를 나타냈다(Table 3). 또한 마디배양보다 정단배양에서 왕성한 생육을 보였고, 품종 간에는 ‘신황미’의 생육이 ‘맛나미’보다 고체 및 액체배지에서 모두 유의한 증가를 보였다. 생육특성별로 보면 줄기직경은 고체배지에서는 마디배양은 7% 까지, 정단배양은 9% 까지 sucrose 농도가 높아질수록 굵어졌으며, 액체배지에서는 마디배양 및 정단배양 모두 sucrose 농도가 높아질수록 줄기직경이 굵어지는 경향이었다. 잎수는 마디 및 정단배양 모두 고체배지에서는 5-7% sucrose농도에서, 액체배지에서는 3-5% sucrose 농도에서 가장 많았다. 뿌리수는 sucrose 무첨가 배지를 제외하고는 일정한 경향이 없었으나, 고체배지에서 뿌리길이는 정단배양의 경우, sucrose 농도가 높아질수록 길어지는 경향이었다. 이는 sucrose 농도가 높을수록 뿌리수 및 뿌리신장이 양호하였다고 한 Ndagijimana 등(2014)의 결과와 같았다. 액체배지에서는 마디 및 정단배양 모두 5% sucrose 첨가배지에서 가장 양호하였다. 생체중 및 건물중은 마디 및 정단배양 모두 고체배지에서는 5% sucrose 첨가배지에서, 액체배지에서는 3-5% sucrose 첨가배지에서 가장 양호하였다. 이는 6-8%의 sucrose 농도에서 초장, 근장, 생체중 및 건물중 증가가 현저하다고 한 Eun 등(2002)과 무병묘 급속증식은 4% sucrose에서 가장 양호하다고 한 Alam 등(2013)의 결과와 같은 경향이었다. 기내배양에서 탄소원으로 이용되는 sucrose는 부정아 유도와 초장, 생체중 및 엽록소 함량 등을 증가시키는 필수요소로, 식물의 종이나 genotype 및 배양부위에 따라 적정량이 다른데, sucrose 무첨가 배지에서는 부정아 형성이 안 되거나 늦으며, 과다한 sucrose 첨가는 삼투압 증가로 오히려 부정아 발달 및 생장을 억제한다는 기존의 연구결과와 같은 경향이었다(Nowak 등, 2004; Karim 등, 2007). 또한 고구마 대량증식 시스템에서 액체배지를 이용한 현탁배양은 생장이 빠르고 다수의 곁눈발생을 촉진하여 증식효율이 높지만, 시스템이 확충되지 않은 소규모 배양실에서 액체배지를 이용한 마디배양은 묘생장이 균일하지 못하고, 배지를 자주 교체하는 노력을 감안할 때, 고체배지가 효과적일 것으로 보였다. 다만 기내묘의 토양이식을 위한 순화과정에서는 액체배지가 한천 제거작업이 필요치 않으므로Nam 등(2016), 최종단계에서는 액체배지를 이용하는 것이 바람직할 것이다. 본 연구에서 기내 무병묘의 생육특성은 배지 물리성, 배양부위 및 sucrose 농도에 따라 상이한 반응을 보였으나, 마디배양은 5% sucrose를 첨가한 고체배지에서, 정단배양은 3% sucrose를 첨가한 액체배지에서 가장 효과적이었다.
Table 2. Effect of explants and sucrose concentrations on in vitro growth of virus-free sweet potato plantlets in solid medium.
zDifferent letters within columns indicate significant differences by Duncan’s multiple range test at p≤0.05. ns, *, **, *** ; Nonsignificant or significant at p≤0.05, 0.01 or 0.001 by ANOVA.
Table 3. Effect of explants and sucrose concentrations on in vitro growth of virus-free sweet potato plantlets in liquid medium.
zDifferent letters within columns indicate significant differences by Duncan’s multiple range test at p≤0.05. ns, *, **, *** ; Nonsignificant or significant at p≤0.05, 0.01 or
0.001 by ANOVA.
3. 무병묘 생존에 미치는 최소생장 기내보존의 영향
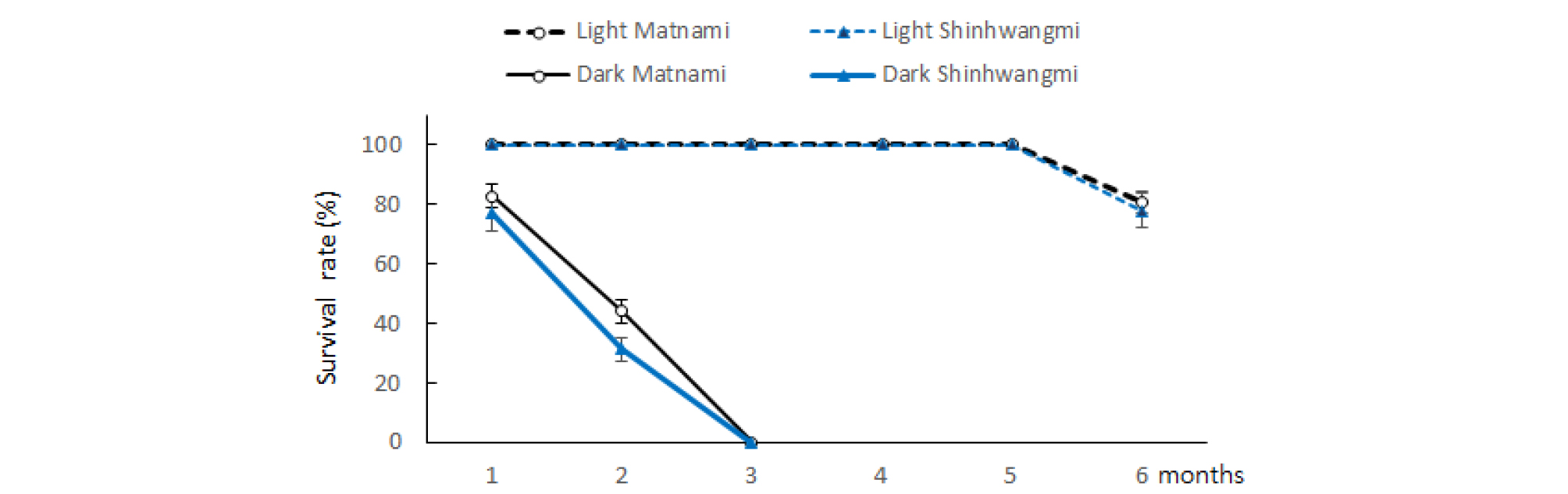
고구마 무병묘의 줄기정단(1cm)을 치상하여 1주일간 발근시킨 다음, 15°C 저온항온기에서 암조건(대조구)과 LED조사구에서 기내보존한 결과, 암조건에서는 1개월 후부터 잎이 급격히 황화되면서 2개월 후에는 대부분의 잎이 고사되었고, 3개월 후에는 줄기까지 모두 고사하였다. 반면 LED 적:청(6:4) 혼합광하에서는 5개월까지는 100% 생존하였으나, 이후부터는 고사하기 시작하여, 6개월 째 생존율은 ‘맛나미’ 80.7% ‘신황미’ 78.0%의 생존율을 보였다(Fig. 2). LED 광하에서 5개월 후의 무병묘 생육은 ‘맛나미’의 뿌리수를 제외하고는 최소생장 기내보존 후의 줄기길이, 잎수, 줄기두께, 뿌리길이 등에서 유의한 증가를 보였다(Table 4). 이는 딸기나 감자의 최소생장 기내보존에서 저온과 함께 낮은 광도의 빛이 있는 상태에서 생존율이 높아진다는 결과와 같았다(Reed, 1992; Sarkar와 Naik, 1998). 다만 15°C에서는 줄기 및 뿌리 생장량이 너무 억제되는 경향으로, 보존온도를 18-20°C 정도로 높이거나, 초기배양 기간을 2주정도로 늘리는 것이 바람직할 것으로 보였다. 특히 식물종에 따라 최소생장 기내보존을 위한 적정온도가 다른데, 저온성 작물은 상온보존보다 0-6°C 저온보존에서 생존율이 높다. 감자에서도 22°C 상온 기내보존은 4개월에 불과하지만, 6°C에서는 1년 이상 기내보존이 가능하였으며((Westcott, 1981)), 돌나물은 10mg·L-1 ABA 첨가배지에서 25°C에서는 8개월까지, 4°C에서는 18개월까지 기내보존이 가능하였다(Lee와 Kwon, 2013). 이와 같이 기내배양 식물체는 저온조건에서 계대배양 없이 1년 이상 보존할 수 있으며, 상온에서도 수개월 이상 활성을 유지할 수 있다(Gopal과 Chauhan, 2010; Kovalchuk 등, 2009). 따라서 최소생장 기내보존은 식물종의 특성에 따라 적정온도에서 보존하는 것이 바람직하다.
Table 4. Growth characteristics of virus-free sweet potato shoot-tip before and after the in vitro minimal-growth conservation at 15°C after 5 months.
zns, *, **, *** : non-significant or significant at p<0.05, 0.01 and 0.001 by T-test, respectively.
본 연구에서 고구마 무병묘의 최소생장 기내보존은 광이 필수적이며, 15°C 저온과 샬레를 이용한 밀식으로 좁은 공간에 대량보존이 가능하여 경제적이었다. 따라서 고구마 무병묘의 기내보존 기술은 봄철 정식기의 대규모 수요에 맞춰, 무병묘의 농가보급에 크게 기여할 수 있을 것으로 기대된다.