서 론
재료 및 방법
1. 재배 및 환경 관리
2. 식물체의 광량, 엽온, 그리고 증산 요소의 수직적 분포 측정
3. 통계분석
결과 및 고찰
1. 온실 내부 식물체 정단부의 수광 광도와 엽온
2. 식물체의 환경 및 증산 요소의 수직적 분포
서 론
파프리카(Capsicum annuum L.)는 고품질, 고수익을 목적으로 시설재배를 하는 대표적인 작물로 안정적 생산을 위하여 고랭지 지역에서는 광 부족 시기인 1-2월 겨울철을 회피한 하계 작형과 평지 지역에서는 7-8월 고온기를 회피한 동계 작형이 이루어지고 있다(Cho 등, 2009; Kim 등, 2021; Lee 등, 2014; Myoung 등, 2008). 온실에서는 내부로 입사되는 광에 의해 식물체 표면 온도(엽온)가 변화하고, 이러한 변화는 작물의 증산량, 광합성, 그리고 재배 중 낙화, 생장 저해, 숙성 불량 및 생리 장해 등에 영향을 준다(Kim 등, 2021; Rylski와 Spigelman, 1982; Shin 등, 2014; Went, 1953). 그리고 지나친 광량과 온도는 작물의 광합성 저하와 고온 스트레스를 유발할 수 있다(Jones, 1992; Oren 등, 1999). 특히, 일출 후 광량과 기온이 상승하는 동안 수증기압포차와 증산량은 유사한 변화 패턴을 나타낸다(Nam 등, 2017; Tai 등, 2010). 최근 증산량은 온실 내 관수 관리(Wanniarachchi와 Sarukkalige, 2022), 열에너지 관리(Boulard 등, 2017; Katsoulas와 Stanghellini, 2019) 등에 중요한 지표로 활용되고 있다. 줄기재배 방식의 온실 내 수직형 작물은 생장함에 따라서 높이, 엽 수 등의 변화로 이질적인 구조 및 공간이 발생한다(Chen 등, 2014; Sarlikioti 등, 2011). 이는 결국 동일 식물체에서도 광량, 광질, 엽온 및 기온, 그리고 이로 인한 증산량과 광합성 등에서 수직적 차이를 나타낸다(Kang 등, 2019). 주로 온실 작물은 밀식형 작물에서 광 분포를 파악하기 위한 Beer-lambert 법칙(BL)이 이용되고 있다(Boulard 등, 2017). 그러나 BL 법칙은 이질적인 구조 및 공간을 포함하지 못하며, 이를 감안한 FSPM 모델(Chen 등, 2014; Pao 등, 2021; Sarlikioti 등, 2011) 등이 연구되었다. FSPM 모델은 많은 매개 변수로 인하여 분석이 복잡하고 작물 생장에 따라서 오류가 심화될 수 있다는 지적이 있다(Louarn과 Song 2020; Vos 등, 2010; Zhang과 DeAngelis 2020). 현재 진행된 대부분의 연구들은 파프리카보다는 타 작물에서 주로 연구되었고, 파프리카 대상 연구에서는 연구 기간이 매우 짧고 소규모로 진행되어 대형온실에서의 다양한 요소를 반영하지 못하고 있다. 실제 온실 내에서는 다양한 규격에 따른 구조, 환기 및 CO2공급에 의한 공기 조성 변화(Boulard 등, 2017), 온실에서의 작물 위치, 특히 장기 재배 동안 해의 고도, 작물 초장 및 엽수 변화, 엽각 등의 구조적 변화, 그리고 주변 식물에 따른 반사광, 산란광 등 매우 다양한 요소들이 영향을 미친다. 따라서 장기간 재배되는 작물을 대상으로 시간에 흐름(작물 생장)에 따른 광, 엽온, 증산, 광합성 등 주요 환경와 증산 요소의 수직적 분포를 연구할 필요가 있다. 이러한 연구 결과는 이후 온실의 에너지 및 관수에 따른 비용절감을 목적으로 하는 연구들에게 유효한 자료를 제공할 수 있다.
따라서 본 연구는 벤로형 대형 온실에서 재배되고 있는 파프리카를 대상으로 하여 식물체의 생장함에 따른 광, 엽온, 그리고 증산 요소의 수직적 분포 변화를 알아보기 위해서 수행되었다.
재료 및 방법
1. 재배 및 환경 관리
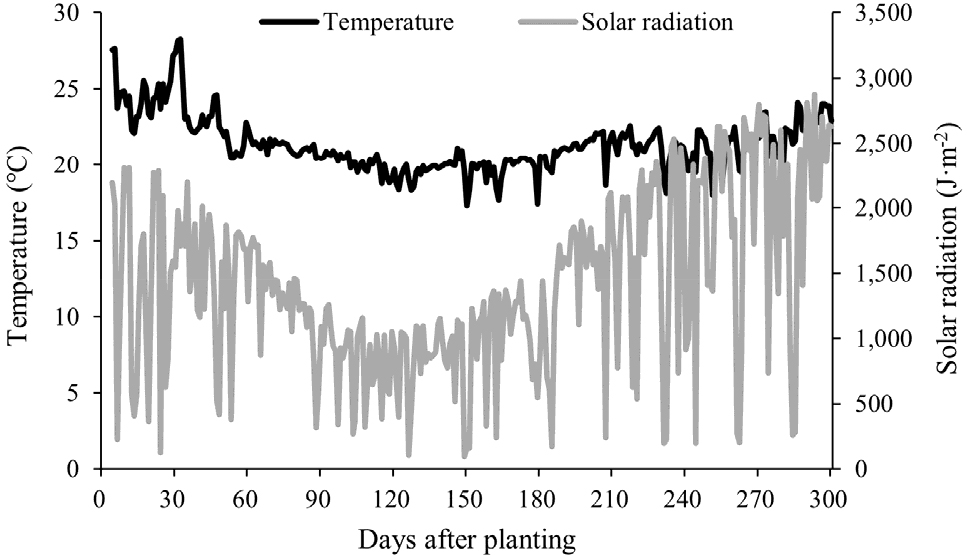
본 연구는 전라북도 익산시 춘포면에 위치한 남북 방향의 벤로형 온실(Fig. 1)에서 2022년 11월 12일부터 2023년 6월 7일까지 수행되었다. 실험 품종은 2022년 7월 20일에 파종된 후 8월 18일에 정식된 적색 계통 ‘나가노(C. annuum L. cv. Nagano RZ, Rijk zwaan Ltd., The Netherlands)’였다. 파프리카의 줄기는 일반적으로 정식 후 본엽이 8-10매 형성되면서 1차 분지가 이루어지는데, 본 연구에서는 1차 분지 시 2줄기만 남겨 유인하는 방식으로 관리되었고, 재식밀도는 3.34주/m2였다. 그리고 본 농가의 총 재배면적은 18,150m2이었으며, 이 중 실험에 이용된 이용 품종은 남북 방향 온실에서 남쪽에 재식되어 있었고 재배면적은 8,167m2였다. 환경제어는 농가의 복합환경제어시스템(HortiMaX, Hardewijk, Netherlands)에 의해 제어되었다. 조사기간 온실 내부 일평균기온은 최저 17.30℃, 최고 28.25℃, 평균 21.34 ± 1.80℃로 유지 및 관리되었고, 외부 일사량은 최저 95.10J·m-2, 최고 2,873.0J·m-2, 평균 1,409.13 ± 676.2J·m-2였다(Fig. 2).
2. 식물체의 광량, 엽온, 그리고 증산 요소의 수직적 분포 측정
조사 구역은 남북방향 온실의 남쪽이며, 동서 방향의 중앙 작업로를 중심으로 앞, 중간, 뒤로 3등분한 후 각 구역에서 남북방향의 재식 열 중 가운데 위치한 식물체를 대상으로 총 6지점으로 하였다(Fig. 1). 생육 초기에는 조사 엽수가 적어 각 지점별 3주로 총 18주를 조사하였고, 측엽을 포함하여 평균 70엽 이상되는 시점(정식 후 220일 경) 부터는 지점별 1-2주로 총 6-12주를 조사하였다. 그리고 식물체 당 평균 120엽이 되는 시기(정식 후 295일경)에 조사를 종료하였다.
식물체에 착생된 엽 전체를 대상으로 일주일 간격으로 오전 11시-오후 1시 사이에 형광 측정기(LI-600, LI-COR Ltd., Lincoln, USA)를 이용하여 엽 중앙부의 상부 광량(PPFD), 그 엽의 온도(Leaf temperature, LT), 수증기압포차(Vapor pressure deficit, VPD), 증산속도(Transpiration rate, TR), 기공전도도(Stomatal conductance, SC)를 측정하였다.
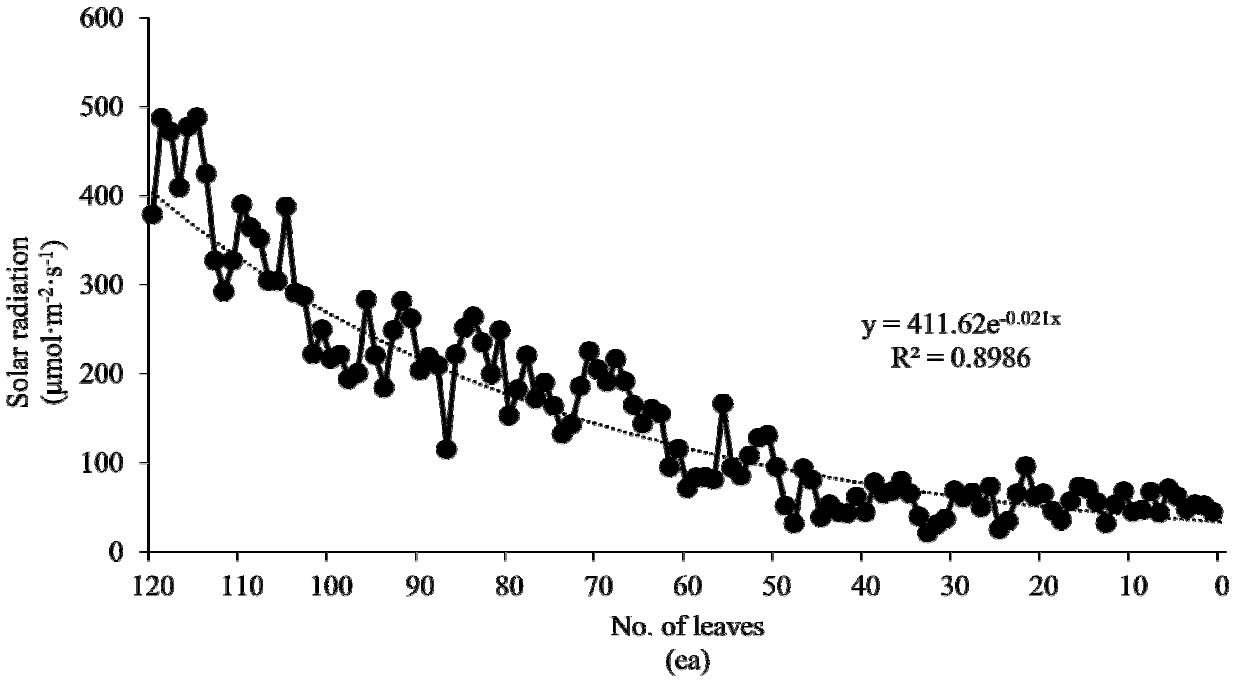
수집된 데이터의 현장 활용도를 높이기 위하여 가장 엽수가 많았던 120엽 시기의 데이터를 이용하여 광량의 수직적 분포를 3구간으로 나누었다. 온실 내로 유입된 광은 식물체 상부로부터 하부로 갈수록 급격히 감소되는 음의 지수함수(R2=0.8986***)를 나타내었다(Fig. 3). 따라서 상부와 하부 간에는 매우 유의한 차이를 나타낼 것으로 판단하였다. 이에 따라서 상부와 하부를 20% 또는 30%(중간부 60% 또는 40%)로 설정한 후 각 구간별 선형회귀분석을 통해 구간 간 회귀계수에서 더욱 뚜렷하게 차이를 나타낸 상부 : 중부 : 하부 = 20% : 60% : 20%로 3구간으로 나누어 평균하였다. 회귀계수의 절대값은 상부 > 중부 > 하부 순이었다(자료 미제시).
3. 통계분석
조사된 주요 데이터는 SPSS 프로그램(Version 19.0 SPSS Inc., Chicago, USA)을 통해 생장함에 따른 식물체 엽수와 3 구간 간 평균차이 검정은 이원배치분석(Two-way ANOVA), 상호관계성 및 영향력은 회귀분석(regression analysis)을 수행하였다. 그리고 회귀 그래프는 Excel 2018(office 365, microsoft Crop, Canada)을 이용하여 작성하였다.
결과 및 고찰
1. 온실 내부 식물체 정단부의 수광 광도와 엽온
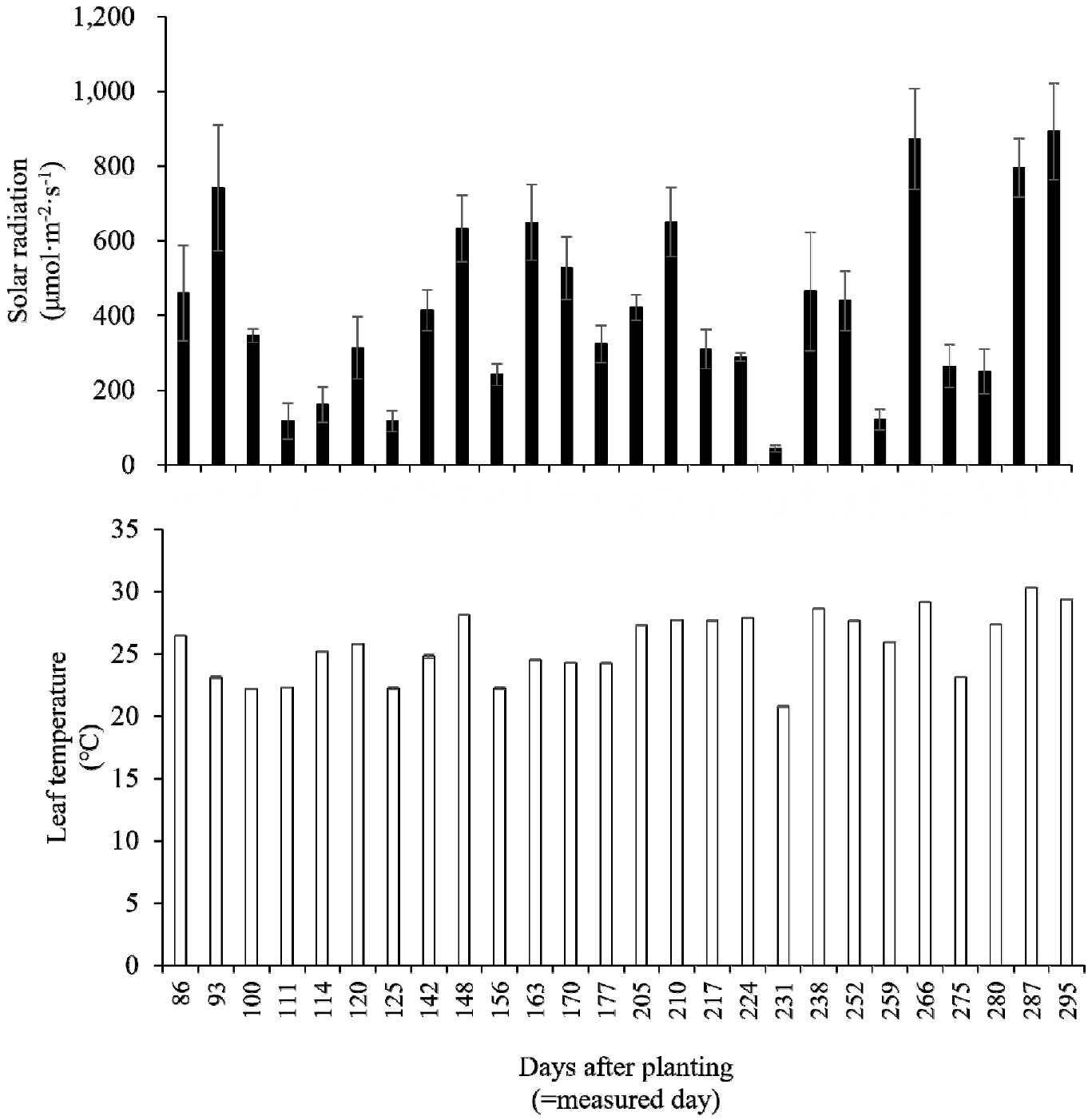
실험 기간 동안 오전 11시에서 오후 1시 사이에 7-10일 간격으로 조사 시 그 식물체 정단부의 광량(PPFD) 및 엽온을 측정하였다(Fig. 4). 식물 정단부까지 전달된 광량은 최소 43.5µmol·m-2·s-1, 최대 893µmol·m-2·s-1, 평균 417.7µmol·m-2·s-1로 변이계수는 57.9%였다. 정단부 엽온은 최소 20.8℃, 최대 30.3℃, 평균 25.7℃로 변이계수가 10.3%로 광량이 엽온보다 상대적으로 큰 변동이 있었다. 광량의 변이계수가 높은 것은 측정 시점에서 외부 광량 변화(Fig. 2)에 영향을 가장 크게 받았고, 내부에서는 차광스크린 작동 여부에 영향을 받은 것으로 판단된다.
2. 식물체의 환경 및 증산 요소의 수직적 분포
식물체의 분지점(방아다리)으로부터 한 줄기에 20, 40, 60, 80, 100 및 120 엽이 착생되었을 때 상부(20%), 중간부(60%), 하부(20%) 구간의 평균 광량, 엽온, 증산속도, 수증기압포차, 기공전도도를 비교하였다(Table 1). 식물체의 착생된 엽수와 구간 요인은 모든 요소에 모두 매우 유의한 영향을 주었다. 엽온에서 20엽착생 시기를 제외하고 모든 요소가 평균간 유의한 차이를 나타내었고, 그 평균값은 상부 > 중간부 > 하부 순이었다. 이에 따라서 조사된 모든 요소 간에도 상관성이 매우 높게 인정될 것으로 판단되었다.
Table 1.
Difference in average values of solar radiation (SR), leaf temperature (LT), transpiration rate (TR), vapor pressure deficit (VPD), and stomatal conductance (SC) by three parts according to growth (=increase in leaves) of plant during paprika cultivation (from November 2022 to June 2023) in Venlo-type greenhouse.
|
No. of leaves (A) (Days after planting) | Parts (B)x |
SR (μmol·m-2·s-1) |
LT (℃) |
TR (mmol·m-2·s-1) |
VPD (kPa) |
SC (mol·m-2·s-1) |
|
20 (93) | Upper | 362.83(1.00) az | 23.85 a | 4.49(1.00) a | 1.13 a | 0.47 a |
| Middle | 264.30(0.73) b | 23.83 a | 3.37(0.75) b | 1.20 b | 0.33 b | |
| Lower | 154.89(0.43) c | 23.94 a | 2.19(0.49) c | 1.29 c | 0.20 c | |
|
40 (122) | Upper | 241.46(1.00) a | 24.95 a | 1.86(1.00) a | 0.69 a | 0.31 a |
| Middle | 107.30(0.44) b | 24.70 b | 1.03(0.55) b | 0.72 b | 0.17 b | |
| Lower | 45.96(0.19) c | 24.32 c | 0.55(0.30) c | 0.77 b | 0.08 c | |
|
60 (207) | Upper | 244.46(1.00) a | 27.80 a | 2.34(1.00) a | 1.26 a | 0.22 a |
| Middle | 103.42(0.42) b | 27.62 a | 0.93(0.40) b | 1.34 b | 0.09 b | |
| Lower | 34.27(0.14) c | 26.98 b | 0.18(0.08) c | 1.41 c | 0.01 c | |
|
80 (245) | Upper | 201.63(1.00) a | 28.38 a | 1.50(1.00) a | 1.33 a | 0.14 a |
| Middle | 62.00(0.31) b | 28.17 b | 0.19(0.13) b | 1.43 b | 0.01 b | |
| Lower | 27.65(0.14) c | 27.98 c | 0.01(0.01) c | 1.48 c | 0.01 b | |
|
100 (270) | Upper | 393.07(1.00) a | 28.03 a | 1.85(1.00) a | 2.30 a | 0.11 a |
| Middle | 235.36(0.60) b | 27.76 b | 1.04(0.56) b | 2.31 ab | 0.04 b | |
| Lower | 166.21(0.42) c | 27.05 c | 0.78(0.42) c | 2.33 b | 0.03 c | |
|
120 (295) | Upper | 440.61(1.00) a | 29.35 a | 3.83(1.00) a | 1.13 a | 0.39 a |
| Middle | 122.76(0.28) b | 28.71 b | 0.78(0.20) b | 1.29 b | 0.07 b | |
| Lower | 53.78(0.12) c | 28.03 c | 0.05(0.01) c | 1.35 c | 0.01 c | |
| Significancey | ||||||
| A | *** | *** | *** | *** | *** | |
| B | *** | *** | *** | *** | *** | |
| A * B | *** | *** | *** | *** | *** | |
특히, 엽수가 증가함에 따라서 광량은 상부(1.0) 대비 중간부에서 0.73→0.44→0.42→0.31→0.60→0.28, 하부에서 0.43→0.19→0.14→0.14→0.42→0.12로 100엽을 착생한 시기를 제외하고 생장할수록(엽수가 증가할수록) 감소폭이 컸다. 하지만 중간부 대비 하부의 상대적 감소폭은 이러한 일정한 규칙을 나타나지 않았다. 파프리카의 광보상점 1.5klux(약 25µmol·m-2·s-1), 광포화점 30klux(약 500µmol·m-2·s-1)을 고려하여 실측된 값을 보면 본 온실에서는 상부에서 하부 모든 엽에서 광합성에 필요한 광화학에너지는 존재하는 것으로 판단된다. 하지만 엽에서는 흡수 파장 중 적색과 청색 파장의 비율이 매우 높으므로 하부 엽으로 갈수록 PAR에서 적색과 청색 파장의 비율이 낮아질 것으로 판단되어 엽의 면적당 광합성량은 구간 별 광량의 상대적 차이에 따르지 않을 것으로 생각된다.
엽온도 광량과 유사한 경향이었지만 구간별 평균값 차이가 크지 않았다. 이는 재배농가에서 외부 대비 높은 습도 유지, 수평 및 수직적 공기 유동을 잘 관리한 상태였고, 이러한 상태에서 직달 광에 의한 상부 엽온은 증가했지만 상대적으로 증산량 증가량이 많아 급격한 엽온 상승을 억제하였을 것으로 판단된다(Bange, 1953). 증산속도는 엽온과 달리 광량의 경향과 매우 유사하였다. 상부(1.0) 대비 중간부에서 0.73→0.55→0.40→0.13→0.56→0.20, 하부에서 0.49 →0.30→0.08→0.01 →0.42→0.01로 나타났다. 이로 보아 온도가 제어되는 온실에서는 증산속도에 엽온보다는 엽 주변 광량이 매우 크게 영향을 주는 것으로 생각된다. 특히, 기공 열림에 있어 적색 파장과 청색 파장 강도가 영향을 주는 것(Lurie, 1978)과 적색과 청색 파장의 흡수가 많은 것으로 고려하면 상부에서 하부로 갈수록 두 파장량은 감소하고 이에 증산속도도 감소할 것이다. 기공전도도도 구간 간 평균값 차이와 상부 대비 두 구간의 상대적 값의 차이에서 증산속도와 매우 유사한 경향을 나타내었다. 수증기압포차는 상부 대비 중간부와 하부의 상대적 값의 차이가 가장 적었다. 파프리카는 수직형으로 생장하는 작물로서 생장에 따라 하부 엽은 상부 엽의 그림자로 인해 도달 광량이 감소하여 하부 엽의 증산효율은 떨어지는 반면 상부 엽은 그림자의 방해가 감소되고 온실의 천장에 가까워지면서 엽수가 증가할수록 광량과 엽온이 높아지게 되고(Hellemans, 2006), 일사량이 증가하면 증산속도와 수증기압포차도 상응하여 증가한다는 기존 연구들 결과(Tai 등, 2010; Wilson과 Bunce, 1997)와 본 결과가 일치하였다.
구간이 아닌 식물체의 모든 엽의 측정값을 살펴보면, 생장함(엽수의 증가)에 따라서 모두 피크를 많이 포함하며 감소하는 경향을 나타내었다(Fig. 5). 대형 온실 환경 속에서는 상부에서 입사한 광이 아래로 엽 층을 따라 감소하는 경향을 나타내나 일률적인 경향을 나타내지는 않았다. 이는 한 식물체 및 주변 식물체의 엽수 증가에 따른 형태 및 공간구조 변화, 그늘 및 반사광 차이, 엽의 방향 차이 등 매우 다양한 광 환경과 증산요소 수준의 변화가 존재하기 때문으로 생각된다. 그리고 변화 점(피크)를 살펴보면, 엽온보다 광량이 해당 엽의 증산속도에 모든 엽에서 매우 유의하게 영향을 주는 것을 알 수 있다. 이는 앞에서 논한 기공 열림에 있어 적색 파장과 청색 파장 강도(Lurie, 1978)가 매우 크게 영향을 준 것으로 생각된다.
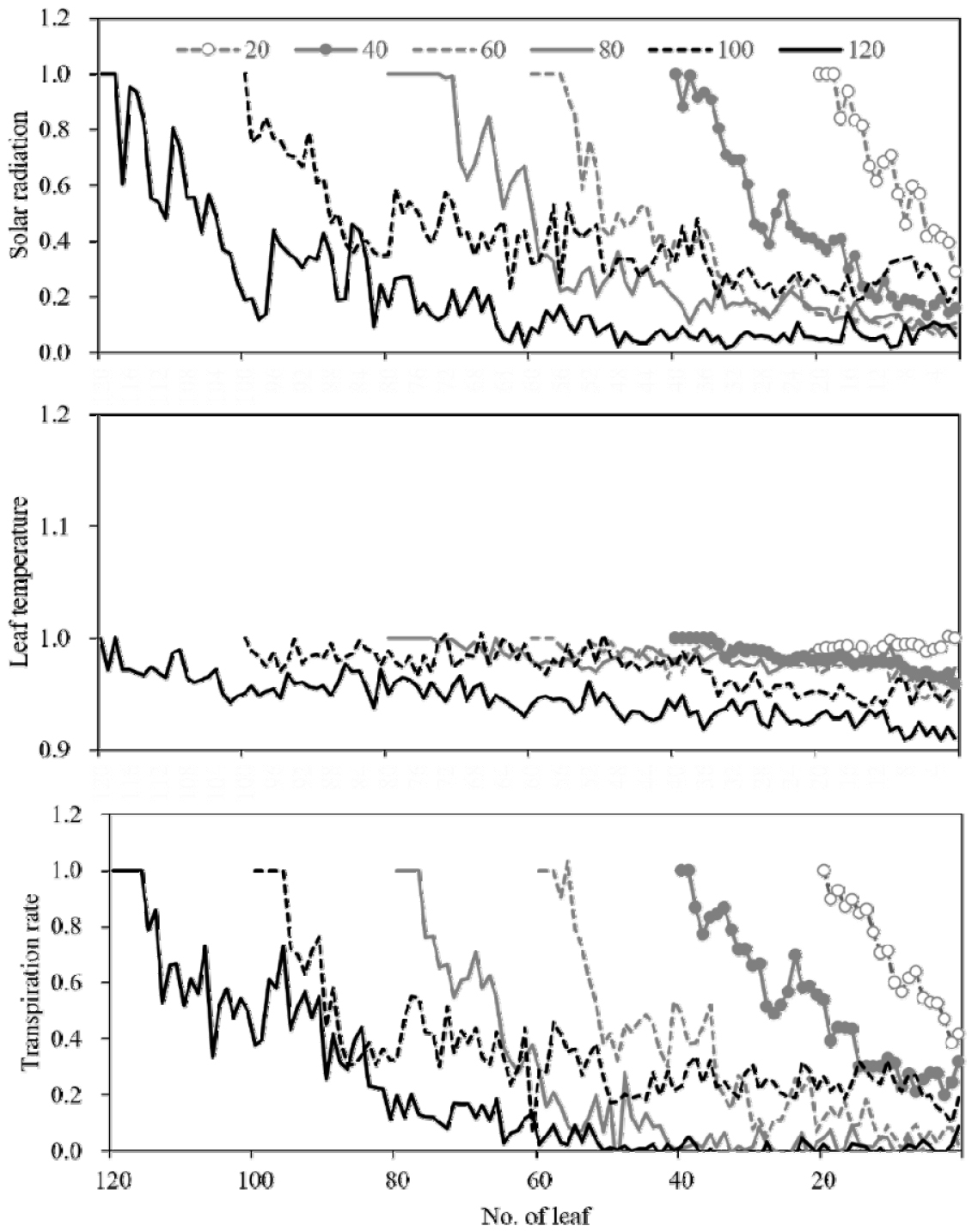
Fig. 5
Vertical changes in solar radiation, leaf temperature and transpiration rate of plant according to number of leaves of plant during paprika cultivation (from November 2022 to June 2023) in Venlo-type greenhouse. Ratio is calculated by X/Y ( X = values measured from the lower leaves than TL, Y = value measured from the top leaves (TL) of plant stem). Measured time :11:00-13:00.
Fig. 5를 회귀분석한 결과(Table 2), 재배 기간 동안 식물체의 수직적 분포에서 지속적으로 선형 회귀모형을 나타냈지만, 엽 주변 광량과 증산속도는 40엽이 착생하는 시기까지는 음의 선형 회귀함수, 그 이상에서는 음의 지수함수를 나타내었다.
상기 연구 결과들과 파프리카의 광보상점 1.5klux(약 25 PPFD)을 고려하면 온실 내에서 한 줄기에 60엽 이상이 되면 하부(20%) 내에 광 분포가 0에 가까운 온실 내 구역 및 식물체들이 증가할 것으로 판단된다.
Table 2.
Changes in solar radiation (SR), leaf temperature (LT), transpiration rate (TR) by three parts according to growth (= increase in leaves) of plant during paprika cultivation (from November 2022 to June 2023) in Venlo-type greenhouse.
| No. of leaves | Regression equation | R2 | |||||
| SR | LT | TR | SR | LT | TR | ||
| 20 | -0.0365x + 4.6957 | 0.0004x + 0.9521 | -0.0306x + 4.0764 | 0.9319***z | 0.2071* | 0.956*** | |
| 40 | -0.0218x + 2.639 | -0.0009x + 1.0685 | -0.0191x + 2.4376 | 0.8928*** | 0.8802*** | 0.9028*** | |
| 60 | 12.703e-0.043x | -0.0006x + 1.0381 | 28.904e-0.055x | 0.9341*** | 0.6016*** | 0.8885*** | |
| 80 | 3.1536e-0.031x | -0.0003x + 1.0058 | 5.9637e-0.055x | 0.9034*** | 0.449*** | 0.6546*** | |
| 100 | 0.7795e-0.011x | -0.0004x + 1.0041 | 0.7283e-0.012x | 0.6777*** | 0.5881*** | 0.6004*** | |
| 120 | 0.573e-0.024x | -0.0005x + 0.974 | 0.9259e-0.041x | 0.8196*** | 0.7485*** | 0.9183*** | |