서 론
재료 및 방법
1. 실험 재료 및 재배
2. 생장특성 조사
3. 항산화 활성, 총 페놀 함량, 플라보노이드 함량 분석
4. Triterpenoid 함량 분석 및 생산 수율
5. 통계 분석
결과 및 고찰
1. 병풀 두 품종의 생장 변화
2. 병풀 두 품종의 항산화 활성 및 총 페놀 함량
3. 병풀 두 품종의 추출 용매별 Triterpenoid 함량 비교
서 론
병풀(Centella asiatica L. Urban)은 산형화목 미나리과에 속하는 다년생 포복성 초본식물로 고온다습한 인도양의 열대지방에서 기원하였다(Hausen, 1993; Gohil 등, 2010). 병풀의 한국 자생지는 제주도 및 일부 남부 도서지역으로 알려져 있다(Kwon 등, 2008). 병풀은 가늘고 긴 포복경이 수평 방향으로 뻗으며, 뿌리가 내리는 포복경의 마디에서 2개의 비늘 모양의 잎이 발생한다. 잎은 2-5cm로 엽두와 엽저는 각각 원두형과 심장저 형태이며 둔거치가 발달한다(Gbolahan 등, 2016). Gohil 등(2010)은 다양한 형태적 특성을 나타내는 20종의 병풀이 존재한다고 보고하였다.
병풀은 아미노산, 페놀, Triterpenoids, 탄수화물 등 다양한 생리활성물질을 풍부하게 함유하고 있어(Belwal 등, 2019), 인도, 말레이시아, 중국 등에서 수백 년 동안 약용작물로 사용되어 왔다(Brinkhaus 등, 2000). 병풀의 대표적인 생리활성물질은 Madecassoside, Asiaticoside, Medecassic acid, Asiatic acid 등의 Triterpenoids 성분이며, Triterpenoids는 상처치료(Bonte 등, 1994; Shukla 등, 1999) 외에도 항염증(Liu 등, 2008; Yun 등, 2008), 항암(Cho 등, 2006), 항산화(Zhimin 등, 2017), 신경보호(Mook-Jung 등, 1999; Gohil 등, 2010) 효과를 나타내는 것으로 보고되어 있다.
병풀의 다양한 생리활성 효과로 인해 의약품 및 화장품 소재로 사용하기 위한 병풀의 국내 수요가 증가하고 있는 실정이다(Goo 등, 2018). 하지만 국내 병풀 자생지는 제주도 및 남부지방으로 제한적이기 때문에 대부분 인도, 마다가스카르 등에서 수입하여 이용해왔다(Baek, 1997). 최근 충북 충주 및 경남 합천에서 시설재배를 통해 병풀의 상업적 재배가 수행되고 있으나, 병풀의 기본적인 생장특성에 대한 연구는 매우 미흡한 실정이다. 또한 병풀을 활용한 대부분의 연구는 생리활성물질의 효과를 검증하는 것으로 매우 한정적이다(Shin 등, 2020). 하지만 식물의 생장특성과 생리활성물질의 함량은 품종과 재배환경에 영향을 받는다(Lee 등, 2014; Suh 등, 2020).
따라서 본 연구는 무가온 온실에서 동일 기간 동안 재배된 병풀 두 품종(‘자이언트 타이거 케어’, ‘굿병풀’)의 기본적인 생장 특성을 조사하였다. 또한, 두 품종에서 추출방법에 따른 항산화 활성 및 Triterpenoids 함량 분석을 수행하여 품종별 생장 특성에 따른 경제적 이용가치를 비교하였다.
재료 및 방법
1. 실험 재료 및 재배
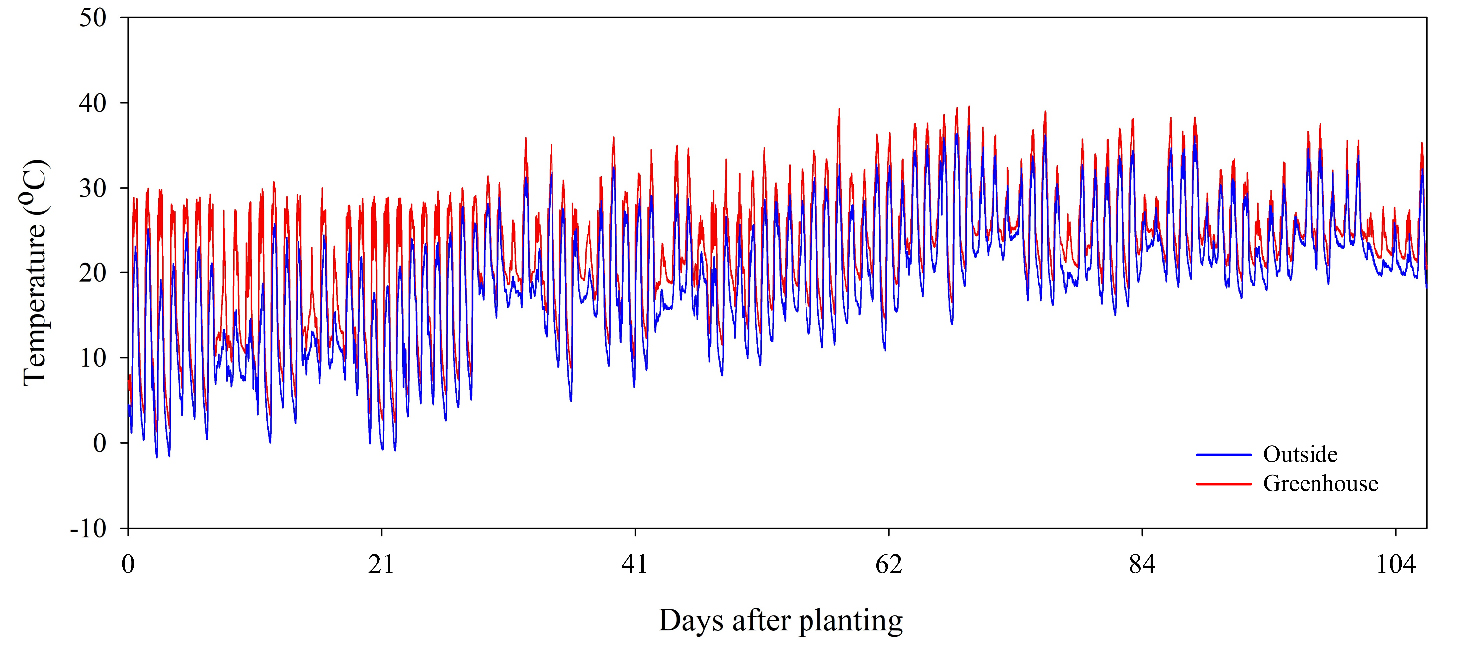
본 연구는 2020년 4월 3일부터 2021년 7월 16일까지 경상국립대학교 종합농장 내 무가온 유리온실(35°09'38.6"N, 128°04'40.0"E)에서 수행하였으며, 충청북도 충주시에 위치한 농업회사법인 ㈜병풀농원에서 구입한 ‘자이언트 타이커 케어’와 ‘굿병풀’을 재료로 사용하였다. 자체 제작한 총 2개의 배드(608 × 188cm)에 마사토와 원예용상토(Heungnong Bio Soil, Heungnong Seed Co., Korea)를 7:3(v:v)의 비율로 30cm 높이의 토양을 조성하였다. 병풀 두 품종의 모종을 각각 20 × 20cm 간격으로 112주씩 정식하여 2개의 배드에 총 224주를 정식하였다. 병풀의 기본적인 생장특성을 조사하기 위해 정식 후 약 3개월 후 수확하는 관행재배 방식을 참고하여 2020년 4월 3일에 정식하여 7월 16일(정식 후 104일)에 수확하였다. 정식 후 수확일까지 무가온 온실의 평균 온도는 주간 26.0 ± 6.1℃와 야간 17.6 ± 5.9℃(Fig. 1), 상대습도는 62.2 ± 20.8%였다(1-800-Loggers, Onset Computer Corporation, MA, USA). 강광을 차단하기 위해 배드에서 60cm 높이에 97% 차광막을 설치하였고, 식물체의 상부에서 평균 80μmol·m−2·s−1의 광도를 나타냈다(LI250A Light Meter, LI-COR Inc., USA). 뿌리가 활착될 때까지 매일 약 15L 정도 관수하였으며, 이후 2일마다 관수하였다.
2. 생장특성 조사
‘자이언트 타이거 케어’와 ‘굿병풀’의 뿌리 활착 후 2020년 4월 24일(정식 21일 후)부터 7월 16일(정식 104일 후)까지 3주 간격으로 기부엽의 엽폭, 엽장, 엽병길이를 자를 이용하여 조사하였다.
정식 104일 후 두 품종의 지상부를 수확하여 생체중, 건물중, 엽두께, 엽병두께, 엽면적, 엽록소, Hunter a*을 조사하였다. 미세저울(Ohaus Analytical Plus, Ohaus Corporation, NJ, USA)을 이용하여 생체중을 측정하였고, 건물중은 65℃에서 3일 동안 열풍건조(OF-02GW, JEIO TECH, Daejeon, Korea) 후 측정하였다. 엽두께와 엽병두께는 버니어켈리퍼스(BD500-200, Bluetec, Korea)를 이용하여 가장 두꺼운 부분을 측정하였고, 엽면적은 엽면적 측정기(LI-3100C, LI-COR, Lincoln, NE, USA)를 이용해 측정하였다. 잎의 엽록소 함량과 색(Hunter a*)을 측정하기 위해 엽록소 측정기(SPAD-502, Minolta, Osaka, Japan)와 색차계(CR-20, Minolta, Osaka, Japan)를 이용하였고, 기부엽의 중심 부위를 측정하였다.
3. 항산화 활성, 총 페놀 함량, 플라보노이드 함량 분석
정식 104일 후 수확한 ‘자이언트 타이거 케어’와 ‘굿병풀’의 식물체를 급속냉동기(QUICK FREEZER, Ilshin Biobase, Seoul, Korea)를 이용하여 -70℃로 냉동시킨 후 동결건조(FREEZE DRYER, Ilshin Biobase, Seoul, Korea)하였다. 동결건조된 건조물을 이용하여 냉수(25℃, water extract; WE), 열수(95℃, hot water extract; HWE), 50% 에탄올(50% EtOH extract; 50E), 70% 에탄올(70% EtOH extract; 70E) 추출을 수행하였다. 두 품종의 건물중의 20배(w/v)에 해당하는 용매를 첨가 후 25℃에서 48시간 침지하여 추출하였다. 각 추출물은 8,800 × g에서 20분 동안 원심분리 후 여과지(Whatman filter garde 1, GE Healthcare, Chicago, IL, USA)에 여과하여 침전물을 제거하였다. 여과지를 통과한 여과물은 40℃에서 감압농축(EYELA MG-2200, EYELA Co., Tokyo, Japan) 후 동결건조하였고, 냉수, 열수, 50% 에탄올, 70% 에탄올 추출물로 조제하였다.
냉수, 열수, 50% 에탄올, 70% 에탄올 추출물의 항산화 활성을 조사하기 위해 Ryu 등(2017)의 방법을 이용하여 2,2’- Azino-bis (3-ethylbenzthiazoline-6-sulfonic acid)(ABTS) 및 2,2-Diphenyl-1-picrylhydrazyl(DPPH) 자유라디컬 소거능과 Ferric Reducing Antioxidant Power(FRAP) 활성을 분석하였다. 표준물질로는 L-ascorbic acid를 이용하였고, 추출물의 항산화 활성은 mg 아스크로브산 당량 항산화 능력(ascorbic acid equivalent antioxidant capacity, AEAC)·g-1로 나타냈다.
두 품종의 4가지 추출물에 포함된 총 폴리페놀과 총 플라보노이드 함량은 비색법으로 조사하였다. 총 폴리페놀 함량은 Marinova 등(2005)의 방법에 따라 10µL의 추출물에 10µL의 2% Na2CO3와 200µL의 Folin-ciocalteu를 첨가 후 30분 동안 암상태에서 반응시켰다. 이 후, 분광 광도계(UV-1650PC, Shimadzu Co., Kyoto, Japan)를 이용하여 750nm 파장에서 흡광도를 측정하였다. 추출물 별 총 폴리페놀 함량은 갈산을 이용하여 검량선을 작성 후 mg 갈산 당량(gallic acid equivalent, GAE)·g-1로 나타냈다.
총 플라보노이드 함량 분석을 위해 20µL 추출물에 40µL의 80% 에탄올을 첨가 후 20µL의 Aluminium nitrate, 20µL의 1M Potassium Acetate, 150µL의 80% 에탄올을 순차적으로 첨가하였다. 이 후, 10분 동안 암상태에서 반응시킨 후 분광 광도계를 이용하여 415nm 파장에서 흡광도를 측정하였다. 추출물 별 총 플라보노이드 함량은 Quercetin을 이용하여 검량선을 작성 후 mg 퀘르세틴 당량(quercetin equivalent, QE)·g-1로 나타냈다(Stanković, 2011).
4. Triterpenoid 함량 분석 및 생산 수율
Triterpenoid 함량 분석을 위해 표준 화합물 Madecassoside, Asiaticoside, Madecassic acid, Asiatic acid(Sigma- aldrich, St. Louis, MO, USA)를 MeOH에 용해시키고 0.2μm Syringe Filter로 불용성 성분을 제거하였다. WE, HWE, 50E, 70E의 용매추출물을 High-performance Liquid Chromatography (Agilent 1200 series, Agilent, Santa Clara, USA)를 이용하여 분석하였다. 검출기는 Diode array detecter(DAD, 250nm)를 이용하였고, 고정상은 YMC Triart C18(4.6 × 250mm, YCM Co., Ltd., Kyoto, Japan), 이동상은 Acetonitrile(Sigma-Aldrich, St. Louis, MO, USA)과 Deionized Water를 이용하였다. Column 온도는 30℃에서 유지한 후 1.5mL·min1 유속에서 20μL의 시료를 주입하였다.
병풀 두 품종의 단위면적 당 Triterpenoid 생산 수율은 다음의 식 [단위면적(3.3m2)당 개체수 × 생체중(g) × 총 triterpenoid 함량(mg·g-1)]을 통해 계산하였다.
5. 통계 분석
두 품종 간의 생육특성에 대한 유의성을 검정하기 위해 R software v3.6.0을 이용하여 t-test를 수행하였다. 또한 두 품종의 생육시기에 따른 생육특성의 유의성과 추출물의 항산화 활성 및 총 폴리페놀과 총 플라보노이드 함량의 유의성을 검정하기 위해 분산분석(ANOVA) 후 5% 유의수준에서 던컨의 다중검정(Duncan’s multiple range test)을 수행하였다.
결과 및 고찰
1. 병풀 두 품종의 생장 변화
병풀 두 품종의 정식 후 수확시기까지의 생장 변화를 조사한 결과, 생장 초반인 정식 21일 후 엽폭은 ‘자이언트 타이거 케어’가 ‘굿병풀’보다 유의적으로 넓었으나, 정식 후 62일까지 두 품종의 엽폭은 유의적인 차이가 없었다(Fig. 2A). 하지만 정식 후 84일부터 104일까지 ‘자이언트 타이거 케어’의 엽폭이 ‘굿병풀’보다 유의적으로 증가하였다. 또한 정식 41일 후 ‘굿병풀’의 엽장과 엽병이 ‘자이언트 타이거 케어’보다 유의적으로 증가하였으나 이후 두 품종의 생장 속도는 유사하였다(Fig. 2B, C). 하지만 정식 후 84일부터 수확일까지 ‘자이언트 타이거 케어’의 생장이 지속적으로 증가하여 수확일에는 ‘굿병풀’보다 높았다(Fig. 2). 특히 ‘굿병풀’은 수확일에 엽폭과 엽장이 유의적으로 감소하였다(Fig. 2A, B). 수확일에 ‘자이언트 타이거 케어’와 ‘굿병풀’의 생장 양상이 다른 이유는 두 품종간의 수확기 차이 또는 여름철 고온에 대한 민감성의 차이가 원인일 것으로 생각된다. 본 연구에서는 ‘굿병풀’이 여름철 고온기에 현저한 생장 저하를 나타내는 것을 관찰하였지만 이에 대한 면밀한 분석이 어려웠으며, 추후 안정적인 병풀 생산을 위한 병풀 품종별 수확시기 및 고온처리에 의한 생장 변화에 대한 연구가 필요할 것으로 생각된다.
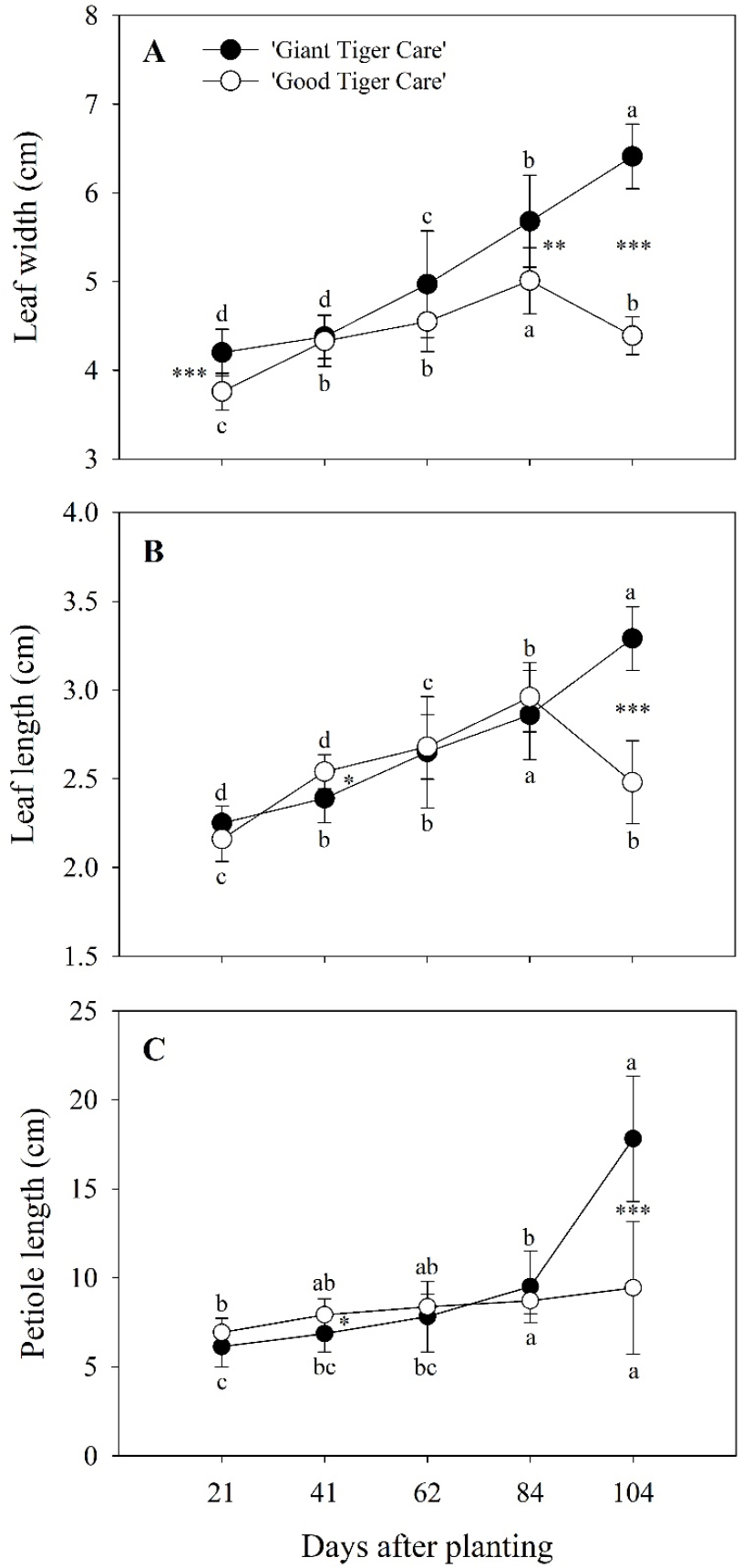
Fig. 2
Changes in leaf width (A), length (B), and petiole length (C) of ‘Giant Tiger Care’ and ‘Good Tiger Care’ from 21 to 104 days after planting in 2020. Data are presented as mean ± SD (n = 10). Different letters indicate significant difference in growth characteristic between the investigation dates, according to the Duncan’s multiple range test (p < 0.05). *, **, and *** indicate significant differences at p < 0.05, p < 0.01, and p < 0.001, respectively according to the t-test.
정식 후 104일에 두 품종의 식물체를 수확하여 생장특성을 조사한 결과(Table 1), 엽두께는 ‘자이언트 타이거 케어’가 0.43 ± 0.55mm, ‘굿병풀’은 0.46 ± 0.08mm로 두 품종간의 유의적인 차이가 없었다. 엽면적은 ‘자이언트 타이거 케어’가 ‘굿병풀’보다 2.3배 넓고, 엽병두께가 1.6배 두꺼워 생체중이 2배 높았다. 건물중은 ‘자이언트 타이거 케어’가 ‘굿병풀’보다 유의적으로 2배 높았으나, 수분함량은 두 품종에서 82%로 유의적인 차이가 없었다. 이는 ‘자이언트 타이거 케어’가 ‘굿병풀’보다 엽면적, 엽병길이 및 두께, 생체중이 유의적으로 높기 때문에 건물중 총량 또한 높은 것으로 생각된다. SPAD로 측정된 엽록소 함량은 두 품종 간 유의적인 차이는 없었으나 Hunter a*는 ‘자이언트 타이거 케어’와 ‘굿병풀’에서 모두 음의 값을 나타내어 녹색이며, ‘자이언트 타이거 케어’가 ‘굿병풀’보다 Hunter a*가 유의적으로 낮아 더 짙은 녹색이었다. Prasad 등(2014)는 인도-갠지스 평원에서 상업적으로 재배되는 엽면적이 다른 4개 병풀 품종의 엽록소 함량이 엽면적과 비례하지 않는다고 보고하였다. 따라서 두 병풀 품종의 식물체 크기와 관련된 생장 특성은 품종에 따른 유전적 소질에 의한 것으로 생각된다(Valadabadi와 Farahani, 2010; Hokmalipour와 Darbandi, 2011). 또한, Madeira 등(2003)은 SPAD 값과 Hunter a*간의 상대적으로 낮은 상관관계를 보고하였다. 따라서 병풀 두 품종의 엽록소 함량과 Hunter a*는 관련이 낮은 것으로 생각되며, 엽록소 함량과 엽색은 병풀 품종 별 특성으로 생각된다.
Table 1.
Growth characteristics of ‘Giant Tiger Care’ and ‘Good Tiger Care’ after harvest on July 16, 2020.
| Cultivar | Leaf thickness (mm)z |
Leaf area (cm2) |
Leaf fresh weight (g) |
Leaf dry weight (g) |
Petiole thickness (mm) |
Relative water content (%) |
Chlorophyll (µmol·m2) | Hunter a* |
| ‘Giant Tiger Care’ | 0.43 ± 0.05 | 7.80 ± 0.95 | 0.44 ± 0.06 | 0.08 ± 0.01 | 2.31 ± 0.22 | 81.81 ± 1.23 | 29.51 ± 3.75 | -8.89 ± 0.62 |
| ‘Good Tiger Care’ | 0.46 ± 0.08 | 3.43 ± 0.31 | 0.23 ± 0.04 | 0.04 ± 0.01 | 1.41 ± 0.21 | 82.34 ± 2.05 | 30.37 ± 4.59 | -8.19 ± 0.47 |
| Significancey | NS | *** | *** | *** | *** | NS | NS | * |
2. 병풀 두 품종의 항산화 활성 및 총 페놀 함량
ABTS와 DPPH 분석을 통한 품종별 항산화 활성은 냉수 및 열수 추출물보다 50%, 70% 에탄올 추출물에서 유의하게 높았다(Table 2). 하지만 ‘자이언트 타이거 케어’의 에탄올 추출물의 항산화 활성은 ‘굿병풀’의 에탄올 추출물보다 유의적으로 높았다. FRAP 분석을 통한 환원능 또한 두 품종에서 모두 에탄올 추출물에서 높았으며, ‘자이언트 타이거 케어’의 환원능은 ‘굿병풀’의 환원능보다 높았다. 특히 두 품종에서 모두 70% 에탄올 추출물의 항산화 활성이 유의적으로 가장 높았다.
Table 2.
Extraction yield, antioxidant activity, total polyphenol and flavonoid content in four extracts of ‘Giant Tiger Care’ and ‘Good Tiger Care’.
| Cultivar | Extractz |
Yield (w/w%) |
ABTS (mg AEAC·g-1)y |
DPPH (mg AEAC·g-1) |
FRAP (mg AE·g-1) |
Total polyphenol (mg GAE·g-1) |
Total flavonoid (mg QE·g-1) |
| ‘Giant Tiger Care’ | WE | 26.3 | 99.0 ± 2.4 B,abx | 99.2 ± 0.4 C,c | 98.4 ± 3.0 AB,ab | 117.1 ± 2.8 E,b | 24.1 ± 0.6 C,c |
| HWE | 26.6 | 74.0 ± 0.4 E,c | 62.4 ± 1.8 F,d | 68.0 ± 1.4 E,c | 109.6 ± 3.1 EF,b | 18.4 ± 1.7 E,d | |
| 50E | 31.7 | 97.2 ± 4.7 B,b | 104.1 ± 2.0 B,b | 94.1 ± 3.6 B,b | 199.4 ± 7.7 B,a | 30.5 ± 2.2 B,b | |
| 70E | 30.7 | 103.6 ± 1.1 A,a | 110.1 ± 2.4 A,a | 100.1 ± 1.9 A,a | 215.4 ± 16.3 A,a | 34.7 ± 1.9 A,a | |
| ‘Good Tiger Care’ | WE | 27.6 | 43.1 ± 3.7 G,d | 33.9 ± 0.5 H,d | 40.5 ± 1.0 G,d | 102.3 ± 3.2 F,c | 7.7 ± 0.8 G,c |
| HWE | 28.8 | 64.2 ± 1.7 F,c | 53.3 ± 1.2 G,c | 58.4 ± 2.6 F,c | 97.0 ± 2.0 F,c | 12.2 ± 1.5 F,b | |
| 50E | 30.3 | 78.9 ± 1.0 D,b | 77.3 ± 0.7 E,b | 77.0 ± 2.4 D,b | 154.5 ± 5.6 D,b | 19.7 ± 0.3 DE,a | |
| 70E | 29.8 | 84.9 ± 1.4 C,a | 88.6 ± 2.0 D,a | 87.1 ± 4.5 C,a | 177.7 ± 2.5 C,a | 21.6 ± 1.2 D,a |
총 페놀 함량 또한 두 품종에서 모두 에탄올 추출물에 가장 많이 포함되어 있었다. 이는 병풀을 포함한 여러 작물에서 총 페놀 함량이 에탄올과 같은 유기용매 추출물에서 더 높았던 결과와 같다(Shin 등, 2020; Hong 등, 2021). 또한 두 품종에서 모두 에탄올 추출물의 수율이 냉수 및 열수 추출물보다 높았기 때문에 에탄올 추출물의 총 폴리페놀과 총 플라보노이드 함량이 냉수 및 열수 추출물보다 높은 것으로 생각된다.
품종별 에탄올 추출물의 총 페놀 함량을 비교한 결과, ‘자이언트 타이거 케어’에서 ‘굿병풀’보다 유의적으로 많은 총 페놀을 함유하였다. 두 품종에서 모두 총 페놀 함량이 가장 높았던 70% 에탄올 추출물을 기준으로 총 폴리페놀 함량은 ‘자이언트 타이거 케어’(215.4 ± 16.3mg GAE·g-1)가 ‘굿병풀’(177.7 ± 2.5mg GAE·g-1)보다 약 1.2배 높았으며, 총 플라보노이드 함량은 ‘자이언트 타이거 케어’(34.7 ± 1.9mg QE·g-1)가 ‘굿병풀’(21.6 ± 1.2mg QE·g-1)보다 약 1.6배 높았다. 동일한 환경조건에서 재배된 병풀 두 품종의 추출물의 항산화 활성과 총 폴리페놀, 총 플라보노이드 함량이 ‘자이언트 타이거 케어’가 ‘굿병풀’보다 높은 이유는 동일한 환경조건 내에서도 여름철 고온에 반응하는 품종별 유전적 소질의 차이에 의한 것으로 생각된다.
두 품종에서 항산화 활성이 높을 수록 총 페놀 함량이 높은 이유는 항산화 활성과 총 페놀 함량 간의 높은 상관성 때문으로 생각된다. Song 등(2010)은 중국의 약용작물의 메탄올 추출물의 총 페놀 함량과 항산화 활성을 분석하여 항산화 활성과 총 페놀 함량 간의 높은 상관관계(r2=0.90)를 확인하였다. Kiselova 등(2006) 또한 불가리아의 약용 작물의 추출물에서 항산화 활성과 총 페놀 함량간의 높은 상관관계(r=0.92)를 확인하였다. 병풀의 총 페놀 함량 또한 항산화 활성과 고도의 상관관계(r2=0.90)를 갖는 것으로 보고되었다(Zainol 등, 2003).
3. 병풀 두 품종의 추출 용매별 Triterpenoid 함량 비교
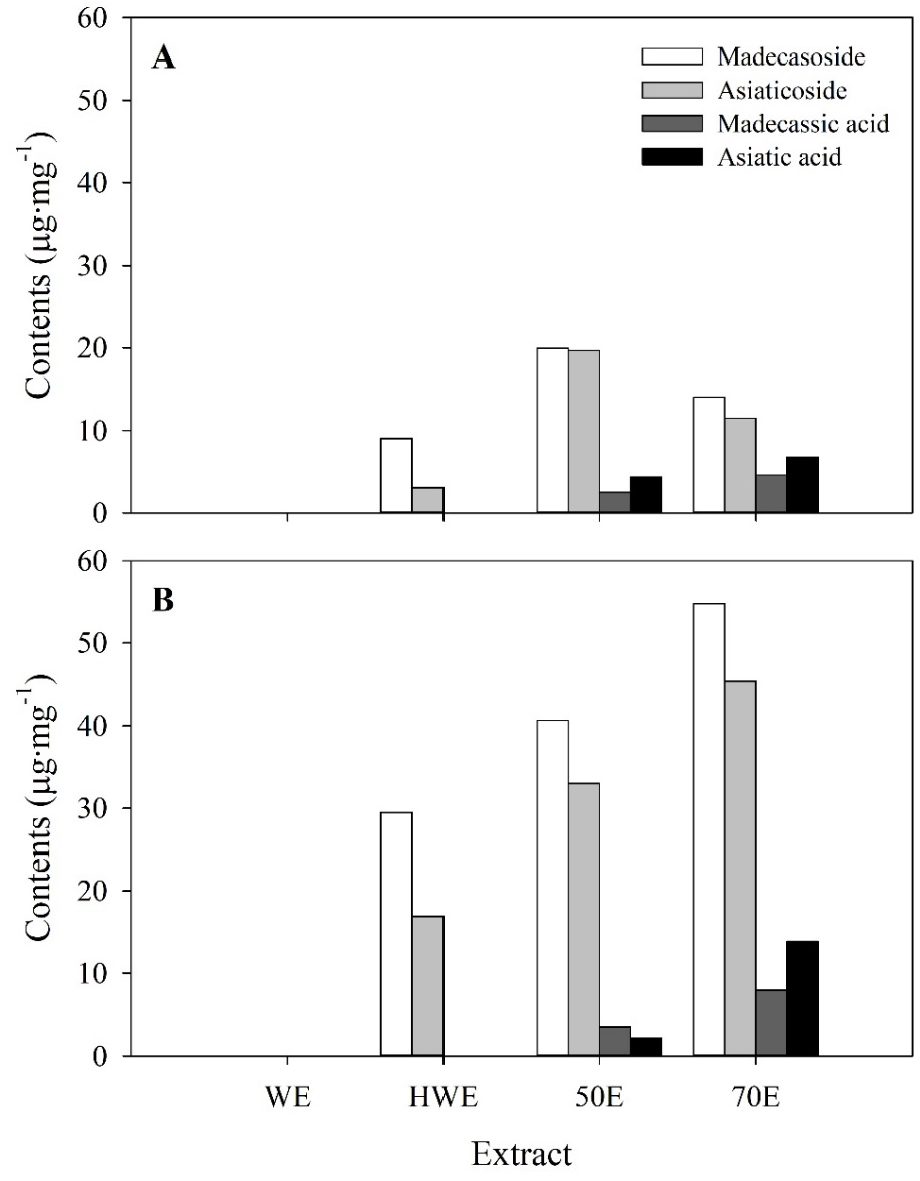
정식 후 104일에 수확한 두 품종을 이용하여 4종류의 용매에 따른 Triterpenoid의 추출 함량 및 효율을 확인하였다(Fig. 3). 냉수 추출물에서는 두 품종에서 모두 Triterpenoid가 검출되지 않았다. 열수 추출물에서는 ‘자이언트 타이거 케어’와 ‘굿병풀’ 모두 Madecassoside와 Asiaticoside만이 검출되었다. Shin 등(2020) 또한 ‘굿병풀’을 이용하여 용매 추출물 별 주요 Triterpenoid 함량을 분석한 결과 냉수 추출물에서는 4가지 Triterpenoids가 검출되지 않았고, 열수 추출물에서는 Madecassoside와 Asiaticoside만이 검출되었다고 보고하였다. 물은 극성 용매로서 식물에서 검출되는 유기화합물을 효율적으로 용해시킬 수 없고(Tommasini 등, 2004; Ong 등, 2006), 병풀의 4가지 Triterpenoids는 극성이 낮아 물에 용해되기 어렵다(Zhao 등, 2010). 열수는 상온의 물보다 극성이 낮고, Madecassoside와 Asiaticoside는 Madecassic acid와 Asiatic acid보다 입자의 크기가 작아 열수 추출물에서 검출된 것으로 생각된다(Kim 등, 2009).
50% 에탄올 추출물과 70% 에탄올 추출물에서는 4가지 Triterpenoid가 모두 검출되었다. Puttarak과 Panichayupakaranant(2013) 또한 에탄올 추출물에서 병풀의 Pentacylic triterpenes 추출 효율이 가장 높았다고 보고하였다. 본 연구에서는 ‘자이언트 타이거 케어’는 50% 에탄올 추출물에서 Madecassoside와 Asiaticoside의 검출량이 가장 높았고, Madecassic acid와 Asiatic acid는 70% 에탄올 추출물에서 검출량이 가장 높았다. ‘굿병풀’에서는 4가지 Triterpenoids 모두 70% 에탄올 추출물에서 검출량이 가장 높았다. 따라서 Madecassic acid와 Asiatic acid의 추출 효율을 증진하기 위해서는 상대적으로 높은 농도의 에탄올을 용매로 하는 것이 효율적일 것으로 생각된다.
두 품종의 4가지 Triterpenoids 함량을 비교한 결과, ‘자이언트 타이거 케어’와 ‘굿병풀’ 모두 Madecassic acid와 Asiatic acid보다 Madecassoside와 Asisticoside가 월등히 많이 검출되었다. 따라서 두 품종 모두 선행 연구들의 보고와 동일하게 Triterpenoids 중 Madecassoside와 Asisticoside가 주성분으로 생각된다(Zheng과 Qin, 2007).
‘자이언트 타이거 케어’에서 Triterpenoid 검출 효율이 높았던 50% 에탄올 추출물에서는 ‘굿병풀’이 ‘자이언트 타이거 케어’보다 Madecassoside와 Asiaticoside의 함량이 각각 2.0배, 1.7배 높았다. ‘굿병풀’에서 추출 효율이 높았던 70% 에탄올 추출물에서는 ‘굿병풀’이 ‘자이언트 타이거 케어’보다 Madecassoside와 Asiaticoside의 함량이 약 3.9배 높았다. ‘자이언트 타이거 케어’의 총 Triterpenoids 함량은 50% 에탄올 추출물과 70% 에탄올 추출물에서 각각 46.53, 37.01µg·mg-1이었고, ‘굿병풀’은 79.37, 121.86µg·mg-1이었다. 에탄올은 독성이 낮고 식품제조에도 이용가능한 용매이다(Puttarak과 Panichayupakaranant, 2013). 따라서 Triterpenoids 추출 효율을 증진시키기 위해 ‘자이언트 타이거 케어’와 ‘굿병풀’ 모두 에탄올 추출법을 이용하며, ‘자이언트 타이거 케어’는 50% 에탄올을 용매로 이용하고 ‘굿병풀’은 70% 에탄올을 이용하는 것이 효과적일 것으로 생각된다.
정식 후 104일의 ‘자이언트 타이거 케어’와 ‘굿병풀’의 3.3m2 당 개체수는각각 120, 40개체로 ‘자이언트 타이거 케어’의 생장 및 번식속도가 훨씬 높은 것으로 조사되었다(data not shown). 총 Triterpenoids 함량이 가장 높았던 추출물을 기준으로 하여 Triterpenoids 생산수율을 계산한 결과, ‘자이언트 타이거 케어’는 3.3m2 당 2.459mg[120개체 × 생체중 0.436g × 총 Triterpenoids 0.047mg·g-1(50E)]이었고, ‘굿병풀’은 1.103mg[40개체 × 생체충 0.226g × 총 Triterpenoids 0.122mg·g-1 (70E)]으로, ‘자이언트 타이거 케어’가 2.2배 더 높았다. 따라서 단위면적 당 생산 가능한 총 Triterpenoids 함량이 많은 ‘자이언트 타이거 케어’를 재배하는 것이 경제적일 것으로 생각된다.