서 론
식물공장은 급격한 기후변화, 환경오염 문제와 식량부 족문제를 해결하기 위한 대안으로 떠 오르고 있다. 최근 들어 인공광 식물공장 실용화를 위한 다양한 연구가 진 행되고 있다(Ikeda 등,1992; Heo 등, 2010; Inden 등, 2011; Lee 등, 2015; Lee 등, 2016).
케일(Brassica oleracea L. acephala)은 십자화과 채소 로 남부 유럽의 지중해 연안이 원산지로 곱슬케일, 쌈케 일, 꽃케일 등이 있다. 현재 전 세계에서 폭넓게 재배되 고 있으며, 조혈작용, 청혈작용 하는 것으로 알려져 있 다. 영양학적으로 글루코시놀레이트(glucosinolate, GLS)를 다량 함유하고 있다(Schmit 등, 2010). GLS는 Brasscica속 식물에서 생합성되는 대표적인 phytoalexin으로 100여종 이 존재하며(Pedras 등, 2011; Mithen, 1992), 질소와 황 이 함유된 이차대사 산물로 작물의 독특한 맛과 향을 결정할 뿐만 아니라 생체내에서 다양한 기능성을 발휘하 는 것으로 알려져 있다(Pedras 등, 2011).
순무 잎에 4 종류의 GLS가 동정되었으며, 잿빛곰팡이 병에 대한 저항성을 나타내는 중요한 물질임을 시사하고 있다(Kwon과 Kliebenstein, 2014). GLS는 식물체의 병해 충 저항성, 종자 내 발아억제 물질 활성, 천연 살균제 등 의 활성이 보고되었으며, 항암작용, 항세균 및 항산화 활 성을 나타내며(Glivetic 등, 2008; Angelini, 1998), 일부 화 합물은 가축이 섭취할 경우 고창증을 유발하는 것(Barth and Jander, 2006; Hansen 등, 2008; Mithen, 1992)으로 알 려져 있다. 형광등+적색 LED 조건에서 Bra029355 등 몇 종류의 유전자의 발현이 증가되었고, 형광등+청색일 때 GLS의 합성이 증가하였다(Moon 등, 2015). Hertog 등(1992)은 케일에는 페놀 물질(Jahangir 등, 2009), 플라보노 이드의 일종인 kaemperol은 211mg·kg-1으로 양파(2mg·kg-1), 브로콜리(72mg·kg-1)보다 월등히 높다고 보고하였다.
글루코시놀레이트는 황과 질소를 함유한 십자화과 식 물의 2차대사산물로 알려져 있다. 글루코시놀레이트는 구 조와 아미노산의 선구물질에 따라 methionine, isoleucine, leucine이나 valine에서 유래한 aliphatic glucosinolates, phenylalanine이나 tyrosine에서 유래한 aromatic glucosinolates, tryptophan에서 유래한 indole glucosinolates 등 3 가지로 구분할 수 있다(Ivana et al., 2008).
케일은 소비량의 증가에 따른 주년 소비 패턴 정착시 키기 위하여 식물공장에서 안정적인 생산과 기능성 연구 가 필요하다. 따라서, 본 연구는 케일 인공광 식물공장 에서 인공광원에 따른 생육과 GLS 등 품질에 함량에 미치는 영향을 구명코자 실시하였다.
재료 및 방법
시험개요
본 연구는 농촌진흥청 국립농업과학원 전주 식물공장 에서 수행하였다. 2015년 3월 10일 스펀지(28×28mm) 파종하여 105구 육묘 트레이에서 육묘하였다. 4월 14일 정식하여 5월 26일 수확을 종료하였다.
처리내용 및 재배관리
케일의 광원을 달리하여 LED B:W(1:1, BW), R:B:W(2:1:3, RBW), B:W(1:1)+형광등(BW+FL) 등 3처 리를 하였으며(Fig. 1), 각 재배장치는 분무경 방식으로 광원을 적색, 청색, 적색의 광량을 각각 조절할 수 있는 시스템이었다. BW+FL 처리구는 베드(길이 2,100mm) 상단 LED 밑에 T5 형광등을 19개를 추가로 설치하였다. 인공광원은 작물과의 높이를 조절과 자체 광량을 조절하 여 광량자속 밀도를 150μmol·m-2·s-1로 맞추었다. 분무경 베드는 2,100×800×300(mm)이었으며, 바닥에서 분무경 재배장치 상단까지 높이는 112cm이었다. 재배장치의 외 관 크기(가로×세로×높이)는 2,200×800×1,870(mm)이었다. 표준 배양액은 일본원시 표준액(N-P-K-Ca-Mg=17.33-4-8-8-4me·L-1)을 사용하였으며, 양액 공급은 24시간 공급 하였다. 배양액의 pH와 EC는 각각 6.2과 1.5ds·m-1으로 주기적으로 보정하였으며, 배양액은 2주 간격으로 전량 교체하였다. 식물공장의 일장은 12시간이었으며, 재배실 온도는 22±0.5°C이고, 습도 50%이었다. 이산화탄소는 별 도로 시용하지 않았으며, 400±100μmol·mol-1이었다.
생육 조사 및 성분 분석
케일의 생육과 수량 특성은 농업과학기술연구조사분 석기준(농촌진흥청, 2012)을 따랐으며, 엽장, 엽폭, 엽수, 엽록소 함량, 생체중, 건물중 등을 측정하였다.
글루코시놀레이트(GLS) 함량을 분석하기 위하여 동결 건조된 시료 100mg을 취하여 1mL의 70% methanol를 넣어 60분간 중탕시켜 추출 후 4°C, 10,000rpm에서 10 분간 원심분리하였다. 반복하여 침전물을 재추출하여 상 등액을 모았다. Crude GSL 추출물을 Mini Bio-Spin chromato-graphy column (Bio-Rad Laboratories, Hercules, CA, USA)에 load 하였다. 컬럼은 0.5mL의 DEAESephadex A 25 anion exchange resin으로 충진되었으며, 분석 전에 0.1M sodium acetate (pH 4.0) 용액으로 활성 화시켰다. 그 후 추출액을 DEAE column에 흘렸다. Sulfatase 200μL 넣고 밀봉하여 상온에서 24시간 방치하 였다(EC 3.1.6.1, type H-1 from Helix pomatia). Desulfo- GSLs를 3차 증류수 1.5mL로 3회 추출하고 0.2μm syringe filter로 filtering하였다. Agilent technologies 1260 Infinity HPLC system (Agilent technologies, Santa Clara, CA, USA)을 분석하였으며, column은 Acquity UPLC® BEH-C18 column (1.7μm, 2.1×100mm; Waters Co.)을 사 용하였다. Photodiode array (PDA) detector로 229nm에서 검출하였다. Solvent는 모두 0.2μm로 filtering하였고, solvent A는 100% water이며, solvent B는 20% acetonitrine (ACN)을 사용하였다. Flow rate는 분당 0.2μL이었으며, Retention time은 25분이었다. Gradient는 시작은 A 99%, B 1%이며, 6분까지 A 1%, B 99%로 변화를 주고, 6 분부터 14분까지는 동일하게 유지하였으며, 14분부터 15분까지 A 99%, B 1%로 변화를 주고 25분까지 유지 하였다.
수분 함량은 신선 엽을 열풍건조기로 80°C와 105°C에 서 측정하였다. 조단백은 분쇄 시료 1.0g과에 kjeltabs 2 알과 황산 12mL를 넣고 분해하여 조단백 정량 장치 (Kjeltec 2300, Foss, USA)로 분석하였다. 조지방 함량은 ether를 NaOH로 탈수 soxhlet 고체 연속 추출기로 6시 간 추출하여 정량하였다. 조회분은 시료를 회화로 200°C 에 2시간 태운 후 600°C에 4~5시간 태워 측정하였다.
결과 및 고찰
수확 엽수는 BW+FL에서 14.4개로 BW 12.5개와 RBW 12.3개보다 유의적으로 증가하였다(Table 1). Lee 등(2016)의 보고에 의하면 광질에 따른 방풍의 수확 엽 수는 RB, RBW, RBGW 등 LED 처리보다 형광등 처리 에서 19.7개로 가장 많았다. 수확 엽 생체중은 BW+FL 이 93.9g/plant으로 가장 무거웠으며, BW가 74.4g/plant1, RBW가 66.2g/plant로 처리마다 유의성을 나타냈다. 방 풍나물의 엽중은 LED RBW(2:1:3)와 RB(1:1)가 형광등 과 통계적인 유의성을 나타냈다(Lee 등, 2016). BW+FL 에서 케일의 수량이 높았던 것은 BW에 연속 파장인 FL 을 보강하여 생육을 극대화 시킨 것으로 생각된다. 엽 건 물중은 수확 엽수와 같은 경향으로 BW+FL이 9.7g/ plant으로 가장 무거워 다른 처리와 유의성을 나타냈다. 건물율은 RBW에서 8.8%로 가장 높았다. 로메인상추의 엽 건물중이 R:B:W(1:1:1)보다 R:B(1:1)에서 높았으나 (Kim 등, 2014), Lee 등(2016)은 방풍나물의 엽 건물중 은 LED 구성비를 달리 했을 때 처리간에 유의성을 나 타내지 않는다고 보고하였다. 이는 LED 조합 비율이 다 르고 작물에 따라 달라 생육 반응이 달랐기 때문이라고 생각된다.
Table 1.
Characteristics of number of harvested leaves, fresh and dry leaf weight, percentage of dry matter of leaves according to different artificial light sources of hydroponically grown kale in plant factory.
| Treatments | No. of harvested leaves | Fresh leaf weight (g•plant-1) | Dry leaf weight (g•plant-1) | Percentage of dry matter (%) |
|---|---|---|---|---|
| BW | 12.5 bz | 74.4 b | 9.1 b | 8.6 b |
| BW+FL | 14.4 a | 93.9 a | 9.7 a | 8.4 c |
| RBW | 12.3 b | 66.2 c | 9.0 b | 8.8 a |
엽병장은 처리에 따라 5.1~5.6cm로 처리간에 유의성 을 나타내지 않았으며, 엽장은 BW에서 18.8cm로 다른 처리보다 작았다(Table 2). 엽폭은 RBW(2:1:3)에서 14.4cm로 가장 넓어 다른 처리와 통계적인 유의성을 나 타냈으나, 엽후는 처리간에 0.037~0.040mm로 처리간에 유의성을 나타내지 않았다. 식물공장에서 재배한 방풍나 물의 엽장과 엽후는 인공광원에 따라 차이가 없으나, 엽 폭은 형광등과 RB(1:1)에서 우수하여 RBW(2:1:3)와 RBGW(2:1:0.5:3) 처리와 유의성을 나타냈다(Lee 등, 2016)고 보고하였다. ‘콜라로사’ 상추의 생육은 적청 혼 합광에서 우수하였고(Shin 등, 2012), ‘홍하 적축면’ 상 추의 생육이 적청 혼합광보다 단색 적색광에서 높았다 (Lee, 2010)고 보고하였다. 결과적으로 작물의 종류에 따 라, 같은 작물이라도 품종에 따라 LED에 대한 생육 반 응이 다르다는 것을 시사하고 있다.
Table 2.
Characteristics of petiole length, leaf length, width, and thickness according to different artificial light sources of hydroponically grown kale in plant factory.
| Treatments | Petiole length (cm) | Leaf length (cm) | Leaf width (cm) | Leaf thickness (mm) |
|---|---|---|---|---|
| BW | 5.1 a | 18.8 b | 12.1 b | 0.039 a |
| BW+FL | 5.4 a | 20.5 a | 13.0 b | 0.040 a |
| RBW | 5.6 a | 19.0 ab | 14.4 a | 0.037 a |
광원에 따른 엽록소 함량은 57.3~59.3으로 처리간에 유의성이 없었으며, 명도도 같은 경향이었다(Table 3). ‘a’ 값과 ‘b’ 값은 BW와 RBW에서 가장 낮았다.
Table 3.
Characteristics of chlorophyll content and Hunter’s color values according to different artificial light sources of hydroponically grown kale in plant factory.
| Treatments | Chlorophyll content (SPAD Value) | Hunter s color value | ||
|---|---|---|---|---|
| L | a | b | ||
| BW | 59.3 a | 33.07 a | 7.14 ab | 8.14 a |
| BW+FL | 58.3 a | 34.64 a | 6.51 b | 7.15 b |
| RBW | 57.3 a | 32.98 a | 7.31 a | 8.68 a |
글루코시놀레이트와 조단백질 함량
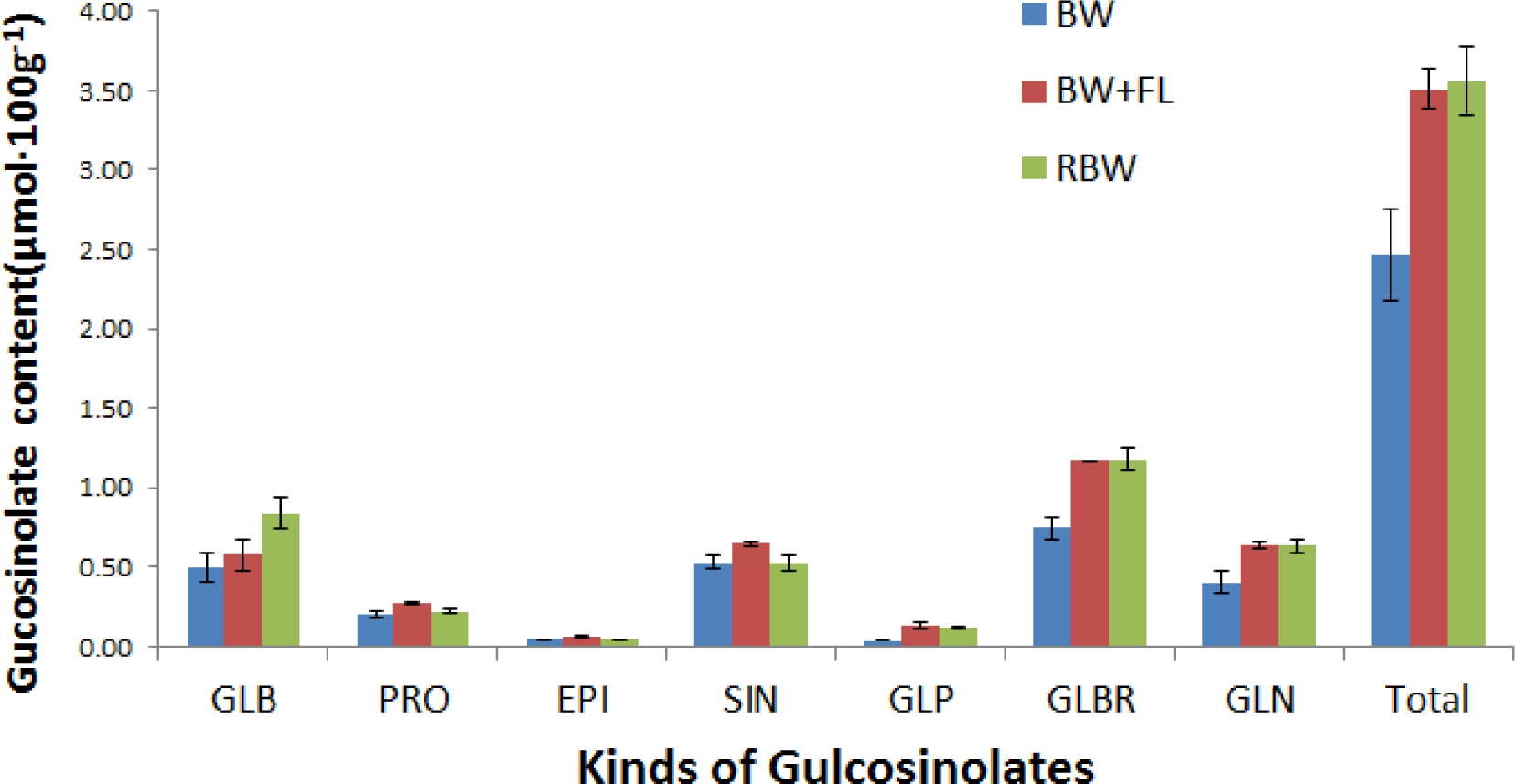
Glucosinolates(GLS)의 함량은 모든 처리에서 glucobrassicin( GLBR), glucoiberin(GLB), sinigrin(SIN), gluconasturtiin( GLN), progoitrin(PRO), glucoraphamin(GLP), epiprogoitrin( EPI)순으로 많았다(Fig. 2). BW+FL 처리에서 PRO, EPI, SIN, GLP, GLN의 함량이 높았고, RBW에 서는 GLB, GLBR, total GLS의 함량이 가장 높았다. 청색과 백색 파장 처리구인 BW에서 각종 GLS의 함량 이 낮았고, BW+FL에서 형광등의 연속파장과 적색광이 포함된 RBW 처리에서 높았다. 단일 파장보다 여러 종 류의 파장, 여러 종류의 파장보다 연속 파장이 GLS 함 량에 미치는 영향이 크다고 생각되었다.
십자화과 채소의 자극취 및 쓴맛 등을 낸다고 알려져 있으며, 이런 glucosinolate를 섭취하면 분해산물이 약리 적 또는 생리적 활성을 나탄낸다고 보고 하였다(Zhang와Tallay, 1994). 콜리플라워, 방울다다기 양배추, 배추, 브로 콜리 등 십자화과 작물의 glucosinolate 분해 산물은 암 유발 억제하는 특성이 있다(Fahey 등, 2001). 식물은 스 트레스 환경에 노출되었을 때 자신을 보호하기 위한 방 어기작의 하나로써 항산화물질을 포함한 다양한 이차대 사산물을 생합성하여 식물체내에 축적하게 되는데(Dixon 와 Paiva, 1995), 흥미롭게도 이러한 기능성 물질이 인체 의 건강을 유지하고 질병을 예방하는데 중요한 역할을 담당한다. Lee 등(2012)은 파종 후 6일째 케일 새싹의 주 요 GLS는 progoitrin, gluconapin, sinigrin, glucoerucin, glucoraphamin, glucoiberin, 4-hydroxyglucobrassicin 순으 로 많았다고 보고하였는데, GLS의 종류와 함량이 본 실 험의 결과와 다소 상이한 것은 식물노화 때문이라고 생 각된다.
케일의 잎을 분석한 결과, 인공광원 처리에 따라 수분 함량은 88.46~90.92%이었으며, 조단백질 함량은 2.97 ~3.13%, 조지방 함량은 0.13~0.15%, 회분 함량은 1.84 ~1.97%로 처리간에 유의성을 나타내지 않았다(Table 4).
Table 4.
Characteristics of moisture, protein, fat, and ash contents according to different artificial light sources of hydroponically grown kale in plant factory.
| Treatments | unit : g 100g-1 | |||
|---|---|---|---|---|
| Moisture | Crude protein | Crude fat | Crude ash | |
| BW | 88.46 a | 3.13 a | 0.15 a | 1.97 a |
| BW+FL | 89.90 a | 3.16 a | 0.15 a | 1.96 a |
| RBW | 90.92 a | 2.97 a | 0.13 a | 1.84 a |