서 론
더덕(Codonopsis lanceolata)은 산지에 자생하는 초롱꽃과(Campanulaceae)의 다년생 덩굴성 식물로 아시아 지역에 널리 퍼져 있으며 한국과 중국에서 주로 약재 또는 식용 목적으로 재배되고 있다(Lee 등, 1992). 더덕의 주요 약리성분은 saponin, polyphenol, tannin, 그리고 alkaloid 등의 화합물이 존재하며 항암, 항염증 및 항산화 등의 유용한 효과를 지니고 있다고 알려져 있다(Hossen 등, 2016; Lee 등, 2002). 더덕은 주로 노지에서 직파를 통해 재배가 이루어지는데, 발아율이 저조하여 입묘율이 낮고, 평균 재배기간이 3년가량으로 길며 생산물의 수량과 품질이 일정하지 않아 이를 개선해야 할 필요가 있다(Ghimire 등, 2006; Um 등, 2019).
공정육묘는 묘의 생산 공정을 체계화하여 생산 비용을 절감하고 묘의 균일성과 생육 속도를 향상시켜 규격화된 플러그묘를 대량으로 생산하는 시스템이다(Jeong, 1998). 또한 공정육묘는 농가에서 육묘에 소요되는 시간과 비용을 절약하고 재배기간을 단축시킬 수 있으며, 균일한 묘를 사용함으로써 일정한 품질의 수확물을 얻을 수 있다(Jeong 등, 2016). 더덕과 같이 장기간 재배하여 지하부를 이용하는 약용작물인 참당귀는 육묘로 인한 추대 억제 효과와 함께 생산량이 증대되었다고 보고되었다(Ahn과 Yu, 1996). 더덕 또한 공정육묘 기술을 적용한 고품질의 규격화된 묘를 생산하여 농가에 공급한다면 생산되는 더덕의 품질을 균일화 하고 생산량을 증대시킬 수 있을 것으로 기대된다. 그러나 더덕은 발아율이 낮고 불균일하여 균일한 묘를 육성하기 힘든 문제점을 지니고 있으며(Ghimire 등, 2006), 본래 산지에 자생하는 식물인 더덕은 햇빛이 강하고 기온이 높은 하절기 육묘에 어려움이 있어 이를 개선하기 위한 연구가 시급하다(RDA, 2019).
종자의 발아율을 향상시키는 방법에는 생장 호르몬 처리(Lee 등, 2018), 펠릿 코팅(Im 등, 2020), 그리고 저온처리(Tang 등, 2008) 등이 있다. 그중 저온처리는 물에 침지한 종자를 저온에 보관하면서 종자 내의 미숙한 배를 성숙시키고 생리적 휴면을 타파함으로써 발아를 촉진시키는 방법으로 여러 작물 종자의 발아세 향상에 효과적이라고 알려져 있다(Park 등, 1998; Tang 등, 2008; Yang 등, 2020). 그리고 산지에서 자생하는 식물의 종자는 대개 휴면성이 강하며, 더덕과 같이 초롱꽃과에 속한 잔대는 50일간 저온처리하였을 때 발아율이 유의적으로 향상되었다고 보고되었다(Park 등, 1998; Seo 등, 2018).
광포화점 이상의 강한 광을 받은 식물체는 기공을 폐쇄하여 광합성이 중단되고 엽소 현상 등으로 인한 피해를 받게 된다(Grime과 Jeffrey, 1965; Powles와 Osmond, 1978). 이러한 피해는 광포화점이 낮은 호음성식물에서 발생하기 쉽다(Jang 등, 2019; Lee 등, 2002). 차광 재배는 온실과 식물체가 받는 광을 조절하여 생육을 원활하게 하고 고온기에 온실 내부 기온을 낮추기 위해 흔히 이용되는 재배법이다(Jang 등, 2019; Kim 등, 1997). 더덕 또한 차광재배를 통한 생육 증진에 관한 연구가 이루어진 바 있으며(Lee 등, 2002; Park 등, 1972), Lee와 Won(2007)은 하절기 더덕의 노지재배 시 56% 차광망을 설치하여 재배하였을 때, 더덕의 엽면적과 엽록소 함량이 차광을 하지 않은 무처리에 비해 유의적으로 증가하였다고 보고하였다. 차광 재배는 하절기 더덕의 육묘에서도 고온장해 회피 및 생육 증진을 도모할 수 있을 것으로 판단된다. 그러나 과한 차광은 식물체의 광합성이 억제되고 도장하여 묘의 품질이 하락하게 되므로 하절기의 더덕 육묘를 위한 적정 차광 수준에 관한 연구가 필요하다(Heins, 1982; Sonobe 등, 2018).
따라서 본 연구는 더덕의 발아율과 발아세를 향상시키기 위한 적정 저온처리 기간과 하절기 더덕의 안정적 육묘를 위한 차광 수준을 조사하고자 수행되었다.
재료 및 방법
1. 실험 재료 및 저온처리
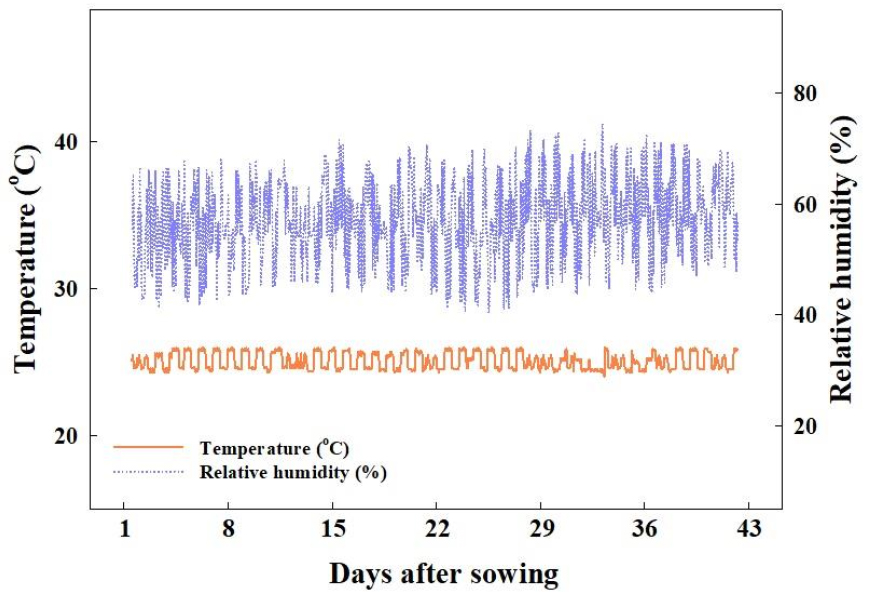
국립원예특작과학원 인삼특작부 시험포장에서 2021년 10월 13일에 채종한 더덕[Codonopsis lanceolata (S. et Z.) Trautv.] 종자를 2022년 5월 14일에 분양받아 정선한 후 4°C의 저온저장고(R-A054GDA, LG Electronics Inc., Seoul, Korea)에 보관하였다. 저온처리 기간에 따른 발아 특성을 조사하기 위해 2022년 6월 20일 증류수에 침지시킨 더덕 종자를 4°C의 저온저장고에서 1, 2, 3, 그리고 4주간 저온처리를 수행하였다. 저온처리 후 NaClO(4%; Yuhanrox, Yuhanclorox Co., Ltd., Seoul, Korea) 500mg·L-1 용액에 종자를 5분간 침종시켜 소독하고 흐르는 물에 10회 이상 세척하였다. 이후 필터페이퍼(F1093, Daihan Sci Co., Ltd., Wonju, Korea) 2매를 깐 지름 9cm의 페트리디쉬(DH.W30015, Daihan Science Co., Ltd.)를 증류수 10mL로 적신 뒤 종자를 100립씩 3반복으로 치상하였다. 대조구는 저온저장고에서 보관 중인 건조된 더덕 종자를 꺼내어 저온처리를 수행하지 않고 즉시 페트리디쉬에 치상하였다. 치상한 더덕 종자는 암환경으로 조성한 밀폐형 식물생산 시스템(C1200H3, FC Poibe Co., Ltd., Seoul, Korea)에서 3주간 발아시켰다. 온습도 로거(TR-74Ui, T&D Co., Ltd., Matsumoto, Japan)로 측정한 밀폐형 식물생산시스템 내부의 온도는 25±1°C, 상대습도는 57±17%였다(Fig. 1).
2. 발아 특성 조사
유근이 1mm 이상 돌출된 종자를 발아된 개체로 취급하여 1일 1회 21일간 발아율을 조사하였다. 저온처리 기간에 따른 더덕의 최종 발아율(germination rate)은 파종 후 21일째까지의 실험 종자 수에 대한 발아한 종자 수의 비율을 조사하였다. 발아세(GE, germination energy)는 파종 후 7일간 발아된 종자 비율을 나타내었으며, 최종 발아율의 50% 발아에 소요되는 일수(T50), 평균발아시간(MGT, mean germination time), 종자의 활력을 나타내는 발아지수(GI, germination index)를 아래와 같이 계산하여 나타내었다(Ellis와 Roberts, 1981; Farooq 등, 2005; Lee 등, 2018).
MGT (days) = ∑ (n × d) / N
T50 (days) = Ti + (N / 2 − Ni) × (Tj − Ti) / (Nj − Ni)
GI = ∑ (n / d)
(d: 치상 후 조사일 수, n = 치상 d 일째 당일 발아 수, N: 총 발아 수, Ni: N에 대한 50% 발아 전날까지의 누적 발아 수, Nj: N에 대한 50% 발아 다음날까지의 누적 발아 수, Ti와 Tj: Ni, Nj 시점의 치상 후 조사일 수)
3. 차광처리
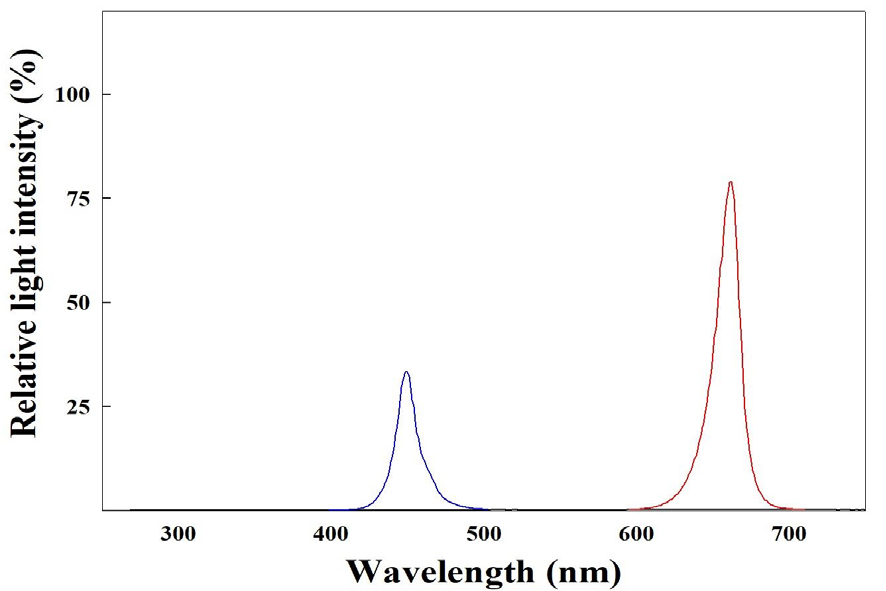
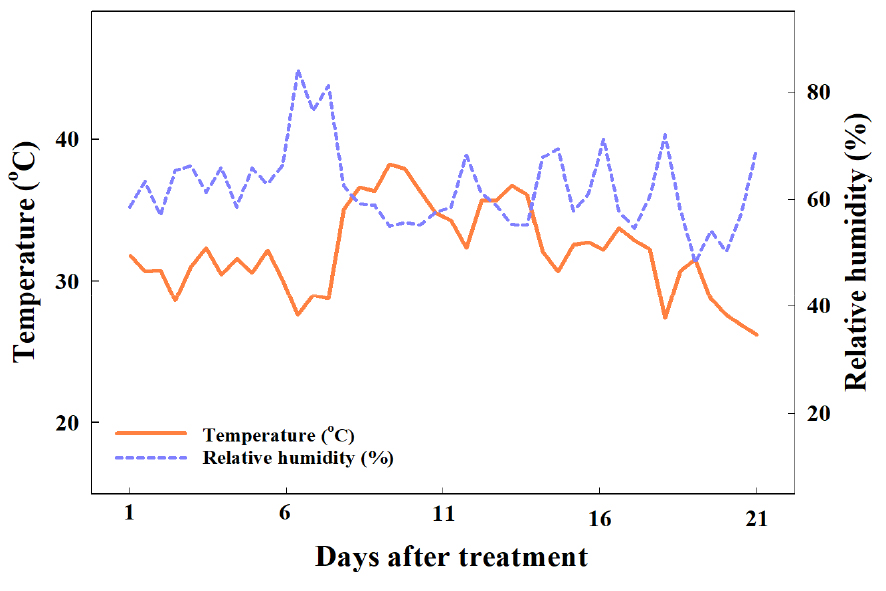
하절기 육묘 시 차광 수준에 따른 더덕의 생육을 조사하기 위해 지름이 9cm인 페트리디쉬에 거름종이 2매를 깔고 증류수 10mL로 적신 뒤 더덕 종자를 2022년 6월 27일에 치상하여 암환경으로 조성한 밀폐형 식물생산시스템에서 최아시켰다. 최아한 식물체는 원예용 상토(Plantworld, Nongwoobio Co., Ltd., Suwon, Korea)를 충진한 50구 플러그 트레이(54 × 28 × 5cm, Bumnong Co., Ltd., Jeongeup, Korea)에 25개체 3반복으로 이식하여 밀폐형 식물생산시스템에서 7월 19일까지 생장시켰다. 최아 이후 밀폐형 식물생산시스템 내 광환경은 광도 100±10µmol·m-2·s-1 photosynthetic photon flux density(PPFD)와 광주기 12/12h(명기/암기)로 설정하였으며 RB LEDs(red:blue = 7:3, ES LEDs Co., Ltd., Seoul, Korea)를 광원으로 사용하였다. 광도는 광도계(HD2101.2, Delta Ohm SrL., Caselle, Italy)를 이용하여 측정하였으며, 광파장은 분광복사계(ILT950, International Light Co., Ltd., MA, USA)로 측정하여 밀폐형 식물생산시스템 내 광파장 분포를 Fig. 2에 나타내었다. 7월 20일에 경상국립대학교 농업생명과학대학 부속농장에 위치한 벤로형 유리온실에서 묘의 차광처리를 하였다. 차광처리는 45% 및 75% 흑색 PE 차광망(shade net, Heungnong Co., Ltd., Geumsan, Korea)을 온실 내 베드에 설치하여 7월 20일부터 8월 10일까지 3주간 처리하였으며 차광을 하지 않은 무처리구를 대조구로 이용하였다. 실험 중 차광률이 유지되는 것을 확인하고자 차광처리 당일과 처리 4, 8, 11, 그리고 13일 후 KST 기준 오전 10시에서 10시 30분 사이에 광도계를 이용하여 육묘 구역 내 더덕의 생장점 높이에서 광도를 3회 3반복으로 측정하고 평균값을 산출하였다(Fig. 3). 양액 공급을 위해 (CaNO3)2·4H2O 472.0mg·L-1, KNO3 202.0mg·L-1, KH2PO4 272.0mg·L-1, NH4NO3 80.0mg·L-1, MgSO4·7H2O2 46.0mg·L-1, Fe-EDTA 15.0mg·L-1, H3BO3 1.4mg·L-1, MnSO4·4H2O 2.1mg·L-1, ZnSO4·7H2O 0.8mg·L-1, CuSO4·5H2O 0.2mg·L-1, Na2MoO4·2H2O 0.1mg·L-1의 양액을 조제하고 EC 1.0dS·m-1, pH 6.5로 조정하여 2일 간격으로 저면관수 하였다. 온습도 로거(TR-76Ui, T&D Co., Ltd, Matsumoto, Japan)로 측정한 육묘기간 중 온실 내부의 평균 기온은 33±5°C, 평균 상대습도는 60±25%였다(Fig. 4).
4. 생육조사
생육조사는 파종 45일차에 초장, 경경, 엽장, 엽폭, 엽수, SPAD, 엽면적, 지상부와 지하부의 생체중 및 건물중을 측정하였다. SPAD값은 엽록소 측정기(SPAD-502, Konica Minolta Inc., Tokyo, Japan)를 이용하여 완전히 전개된 3개의 잎을 측정하고 평균값을 산출하였다. 경경은 버니어캘리퍼스(CD-20CPX, Mitutoyo Co., Ltd., Kawasaki, Japan)를 이용하여 측정하였다. 엽면적은 엽면적 측정기(LI-3000, LI-COR Inc., Lincoln, NE, USA)를 이용하여 측정하였고, 생체중과 건물중은 전자저울을 이용하여 측정하였다. 건물중은 식물체를 70°C 항온 건조기(Venticell-222, MMM Medcenter Einrichtungen GmbH., Planegg, Germany)에서 72시간 동안 건조한 후 측정하였다. 뿌리 이미지 스캐너(Expression 12000XL, EPSON Co., Ltd., Seoul, Korea)를 이용하여 뿌리를 스캔하고 WinRhizo Pro 2007a 뿌리 이미지 형태 분석 시스템(Regent Instruments Inc., Sainte-Foy, QC, Canada)을 이용하여 총 뿌리길이, 뿌리 표면적, 평균 직경, 근단 수를 분석하였다. 측정한 생육 데이터를 토대로 더덕 묘의 엽면적지수(LAI, leaf area index), 잎의 두께를 나타내는 비엽중(SLW, specific leaf weight), 묘의 충실도(compactness), 그리고 묘의 전체적인 품질을 평가하는 Dickson’s quality index(DQI)를 아래와 같이 계산하여 묘소질의 지표로 삼았다(Beadle, 1993; Dickson 등, 1960).
LAI(cm2·cm-2) = 엽면적(cm2)/플러그 트레이 면적(cm2)
SLW(cm2·mg-1) = 엽면적(cm2)/지상부 건물중(mg)
Compactness(mg·cm-1) = 지상부 건물중(mg)/초장(cm)
DQI = 총 건물중/{(초장/경경) + (지상부 건물중/지하부 건물중)}
5. 실험설계 및 통계분석
발아실험은 처리 당 100개체 3반복으로 수행하였으며, 차광실험은 처리 당 25개체씩 3반복의 완전임의배치법으로 배치하고 처리 당 균일한 11개체를 채취하여 조사하였다. 통계분석은 SAS 프로그램(SAS 9.4, SAS Institute Inc., Cary, NC, USA)을 이용하여 분산분석(ANOVA)을 실시하였고, 평균 간 비교는 Tukey’s test를 이용하여 5% 유의수준에서 각 처리 간 유의성을 검증하였다. 그래프는 SigmaPlot 12.5(Systat Software, San Jose, CA, USA)를 이용하여 나타내었다.
결과 및 고찰
더덕의 발아율은 1-2주간 저온처리 하였을 때 대조구와 유의적인 차이가 나타나지 않았으며 2주차 이후로는 저온처리 기간이 길어짐에 따라 최종 발아율이 감소하는 경향을 보였다(Table 1). 반면 평균발아일수(MGT)는 1주, 2주 3주, 그리고 4주간의 모든 처리에서 대조구에 비해 유의성 있게 단축되었다. T50은 1주, 3주간 저온처리 하였을 때 유의적으로 단축되었다. 파종 후 7일까지의 발아율을 나타낸 발아세(GE)와 종자의 활력을 나타내는 발아지수(GI)는 저온처리를 1주간 수행하였을 때 유의적으로 가장 높은 값을 나타내었다. 종자의 발아는 종피를 투과하여 종자 내부로 흡수된 물과 저장양분을 이용한 대사활동을 통해 배아와 유근이 생장하면서 개시된다(Nonogaki 등, 2010; Woodstock, 1988). 그러나 미숙한 배를 지닌 종자는 발아에 적절한 외부 환경이 조성되더라도 내적 요인에 의해 발아가 억제되는 생리적 휴면 특성을 갖는다(Baskin과 Baskin, 2004). 종자의 생리적 휴면은 얕은 휴면(non-deep dormancy), 깊은 휴면(deep dormancy), 그리고 중간 단계인 중간휴면(intermediate dormancy)으로 구분되며, 얕은 휴면성을 지닌 작목의 경우 노천매장 또는 저온처리를 비롯한 후숙 과정을 거쳐 휴면을 타파할 수 있다(Baskin과 Baskin, 2014; Schwienbacher 등, 2011). 저온처리는 종자를 물에 침지하고 저온에 보관하는 발아촉진법으로, 종자 내부에 수분을 침투시키고 저온을 통해 발아를 촉진하는 지베렐린의 생합성을 유도함으로써 미숙한 배를 성숙시켜 종자의 생리적 휴면을 타파할 수 있는 방법으로 알려져 있다(Baskin과 Baskin, 2014; Yamauchi 등, 2004). Ryu 등(2017)은 얕은 생리적 휴면성을 지닌 제비동자꽃 종자에 저온처리를 6주 이상 수행하였을 때 발아율이 유의적으로 증가하였다고 보고하였다. Yang 등(2020)은 프리뮬러(Primula beesiana) 종자를 4, 8, 그리고 16주간 저온처리 하였을 때 모든 처리구에서 발아율이 향상되었으며, 이를 프리뮬러가 얕은 생리적 휴면성을 지닌 근거 중 하나로 제시하였다. 그리고 더덕과 같이 초롱꽃과인 잔대에서도 50일간의 저온처리를 통해 발아율이 증가된 연구 결과가 보고되었다(Park 등, 1998). 본 연구에서 저온처리 기간에 따른 더덕의 발아특성은 저온처리를 1주간 하였을 때 대조구보다 GE와 GI가 유의성 있게 향상되었고 MGT와 T50이 유의적으로 단축되어 균일하고 발아세가 우수한 것을 확인하였다. 이를 통해 앞선 연구들과 같이 저온처리에 의해 더덕의 발아가 촉진되었음을 확인할 수 있다. 따라서 더덕은 1주간의 저온처리를 통해 발아세를 향상시킬 수 있는 얕은 휴면성을 지닌 작목으로 판단된다.
Table 1.
Germination characteristics of Codonopsis lanceolata as affected by cold treatment periods.
| Cold treatment (week) |
Germination rate (%) |
MGTz (day) |
T50y (day) |
GEx (%) | GIw |
| Control | 73.3 abv | 8.13 c | 6.3 b | 40.7 b | 10.5 b |
| 1 | 80.3 a | 6.00 a | 4.7 a | 59.7 a | 17.1 a |
| 2 | 69.3 b | 6.97 b | 6.0 ab | 49.0 b | 11.8 b |
| 3 | 52.7 c | 5.87 a | 4.4 a | 40.7 b | 10.5 b |
| 4 | 33.7 d | 6.20 a | 5.3 ab | 27.0 c | 6.1 c |
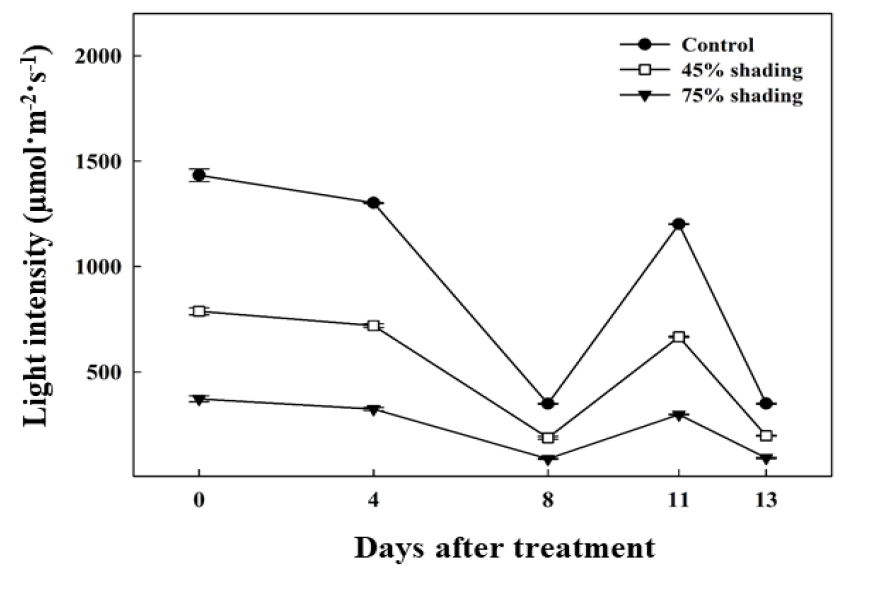
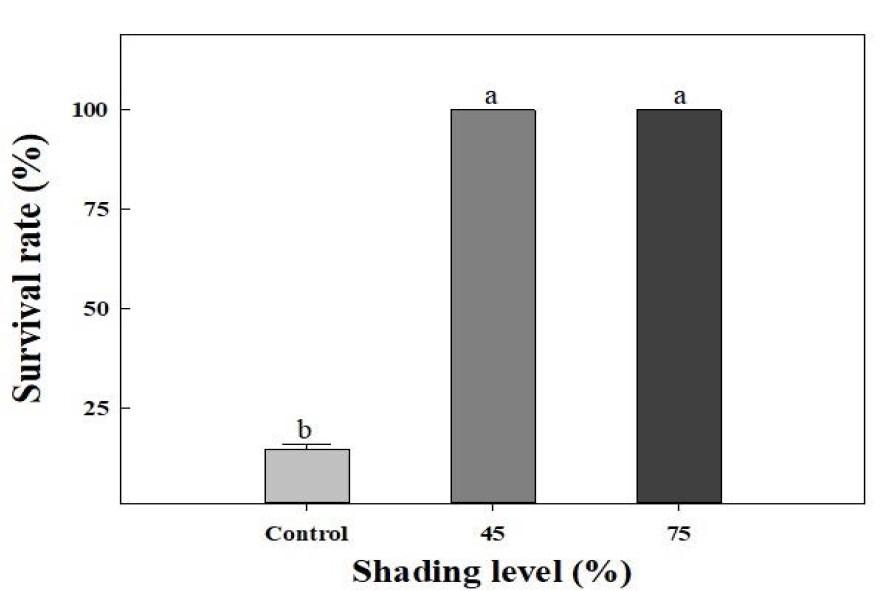
실험 중 측정한 비가 오지 않은 날의 온실 내 평균 광도는 차광을 하지 않은 무처리에서 1,312±35µmol·m-2·s-1, 45% 차광처리는 724±18µmol·m-2·s-1, 그리고 75% 차광처리에서 331±12µmol·m-2·s-1로 실험에 설정한 차광 수준으로 유지되었다(Fig. 3). 온습도 로거로 측정한 온실 내부의 평균 기온은 33±5°C, 평균 상대습도는 60±25%였다(Fig. 4). 실험 종료 후, 무처리구 식물체의 생존율은 14.7%로 대부분 고사한 반면, 차광처리구의 식물체는 100% 생존하였다(Fig. 5). Park 등(1972)은 발아 후 1개월이 지난 2년생 더덕의 광포화점이 1,389µmol·m-2·s-1라고 보고하였으며, Lee와 Won(2007)은 파종 후 약 4개월이 경과한 더덕의 광포화점을 700-1,000 µmol·m-2·s-1라 보고하였다. 무처리 구역 내 평균 광도는 1,312±35 µmol·m-2·s-1이며, 이는 앞선 연구에서 보고된 파종 4개월 후 더덕의 광포화점을 초과하는 수치이다. 또한 실험기간 동안 온실 내 평균 기온은 33±5°C로 더덕의 생육 적온인 20-25°C와 크게 상이하였다(Lee 등, 1992). 본 연구는 파종 24일 후 육묘기의 어린 더덕을 처리 대상으로 하였으며, 하절기의 고온과 광포화점 이상의 강한 광에 노출된 무처리구에서 고온장해를 비롯한 스트레스로 인해 많은 식물체가 고사한 것으로 판단된다.
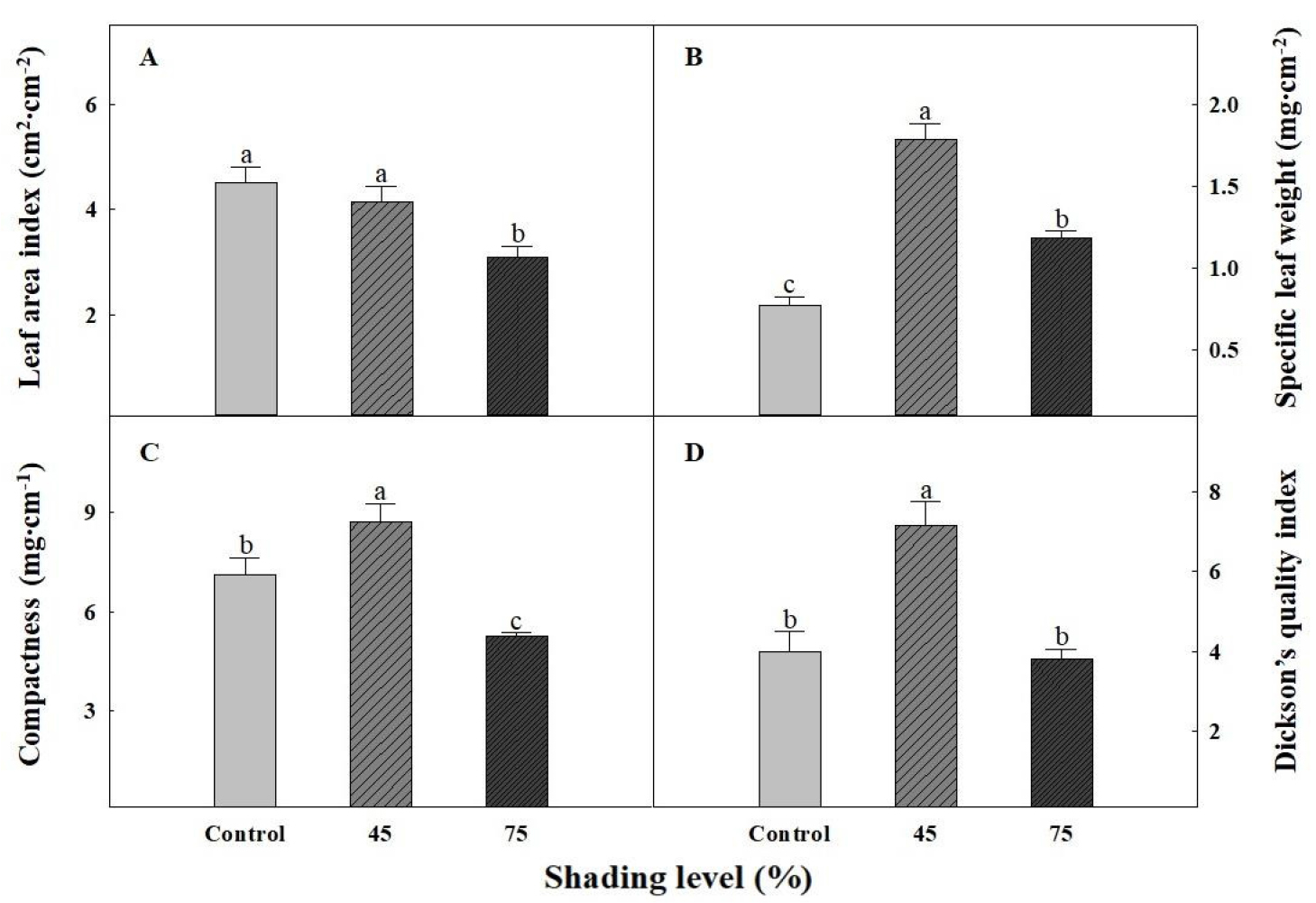
파종 45일 후 차광 수준에 따른 더덕 묘의 생육은 45% 차광처리에서 우수한 경향을 보였다(Table 2와 Fig. 6). 초장과 엽장, 엽폭, 그리고 생체중 및 건물중은 45% 차광처리에서 유의성 있게 우수하였다. 경경은 무처리와 45% 차광처리에서 75% 처리에 비해 유의적으로 굵었다. 더덕 묘의 총 뿌리 길이, 표면적, 그리고 근단 수는 차광처리 시 유의성 있게 증가하는 경향을 보였다(Table 3). 뿌리 평균 직경의 경우 무처리와 45% 차광처리에서 75% 차광처리에 비해 유의적으로 높게 나타났다. 비엽중(SLW)은 무처리와 45% 차광처리에서 75% 처리에 비해 유의적으로 높았으며 엽면적지수(LAI), 묘의 충실도(compactness)와 DQI는 45% 차광처리에서 가장 높게 나타났다(Fig. 7). 빛은 식물의 생장과 발달에 큰 영향을 끼치는 요소 중 하나이며 작물에 따라 적합한 광도는 상이하다(Kami 등, 2010). 식물체가 광포화점 이상의 강한 광을 지속적으로 받은 경우, 식물체는 잎의 기공을 닫고 광합성과 증산작용이 억제된다(Grime과 Jeffrey, 1965; Powles와 Osmond, 1978). Lee(2002)와 Lee와 Won(2007)은 더덕 노지 재배 시 차광을 하지 않은 무처리에 비해 56% 차광처리에서 잎의 엽록소 함량을 나타내는 SPAD와 엽면적이 유의성 있게 높았으며, 이는 무처리구에서 광포화점 이상의 광이 지속되어 잎의 엽록소가 파괴된 것에 기인하였다고 보고하였다. 본 연구에서도 재배기간 중 광포화점 이상의 광도로 인해 무처리구에서 SPAD 및 지상부와 지하부 생육이 저조하였고, 45% 차광처리에서 묘소질이 유의적으로 우수하여 앞선 연구와 유사한 결과를 나타내었다. 그리고 저광도 조건에서의 육묘는 잎의 광합성이 제한되고 줄기가 가늘어져 우수한 묘를 생산하기 어렵다(Heins, 1982; Sonobe 등, 2018). Table 2와 Fig. 7에서 나타난 75% 차광처리의 생육은 45% 처리에 비해 줄기가 가늘고 전체적인 생육과 묘소질이 45% 차광처리에 비해 유의적으로 저조하였다. 이는 과한 차광으로 인해 충분한 광을 수용하지 못해 생육이 지연된 결과로 판단된다. 따라서 하절기에는 45% 차광처리를 통해 안정적인 더덕 육묘가 가능할 것이다.
Table 2.
Shoot growth characteristics of Codonopsis lanceolata as affected by different shading levels at 45 days after sowing.
| Shading (%) |
Plant height (cm) |
Stem diameter (mm) |
Leaf length (cm) |
Leaf width (cm) |
No. of leaves (/plant) | SPAD |
Leaf area (cm2/plant) |
Fresh weight (mg/plant) |
Dry weight (mg/plant) |
| 0 (control) | 9.2 cz | 1.57 a | 3.2 b | 2.5 b | 5.6 b | 29.48 b | 15.61 c | 442.7 b | 68.6 b |
| 45 | 16.3 a | 1.58 a | 4.2 a | 3.1 a | 8.0 a | 33.71 a | 35.06 a | 957.3 a | 141.3 a |
| 75 | 13.9 b | 1.28 b | 3.4 b | 2.6 b | 8.2 a | 35.72 a | 25.80 b | 561.8 b | 72.8 b |
Table 3.
Root growth characteristics of Codonopsis lanceolata as affected by different shading levels at 45 days after sowing.
| Shading (%) |
Total root length (cm) |
Surface area (cm2) |
Average diameter (mm) |
No. of root tips (/plant) |
Fresh weight (mg/plant) |
Dry weight (mg/plant) |
| 0 (control) | 18.6 bz | 3.24 b | 0.61 a | 42.6 b | 42.0 b | 5.7 b |
| 45 | 47.0 a | 8.45 a | 0.63 a | 124.4 a | 211.0 a | 13.1 a |
| 75 | 51.5 a | 6.58 a | 0.41 b | 131.5 a | 86.9 b | 6.7 b |
이상의 결과를 종합하면, 4°C에서 일주일간의 저온처리는 더덕의 발아세를 유의적으로 향상시킬 수 있었으며, 기온이 높고 광이 강한 하절기 육묘 시에는 45% 차광 조건에서 육묘할 경우 안정적인 더덕 육묘가 가능할 것으로 판단된다.