서 론
재료 및 방법
1. 식물재료 및 재배환경
2. NaCl 농도 및 처리 시기
3. 생육 및 생리활성화합물
4. 통계분석
결과 및 고찰
1. 갯방풍 수경재배 시 NaCl 처리 농도에 따른 생육(실험 1)
2. 갯방풍 수경재배 시 수확 전 NaCl 처리에 따른 생육(실험 2)
서 론
식물의 생장과 생리활성화합물 함량에 영향을 미치는 환경조건에는 광, 수분, 습도, 양분, 온도, CO2 등이 있으며 그 중 양분은 작물의 생리적 특성 및 품질에 직접적인 영향을 주는 중요한 요소이다(Müller 등, 2000). 많은 수경재배 농가에서는 양액의 형태로 양분을 식물체에 공급하게 되며 양액 농도 또는 특정 이온을 조절하여 작물의 생육을 관리하거나 생산성을 증가시키는 방법을 이용한다. 하지만, 양액의 조성, 조제 및 농도가 부적절하게 이루어졌을 경우 작물에 스트레스가 발생할 수 있으며, 특히 Na+나 Cl-등 특정 이온은 과도한 흡수로 인한 이온 독성 반응 및 이온의 식물 체내 축적으로 인한 이온 불균형 현상, 수분과 이온의 복합작용을 통한 스트레스 반응으로 생육억제 및 생리장해 등의 부정적인 반응과 함께 당도, 색, 생리활성 화합물의 증가 등의 긍정적인 반응도 동시에 나타난다(Bernstein, 1975; Kim 등, 2019; Shabala 등, 2015; Termaat와 Munns, 1986).
이러한 염 스트레스에 대해 내성을 가지는 식물을 염생식물이라고 하며, 염생식물은 일반적인 식물의 한계 염 수준(40mM NaCl)을 초과하는 환경에서도 정상적으로 생장한다(Choi 등, 2013; Kim 등, 2019; Matthew와 Hasegawa, 2013; Termaat와 Munns, 1986). 염생식물에는 개기장(Panicum bisulcatum Thunb), 까마중(Solanum nigrum), 바랭이(Digitaria ciliaris), 어처귀(Abutilon theophrasti), 갯방풍(Glehnia littoralis F. Schmidt ex Miquel)등이 있으며 바닷물이나 천일염, NaCl 등 염분처리를 통한 간척지 토양에서의 염생식물의 재배 및 생리활성화합물, 생장에 관한 연구가 진행되어왔다(Kim 등, 2011; Lee 등, 1999; Lee 등, 2010; Lee 등, 2020; Sohn등, 2009).
방풍은 중화본초(CFDA, 1999)에 진통, 해열의 약리효과가 명시되어 있으며 뿌리와 뿌리줄기를 치료에 사용한다. 생약으로 사용되는 방풍류에는 방풍(당방풍, 진방풍; Saposhnikovia divaricate Turcz.), 갯기름나물(빈해전호, 식방풍; Peucedanum japonicum Thunb.), 그리고 갯방풍(빈방풍, 북사삼, 해방풍)등이 있다(CFDA, 1999; Choo 등, 2008; Song 등, 2014). 갯방풍은 우리나라 해안사구 모래언덕에 주로 자생하는 산형과(Umbelliferae)의 갯방풍속(Glehnia) 염생식물로, 잎은 톱니가 있는 작은 3개의 잎으로 갈라져 있으며 꽃잎은 길고 흰색이다. 잎과 뿌리에는 항진통, 항염증, 항암작용을 하는 coumarin, polyacetylene, saposhnikovan A, sesquiterpene 등의 약리적 효과를 가진 화합물이 함유되어 있어 어린 잎줄기는 채소로 식용하고 뿌리는 약용으로 사용한다(Choo 등, 2008; Lee, 2020; Um 등, 2010). 현재 갯방풍은 기능성 채소 및 고부가가치 상품으로 판매되고 있지만, 생약, 식생, 유전 및 형태 연구가 주로 이루어지고 있어 재배관리를 통한 생산 및 생리활성화합물 함량을 증진하는 고품질 갯방풍 생산을 위한 연구가 필요한 실정이다(Choi 등, 1997; Kim 등, 2008; Moon 등, 2010; Song 등, 2014).
따라서, 본 연구는 염생식물인 갯방풍을 이용한 담액식 재순환 수경재배 시스템에서 다양한 NaCl 농도와 수확 전 처리 시기에 따른 생육반응 및 생리활성화합물 함량을 구명하고자 수행되었다.
재료 및 방법
1. 식물재료 및 재배환경
실험을 위해 갯방풍 종자를 3일간 베노밀 수화제(Farmhannong benomyl, FarmHannong Co., Jinju, Korea)를 사용하여 소독한 후 암조건, 5°C에서 10주간 저온 습윤 처리하였다. 그 후 종피를 제거한 종자를 128구 플러그 트레이(54cm × 28cm × 4.8cm, Bumnong Co. Ltd., Jeongeup, Korea)에 우레탄 스펀지(W × L × H: 30mm × 30mm × 40mm, Gafatec Co., Ltd., Korea)를 충진 하여 1구당 1립씩 파종하였다. 파종 후 경상국립대학교 시설원예학연구실의 밀폐형 식물 생산 시스템(C1200H3, FC Poibe Co. Ltd., Seoul, Korea)내에서 육묘하였으며 본엽이 출현한 이후 양지붕형 유리온실에서 수경재배하였다. Hoagland 배양액(Hoagland and Arnon, 1950)을 조제 하여 2주 간격으로 교체하여 사용하였다. 양액의 EC는 1.5dS·m-1, pH는 6.5로 조절하여 공급하였다.
2. NaCl 농도 및 처리 시기
두 실험 모두 NaCl 무처리구를 대조구로 사용하였다. 실험은 각각 독립적으로 실시하였으며, 첫 번째 실험은 갯방풍의 수경재배 기간 동안 적절한 NaCl농도를 확인하기 위해 수행 되었다. 2020년 3월 6일에 파종한 묘를 본엽이 출현한 2020년 5월 25일에 정식 한 후 배양액에 NaCl을 각각 40, 80, 120, 160, 200mM 농도로 처리하여 2020년 6월 24일까지 30일간 재배하였다.
두 번째 실험은 수확 전 NaCl 처리가 갯방풍의 생육과 생리활성 화합물에 미치는 영향을 확인하기 위해 수행되었다. 2020년 5월 25일에 파종한 갯방풍을 본 엽이 출현한 2020년 6월 30일에 정식 하고 2020년 8월 19일까지 50일 동안 재배하였다. 수확 전 NaCl 처리는 수확 10일 전이었던 2020년 8월 10일과 수확 5일 전인 2020년 8월 15일에 50, 100, 150, 200mM 농도로 NaCl을 각각 처리하였다.
3. 생육 및 생리활성화합물
3.1 갯방풍 수경재배 시 NaCl 처리 농도에 따른 효과(실험 1)
생존율은 정식 후 4일 간격으로 모든 개체를 육안으로 조사하여 생존한 개체 수를 전체 정식 개체 수로 나누어 백분율로 나타내었다. 생육조사는 처리 당 6주를 무작위 선발하여 가장 큰 잎의 엽병장, 엽장, 엽폭, 엽수를 측정하였고, 근장은 크라운부터 지하부의 총 길이를, 경경과 근경은 각각 부위별로 가장 굵은 부분을 버니어캘리퍼스(CD-20CPX, Mitutoyo Co. Ltd., Kawasaki, Japan)를 이용하여 측정하였다. 엽록소 함량은 엽록소 측정기(SPAD 502, Konica Minolta Inc., Tokyo, Japan)를 이용하여 완전히 전개된 잎 3매에서 측정하였고, 엽면적은 엽면적 측정기(LI-3000, LI-COR Inc., Lincoln, NE, USA)로 줄기를 제외한 잎의 면적만을 측정하였다. 생체중과 건물중은 전자저울(EW220-3NM, Kern&Sohn GmbH., Balingen, Germany)을 이용하여 측정하였는데, 건물중은 70°C 항온 건조기(Venticell-222, MMM Medcenter Einrichtungen GmbH., Planegg, Germany)에서 72시간 이상 건조한 시료의 지상부, 지하부 무게를 측정하였다.
3.2 갯방풍 수경재배 시 수확 전 NaCl 처리에 따른 효과(실험 2)
NaCl처리에 따른 생리장해 정도를 확인하기 위해 50일 후 처리 당 무작위로 선발된 6주의 모든 잎에서의 시각적인 피해 정도를 조사하여 백분율로 나타내었다. 피해가 나타나지 않은 잎은 0점, 얼룩이 나타난 잎은 1점, 황색 반점이 생긴 잎은 2점, 색이 연해지고 반점이 생긴 잎은 3점, 색이 연해지고 시든 잎은 4점, 시든 잎은 5점으로 계산하였다. 생육조사는 실험 1과 동일한 방법으로 수행하였으며, 광합성률은 처리 당 6주를 무작위로 선발하여 휴대용 광합성측정장치(CIRAS-3, PP Systems International Inc., Amesbury, MA, USA)로 생장점으로부터 완전히 전개된 5번째 잎을 측정하였다.
총 페놀함량과 총 플라보노이드의 함량 측정은 처리 당 6주를 무작위로 선발하여 조사하였으며, 액체질소로 동결시킨 갯방풍 잎을 초저온 냉동고(NF-140SF, Nihon Freezer Co. Ltd., Yushima, Japan)에 –72°C의 온도로 보관하였다가 막자사발에 분쇄한 후 시료 0.4g에 2mL의 80% methanol을 첨가하여 2mL 튜브에 넣고 암 상태에서 교반기에 45° 기울여 원심분리(15,000rpm, 25°C, 10min)후, 상층액을 추출하여 사용하였다. 총 페놀함량은 Folin-ciocalteu’s reagent 방법(Singleton과 Rossi, 1965)을 일부 변형하여 측정하였고 분광광도계로 735nm에서 흡광도를 측정하여 식물체 1g당 Gallic acid equivalent(mg)로 나타내었다. 총 플라보노이드 함량은 Kumaran과 Karunakaran 방법(2007)을 일부 변형하여 측정하였으며 반응이 끝난 시료를 분광광도계 415nm에서 흡광도를 측정하여 식물체 1g당 quercetin equivalent(mg)로 나타내었다.
항산화 활성은 2,2-diphenyl-1-picrylhydrazyl(DPPH, Sigma-Aldrich Co., St. Louis, MO, USA) free radical scavenging activity method(Yamaguchi 등, 1998)를 일부 변형하여 측정하였으며 반응이 끝난 시료를 분광광도계로 517nm에서 상층액의 흡광도를 측정하여 1g당 trolox(mg)로 표현하였다.
4. 통계분석
실험은 처리당 12개체씩 3반복의 난괴법으로 배치하였으며 균일한 6개체를 채취하여 조사하였다. 통계분석은 SAS 프로그램(SAS 9.4, SAS Institute Inc, Cary, NC, USA)을 이용하여 분산분석(ANOVA)을 실시하였고, 평균 간 비교는 던컨의 다중검정(Duncan’s multiple range test)을 이용하여 5% 유의수준에서 각 처리 간 유의성을 검증하였다. 그래프는 SigmaPlot 프로그램(SigmaPlot 12.0, Systat Software, San Jose, CA, USA)을 이용하여 나타내었다.
결과 및 고찰
1. 갯방풍 수경재배 시 NaCl 처리 농도에 따른 생육(실험 1)
정식 후 30일째에 갯방풍의 최종생육 결과를 Fig. 1에 나타냈다. 가장 농도가 높은 200mM NaCl에서 정식 7일째부터 고사하는 갯방풍 묘가 관찰되었으며(Fig. 2), 160mM NaCl은 처리 8일, 120mM NaCl은 12일, 80mM NaCl은 16일부터 고사하는 개체가 나타났다. 또한, 정식 28일째에 200mM NaCl에서는 29.2%의 개체만 생존하였으나 40mM과 0mM에서는 고사하는 개체가 나타나지 않았다. 따라서 갯방풍 수경재배 시 배양액의 NaCl 농도가 80mM 이상일 때 갯방풍 묘에 염류장해가 나타나는 것으로 판단된다.
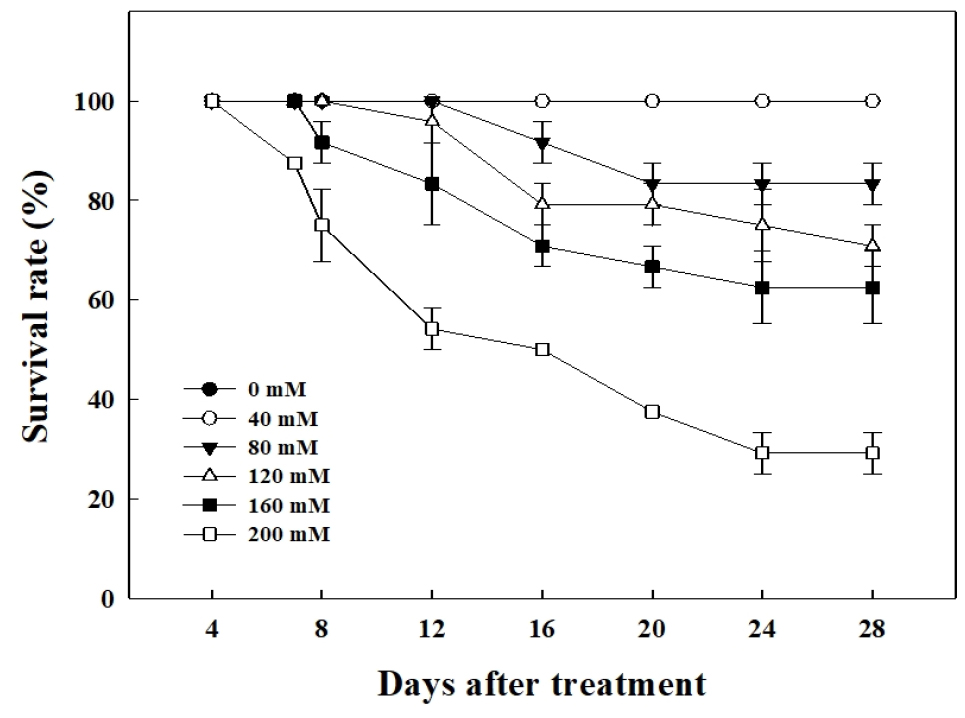
Fig. 2
Survival rate of Glehnia littoralis Fr. Schmidt ex Miquel as affect by different NaCl concentrations at 30 days after transplanting. Vertical bars represent the stand deviation of the mean (n = 6). Different letters above bars indicate significant differences by Duncan’s multiple range test at p ≤ 0.05.
Table 1은 갯방풍 정식 후 30일 째의 생육을 나타낸 결과이다. 대조구 그리고 40mM 처리구와 비교해서 80mM 이상의 NaCl 처리에서 유의성 있게 생육이 감소하기 시작했다. 또한, NaCl 처리에 따른 양액의 EC 수준은 80mM NaCl 처리에서 평균 9.3dS·m-1로 측정되었는데(data not shown) Jang 등(2019)이 보고한 EC 8.0dS·m-1이상에서 갯방풍의 생육 저해가 나타났다는 결과와 비슷한 경향이었다. 이와 같은 결과는 NaCl 처리가 식물체와 양액의 수분퍼텐셜에 영향을 주어 수분 흡수가 감소한 것으로 판단되며, Park 등(2010)이 연구한 내염성 수종의 NaCl 농도별 생장 반응과 유사한 경향으로 나타났다.
Table 1.
Growth characteristics of Glehnia littoralis Fr. Schmidt ex Miquel as affected by different NaCl concentrations at 30 days after transplanting.
2. 갯방풍 수경재배 시 수확 전 NaCl 처리에 따른 생육(실험 2)
정식 후 50일째에 갯방풍의 잎에 나타난 가시적 피해를 Fig. 3와 Fig. 4에 나타내었다. 수확 10일 전 NaCl 처리에서는 200mM NaCl 처리에서 3.49의 유의적인 가시적 피해가 나타났으며, 수확 5일 전 150mM NaCl 처리에서 3.32, 200mM NaCl 처리에서 2.14의 유의적인 가시적 피해가 관찰되었다(Fig. 4). 염분은 토양에 축적되면 토양의 이온 농도를 높이고 수분 퍼텐셜을 감소시켜 식물의 수분흡수를 방해한다(Marschner, 1995). 본 실험에서도 고농도의 NaCl 처리로 양액의 수분 퍼텐셜이 낮아졌고, 이것이 식물에 삼투 스트레스로 작용하여 수분 부족과 위조 현상을 일으켜 잎에 생리장해가 나타난 것으로 판단된다.
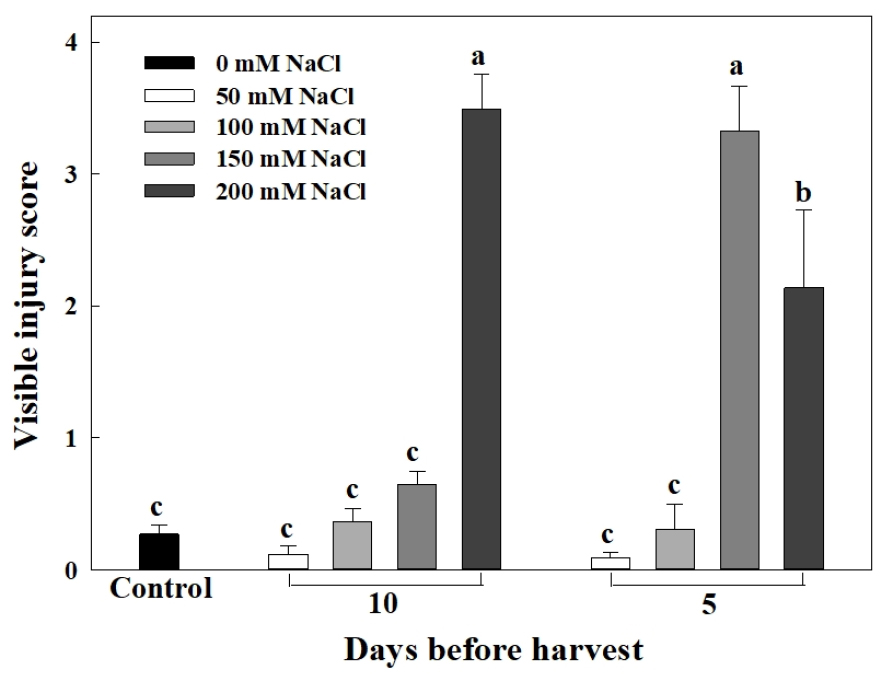
Fig. 4
Visible injury score of Glehnia littoralis Fr. Schmidt ex Miquel as affected by different NaCl concentrations and treatment timing at 50 days after transplanting. Vertical bars represent the stand deviation of the mean (n = 6). Different letters above bars indicate significant differences by Duncan’s multiple range test at p ≤ 0.05.
정식 후 50일째에 갯방풍의 최종생육 결과를 Fig. 5에 나타내었다. 갯방풍에 NaCl을 처리하였을 때 대조구 대비 50mM NaCl 처리 시 엽장 10.77cm, 근경 13.87mm, 지하부 생체중 6.78g 및 지상부 건물중 3.11g으로 증가 되었다(Table 2). 그러나 염 농도가 높아지면서 생육이 감소되는 경향도 관찰되었는데, 특히 수확 5일 전 200mM 처리에서 지상부 생체중이 4.05g, 건물중이 0.69g, 지하부의 생체중이 2.07g, 건물중이 0.60g으로 가장 낮았다. SPAD는 대조구와 수확 10일전, 5일 전 모두 50mM NaCl 처리 및 100mM NaCl 처리에서 가장 높았고, 수확 10일 전 200mM NaCl 처리에서 가장 낮았다(Fig. 6A). 엽면적은 수확 5일 전 200mM NaCl 처리에서 가장 낮게 나타났다(Fig. 6B). 염분 스트레스에 대한 식물의 반응은 식물 종과 품종, 생육 단계 및 환경조건 등에 따라 다양하게 나타난다(Giuliano 등, 1993). 적정 염 농도에서 시금치의 수확량이 증가(Osawa, 1963)했고, 저농도 단기간 NaCl 처리한 양상추의 생육이 증가(Kim과 Hyun, 2011) 했다는 연구 결과가 있으며, Bolu와 Polle(2004)은 저농도의 NaCl 처리가 세포질을 산성화시키고 세포벽 구성을 늦추어 세포를 성장시킨다고 보고했다. Kim 등(2019)은 염생식물인 나문재(Suaeda glauca)가 50mM NaCl 처리에서 생육이 증가하였다고 보고하였는데, 이는 척박한 해안사구에 자생하는 염생식물이 생장 환경에 최적으로 진화한 결과라고 하였다. 이러한 결과들을 통해 염분 스트레스가 작물에 부정적인 영향만 주는 것은 아니며(Shannon과 Grieve, 1998), 적절한 스트레스를 통해 작물 생육을 증진 시킬 수 있음을 알 수 있다. 따라서 저농도의 NaCl 처리가 갯방풍의 생육을 증진하는 긍정적인 스트레스로 작용했으며, 특히 수확 10일 전 50mM NaCl 처리가 유의성 있게 효과적이었다.
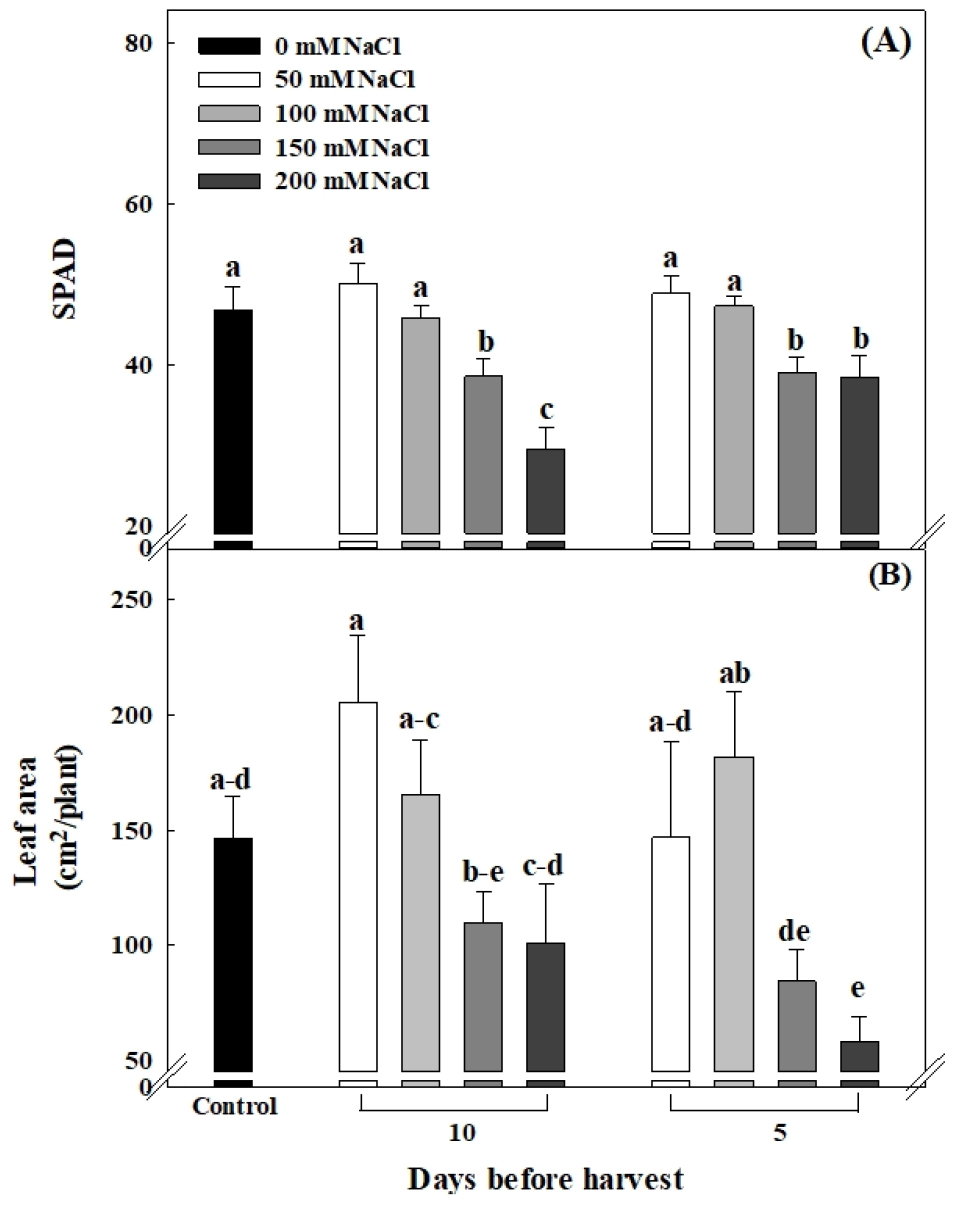
Fig. 6
The SPAD (A) and leaf area (B) of Glehnia littoralis Fr. Schmidt ex Miquel as affected by different NaCl concentrations at 50 days after transplanting. Vertical bars represent the stand deviation of the mean (n = 6). Different letters above bars indicate significant differences by Duncan’s multiple range test at p ≤ 0.05.
Table 2.
Growth of Glehnia littoralis Fr. Schmidt ex Miquel as affect by different NaCl concentrations with treatment timing at 50 days after transplanting.
식물의 잎 단위면적당 CO2 동화율은 식물의 광합성 능력에 따라 달라지며 이는 작물 생산량에 영향을 미치고(Gimenez 등, 1992; Peng 등, 1991), 축적된 NaCl은 식물의 수분흡수를 방해하고 식물세포의 기공폐쇄와 함께 광합성 기구 활성을 저해하여 광합성을 감소시킨다(Shannon과 Grieve, 1998; Termaat와 Munns, 1986). 본 실험에서 갯방풍의 기공전도도는 대조구 대비 수확 10일 전 NaCl 150mM 처리에서 56.22%, 수확 5일 전 100mM 처리에서 50.76%의 유의적인 감소가 나타났다(Fig. 7A). 갯방풍의 수분 이용효율은 대조구 대비 수확 10일 전 NaCl 50mM 처리에서 47.58%, 수확 5일 전 NaCl 100mM 처리에서 31.40%의 유의적인 감소가 관찰되었다(Fig. 7B). 광합성률은 대조구 대비 수확 10일 전 NaCl 50mM 처리에서 45.76% 감소, 수확 5일 전 NaCl 100mM 처리에서 57.81%의 유의적인 감소가 나타났다(Fig. 7C). 이와 같은 광합성 지표의 감소는 Lee 등(1998)이 연구한 담배(Nicotiana tabacum L. cv. NC82), 수리취(Lee와 Lee, 2018) 및 고들빼기(Lee 등, 2020)에서 나타난 결과와 일치하였으며 염 스트레스로 식물체 내 이온이 과다하게 축적되어 식물의 수분 퍼텐셜이 낮아지고, 광합성 기구 활성이 저해되었음을 시사한다.
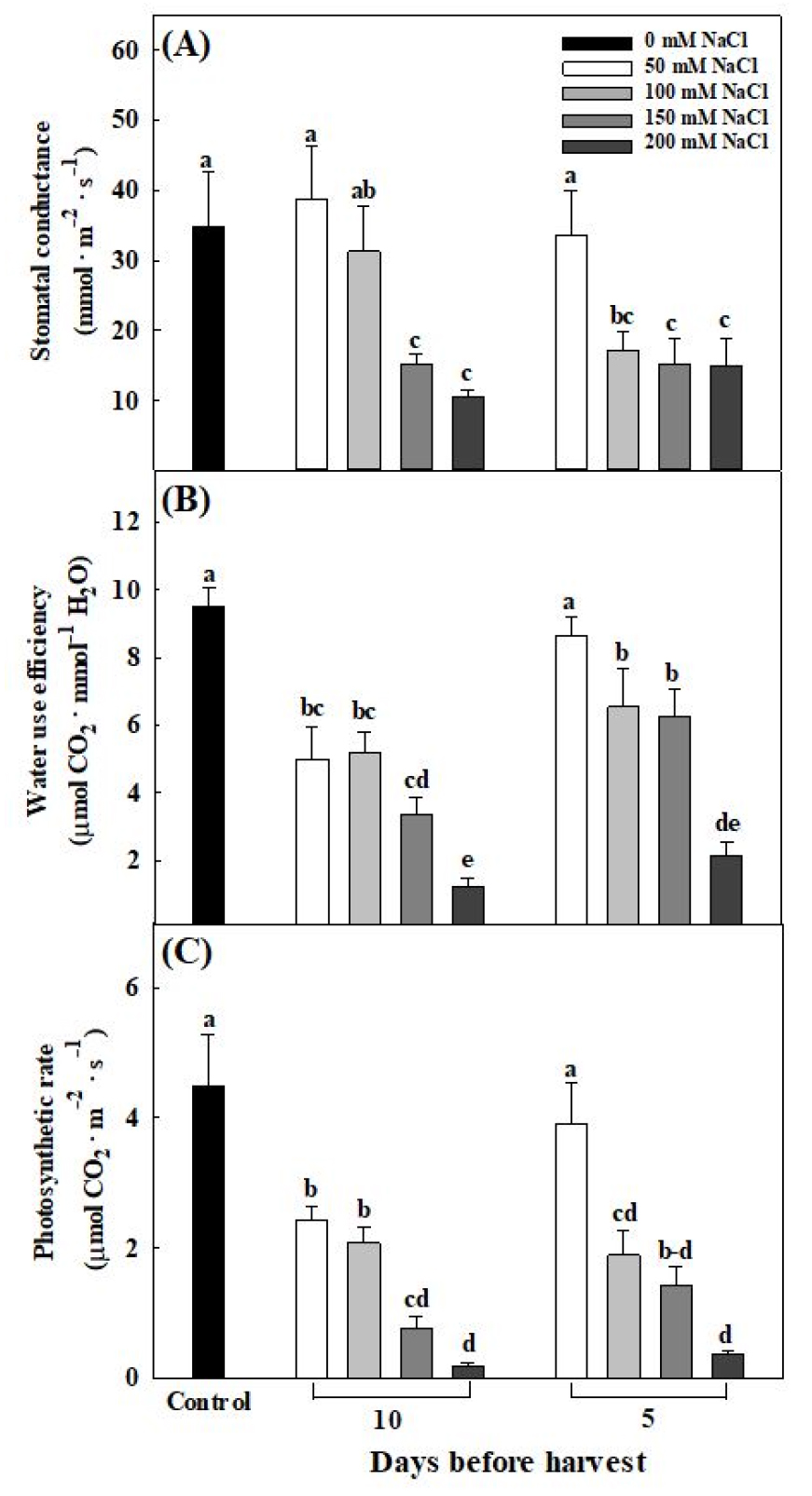
Fig. 7
Stomatal conductance (A), water use efficiency (B), and photosynthetic rate (C) of Glehnia littoralis Fr. Schmidt ex Miquel as affect by different NaCl concentrations and treatment timing at 50 days after transplanting. Vertical bars represent the stand deviation of the mean (n = 6). Different letters above bars indicate significant differences by Duncan’s multiple range test at p ≤ 0.05.
정식 후 50일째에 갯방풍의 총 페놀과 플라보노이드 함량은 NaCl 농도가 증가함에 따라 상대적으로 높아졌으며 특히 수확 5일 전 200mM NaCl 처리에서 가장 우수했다(Fig. 8A와 8B). 스트레스로 광합성 기구가 정상적으로 작동하지 못하면 식물체 내에 활성산소가 축적되는데, 이것은 독성물질로 작용하여 식물세포를 파괴하는 등 생장을 저해한다. 따라서 식물은 생리활성화합물을 생산하여 산화 방어 기작을 개시하는데, 이와 같은 생리활성화합물 함량의 증가는 보리(Hordeum vulgare), 스피아민트(Mentha spicata L.), 양초(Leymus Chinensis Trin.), 타임(Thymus vulgaris L.)의 연구에서 보고되었다(Bistgani 등, 2019; Choi와 Chiang, 2017; Kim 등, 2006; Shim 등, 2018). 마찬가지로 본 실험에서도 갯방풍의 총 페놀, 플라보노이드 함량이 증가하는 경향이었으나, 항산화 활성은 상대적으로 감소하였다(Fig. 8C). 이는 수리취(Synurus deltoides), 가는갯능쟁이(Atriplex gmelinii C. A. Meyer), 로켓풀(Cakile maritima)에서 한계 수준 이상의 산화스트레스에 의해 항산화 능력이 감소하여 나타난 결과와 일치했다(Amor 등, 2006; Bae 등, 2003; Lee와 Lee, 2018). 따라서 200mM NaCl에서 항산화 활성 감소는 갯방풍의 항산화 능력을 초과하여 누적된 활성산소로 산화스트레스가 주어졌기 때문이라고 판단된다.
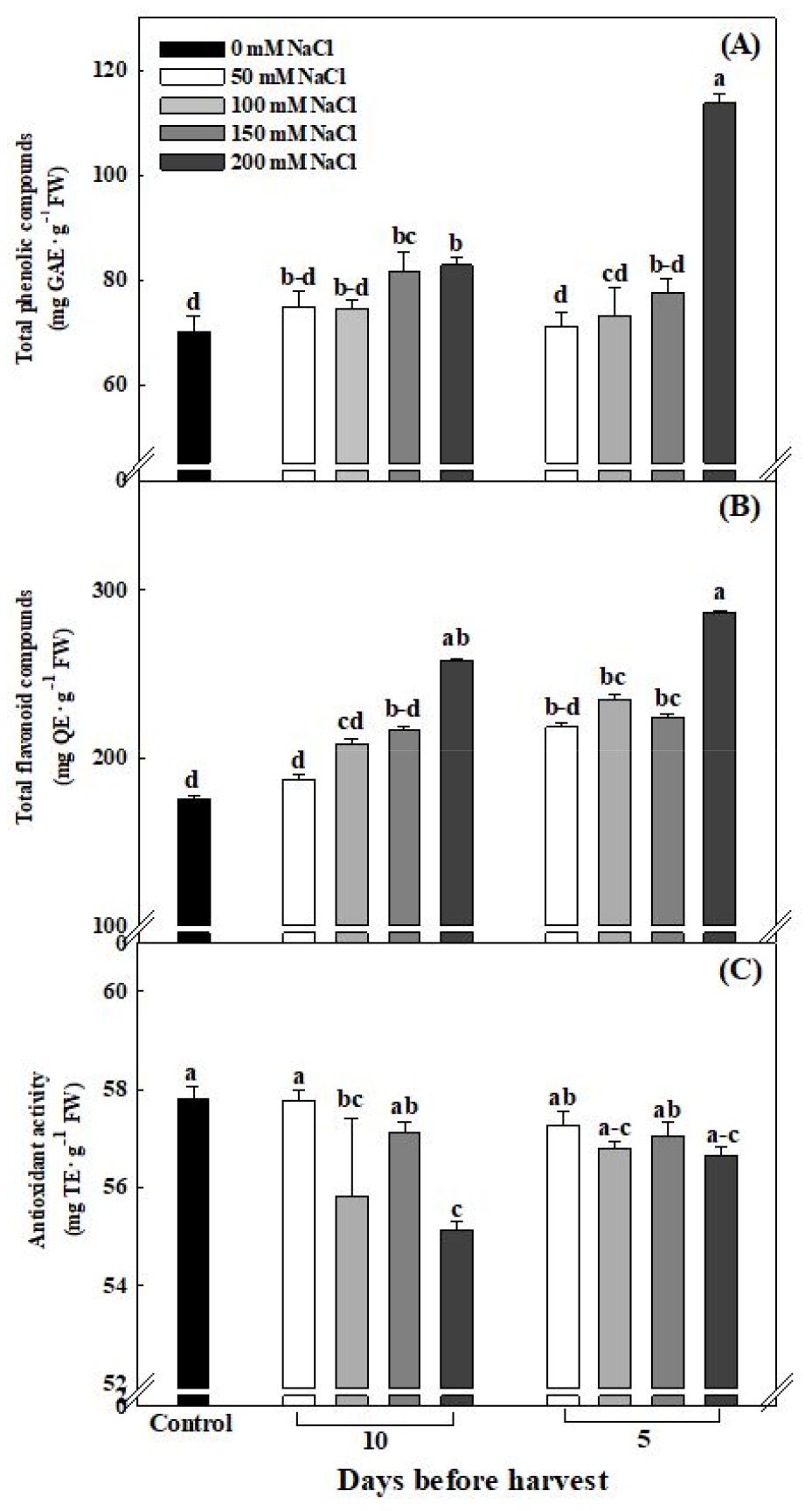
Fig. 8
Total phenolic compound (A), total flavonoid compound (B), antioxidant activity (C) of Glehnia littoralis Fr. Schmidt ex Miquel as affect by different NaCl concentrations and treatment timing at 50 days after transplanting. Vertical bars represent the stand deviation of the mean (n = 6). Different letters above bars indicate significant differences by Duncan’s multiple range test at p ≤ 0.05.
이상의 결과들을 종합하면, 정식 후 30일 동안 40mM 이상의 NaCl 처리 시 생리장해가 나타났으며 NaCl 농도가 증가함에 따라 광합성 지표는 낮아졌다. 수확 10일, 5일 전 NaCl 200mM 처리 시 총 페놀과 플라보노이드 함량이 유의적으로 증가하였으나 낮은 농도의 염 처리구 대비 생육이 저조하였으며, 생존률 및 생장을 고려하였을 때 고품질 갯방풍 생산에는 적합하지 않다고 판단된다. 결론적으로 담액식 수경재배 시스템에서 수확 10일 전 NaCl을 50mM 농도로 처리하는 것이 고품질 갯방풍의 생산을 위해서 효과적일 것으로 판단된다.







