서 론
배초향(Agastache rugosa)은 꿀풀과에 속하는 다년생 초본류로 ‘방아’라고 불리기도 하며 약간의 습기가 있는 양지바른 산야에서 자생하는 식물로 식물체 전체에서 특유의 강한 향기가 나는 것이 특징이다(Choi 등, 2010). Rosmarinic acid, tilianin, acacetin과 같은 약리성분을 함유하고 있어 혈관질환, 구토, 감기, 가래 등을 치료하는 데 사용된다(Choi 등, 2010; Yeo 등, 2021). 국내에서는 약재뿐만 아니라 잎을 채취하여 나물, 부침, 향신료와 같은 식재료로 사용된다(Choi와 Lee, 1999; Yeo 등, 2021). 채소 작물 중 엽채류로 분류되는 배초향은 잎을 수확하여 신선 채소의 형태로 유통 및 소비되는 것으로 알려져 있다(Gopalakrishnan, 2007; Heo 등, 2006; Kwack 등, 2006; Lee, 2019). 따라서, 배초향 잎의 수량과 품질을 늘리는 것은 엽채류로 유통되는 배초향의 수량과 품질을 늘리는 것을 의미한다.
작물의 이용 목적에 따라 영양생장 및 생식생장을 유도하고 조절하는 것은 작물의 수량 및 생산성 증대에 있어 매우 중요하다. 식물은 영양생장기에는 잎, 뿌리, 줄기가 싱크(sink)로 작용하며, 이후 생육상이 전환됨에 따라 생식생장기에 꽃, 과실, 종자 등이 싱크로 작용하여 두 생장기간에는 생장에 있어 길항적 작용을 나타낸다(Araki, 2001; Gardener 등, 2020).
작물의 생육상 전환은 온도, 식물체 내 탄수화물과 질소의 비율, 식물생장조절물질, 광주기 등이 관여한다(Hunter 등, 1977; Lim 등, 2015). 특히, 광주기는 작물의 생육상 전환의 주요인 중 하나로 알려져 있다(Han 등, 2006). 이러한 광주기에 따른 작물의 생육상 전환은 식물의 잎에서 광주기를 인식하여 만들어진 신호전달 물질에 의해 조절된다고 알려져 있다(Pennazio, 2004).
인위적인 광주기 조절을 통한 작물의 생육상 전환은 다양한 원예작물의 수량을 높이기 위해 사용되고 있다. 국화는 단일식물로 알려진 대표적인 화훼 작물로, 목표한 수확기에 맞춰 영양생장을 지속시켜 초세를 키운 후 암막을 통한 단일처리를 통해 생식생장으로 전환시켜 화아분화를 유도한다(Choi 등, 2012). 한국에서 흔히 깻잎으로 알려진 들깨 또한 대표적인 단일식물로, 엽채류로 사용하기 위한 들깨는 생식생장을 억제하기 위해 야간에 시설 내에서 인공광을 이용한 전조재배를 하여 영양생장을 지속하도록 유도한다(Choi 등, 2015; Choi 등, 2019). 또한, ‘설향’, ‘금실’ 등으로 대표되는 일계성 딸기는 저온과 단일조건에서 화아분화가 이뤄진다고 알려져 있으며(Fumiomi와 Michael, 2006; Manakasem과 Goodwin, 1998), 이를 이용하여 인위적인 저온단일 또는 야냉 처리를 통해 일계성 딸기의 화아분화를 유도하는 기술이 현장에서 이용된 바 있다(Jun 등, 2013; Rho 등, 2007).
앞서, Choi 등(2010)은 배초향의 생육을 위한 적정 온도, 차광 정도, 재식 간격에 관한 연구를 진행하였다. 하지만, 앞서 언급한 국화, 들깨 등과 달리 엽채류로 사용하는 배초향의 개화 조건, 생육 전환의 조건 등이 명확히 구명되지 않아 시설 재배 시 환경 조절을 통한 작물의 생육상 전환이 원활히 이뤄지지 않을 경우 식물의 생식생장을 유도하여 잎의 수량 및 품질이 떨어질 수 있다. 따라서, 본 연구는 엽채류 작물인 배초향의 광주기에 따른 개화 특성 및 생육 특성을 확인하고, 이를 바탕으로 배초향의 생식생장을 억제할 수 있는 광주기 조건을 구명하여 배초향의 수량 감소 및 품질 저하를 피할 수 있는 시설 내 환경 조절 방법을 구명하기 위해 수행되었다.
재료 및 방법
1. 식물 재료 및 생육 환경
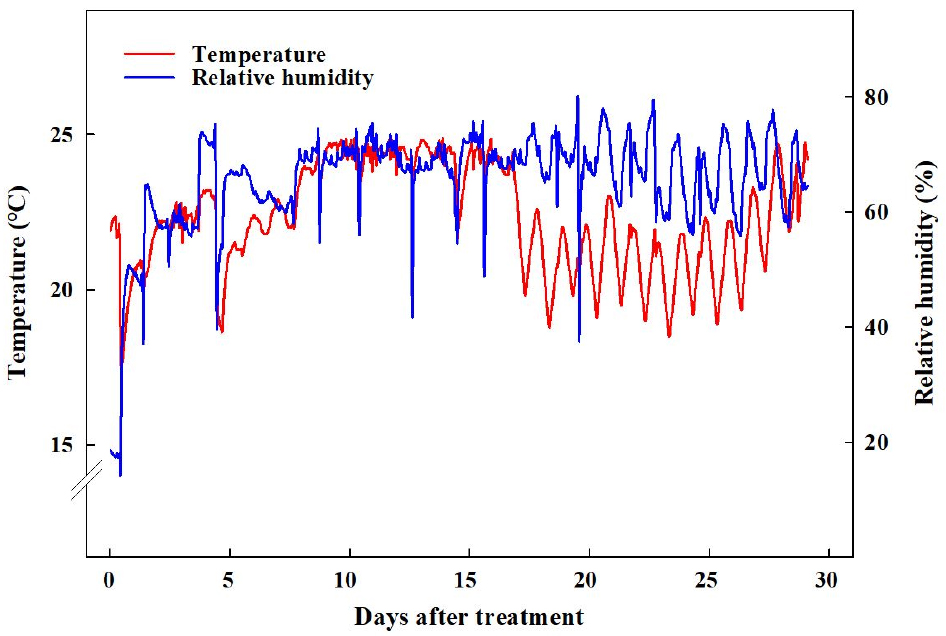
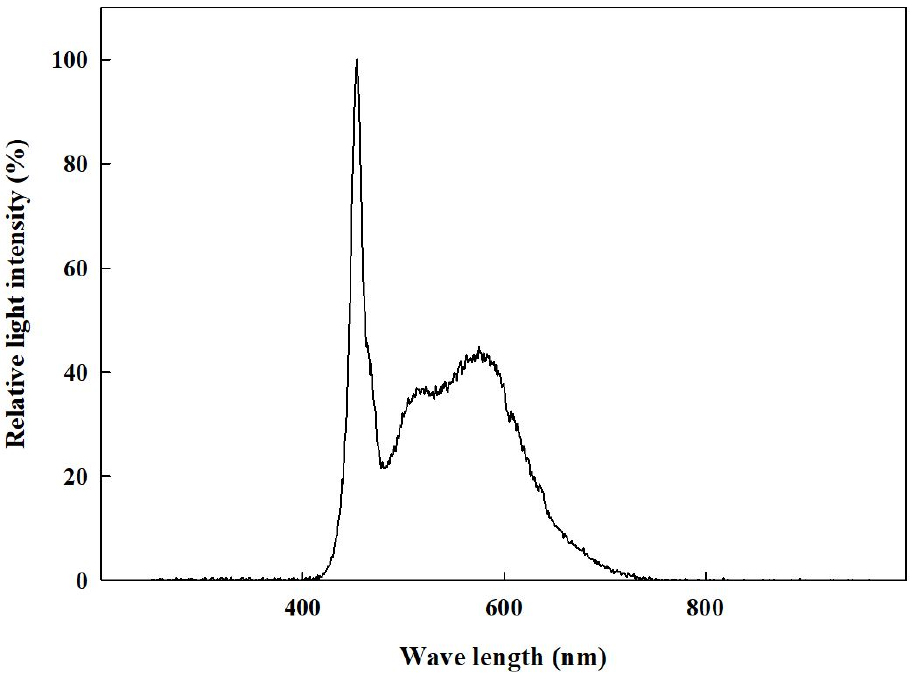
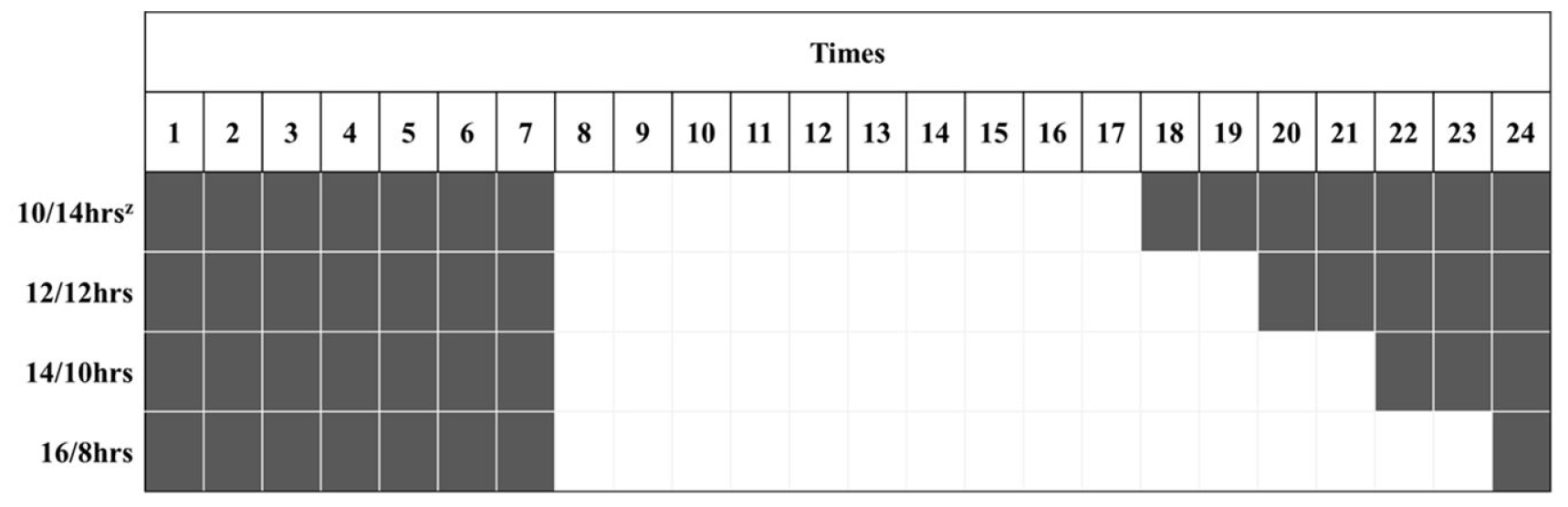
2021년 11월 29일에 경상국립대학교 부속 농장에 위치한 양지붕형 유리온실에서 코이어 배지(Cocopeat Co. Ltd., Dummalasuriya, Sri Lanka)를 충진한 105구 플러그 트레이에 배초향(Agastache rugosa Kuntze) 종자를 파종한 후 본엽이 4매 출현할 때까지 육묘하였다. 2021년 12월 27일에 외경 150mm, 높이 135mm, 내경 90mm인 화분(GS150, Goldstar Chemicals Co. Ltd., Chungju, Korea)에 코이어 배지를 충진한 후에 배초향 묘를 이식한 후 식물생장 워크인 챔버에 배치하였다. 온습도 로거(TR-74Ui, T&D Co. Ltd., Matsumoto, Japan)를 통해 워크인 챔버 내 평균 온도와 상대습도를 모니터링하여 온도는 23 ± 1℃, 평균 상대 습도는 59 ± 17%로 유지되었음을 확인하였다(Fig. 1). 광원으로 백색 LED(light emitting diode, Bissol LED Co. Ltd., Seoul, Korea)를 사용하였다. 광도(photosynthetic photon flux density)는 200 ± 10μmol·m-2·s-1로 설정하였으며, 사용된 광원의 광질을 분광복사계(IFL950, International Light Co. Ltd., MA, USA)를 이용하여 분석하였는데 광파장 분포는 Fig. 2와 같았다. Hoagland 배양액[Ca(NO3)2·4H2O 236.150g·L-1, KNO3 151.65g·L-1, Fe-EDTA 10.528g·L-1, NH4H2PO4 28.765g·L-1, MgSO4·7H2O 123.240g·L-1, H3BO3 0.715g·L-1, MnCl2·4H2O 0.453g·L-1, ZnSO4·7H2O 0.055g·L-1, CuSO4·5H2O 0.020g·L-1, Na2MoO4·2H2O 0.005g·L-1]을 조제하여(Hoagland and Arnon, 1950), EC는 1.0dS·m-1, pH는 6.5로 조절하여, 각 식물체당 50mL씩 2일에 한 번 배지에 직접 공급하였다. 광주기는 시작을 모든 처리구에서 오전 8시로 하였으며, 명기/암기 시간을 각각 10/14hrs, 12/12hrs, 14/10hrs, 16/8hrs로 설정하였다(Fig. 3). 각 처리별 일적산광량(Daily light integral)는 각각 7.20, 8.64, 10.08, 11.52 mol·m-2·d-1이었다. 각 처리는 2021년 12월 27일에 시작하여 2022년 1월 24일까지 총 29일간 진행되었다.
2. 생육 조사
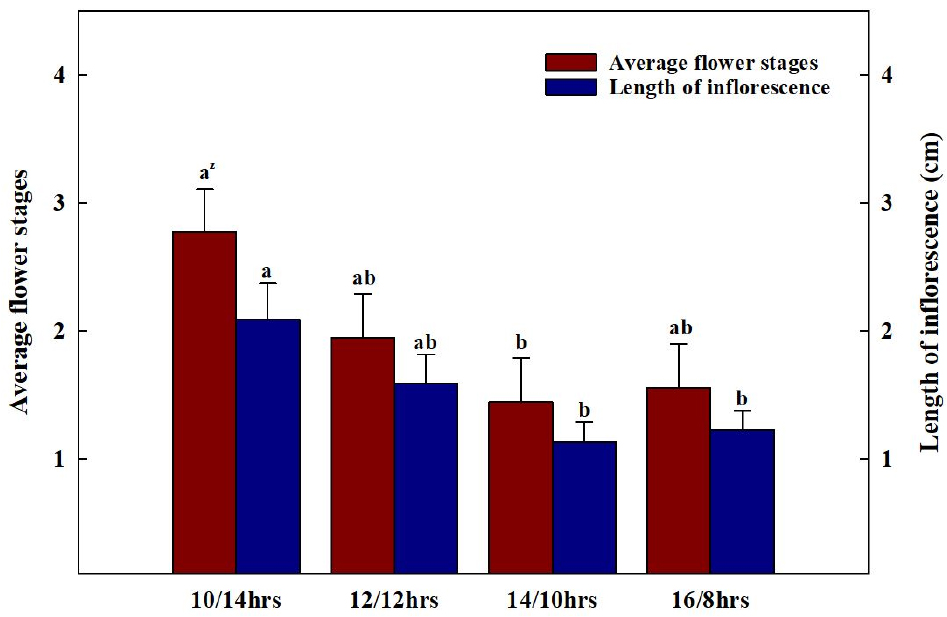
광주기 처리 후 모든 처리구 중 100% 개화율을 보인 처리구가 발견되는 시점에 모든 처리구들의 지상부를 수확하여 초장, 엽장, 엽폭, 엽수, SPAD, 생체중 및 건물중, 엽면적을 측정하였다. 초장은 지제부에서부터 식물체의 생장점까지의 높이를 측정하였으며, 엽장과 엽폭, SPAD는 완전히 전개된 4번째 본엽에서 측정하였다. 엽면적은 엽면적 측정기(LI-3000, LI-COR Inc., Lincoln, NE, USA)를, 생체중과 건물중은 전자저울(EW220-3NM, Kem&Sohn GmbH., Balingen, Germany)을 이용하여 측정하였다. 건물중은 시료를 70℃ 항온 건조기(Venticell-222, MMM Medcenter Einrichtungen GmbH., Planegg, Germany)에서 72시간 건조한 후 측정하였다. SPAD 값은 엽록소 측정기(SPAD-502, Konica Minolta Inc., Tokyo, Japan)를 이용하여 측정하였다. 화서 발달을 조사하기 위해 단계별 개화 수준을 육안으로 구분하여 측정하였으며(Fig. 4), 화서 길이를 측정하였다.
3. 통계분석
실험은 완전 임의 배치된 실험구 내에서 3반복으로 진행되었다. 통계분석은 SAS 프로그램(SAS 9.4, SAS Institute Inc., Cary, NC, USA)을 이용하여 분산분석(ANOVA)을 실시하였고, 처리 간 평균 차이는 Tukey 다중검정을 이용하여 5% 유의수준에서 검증하였다. 그래프는 SigmaPlot 프로그램(SigmaPlot 12.5, Systat Software Inc., San Jose, CA, USA)을 이용하여 작성하였다.
결과 및 고찰
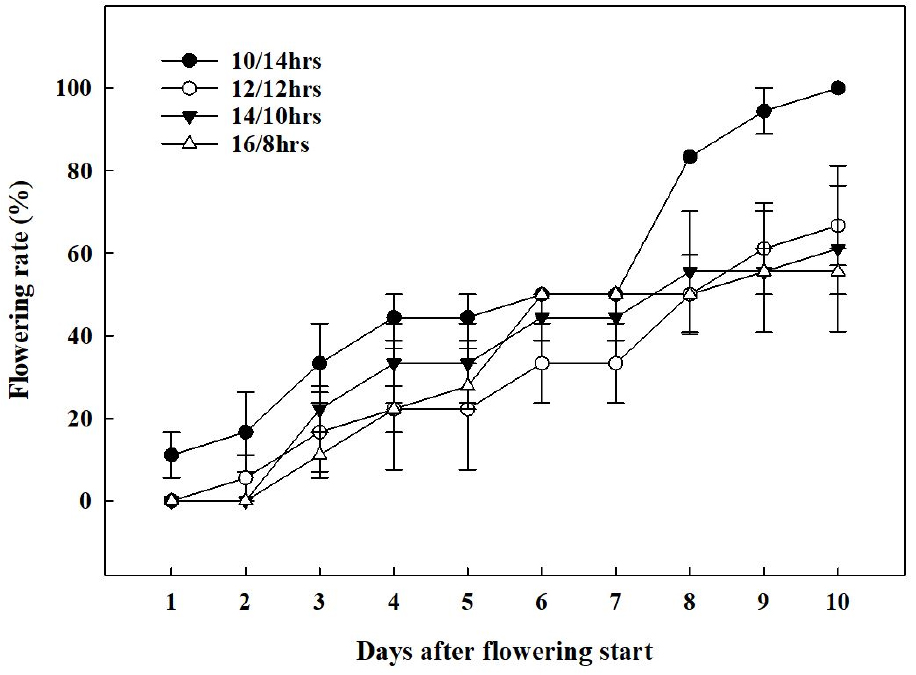
배초향의 첫 개화는 가장 광주기가 짧았던 10/14hrs에서 가장 먼저 관찰되었다(Fig. 5). 10/14hrs의 첫 개화일(1일차)을 시점으로 2일차에는 12/12hrs에서 개화가 시작되었으며, 이외 다른 처리구들에서는 3일차에 개화가 시작되었다. 첫 개화가 관측되고 10일이 지난 시점에서 10/14hrs에서 100%의 개화율을 보였다. 단일식물은 광주기가 짧을수록 phytochrome, 신호전달물질의 작용, sucrose 흡수 기작의 변화, DNA의 발현 정도에 따라 개화 속도가 빨라진다(Higuchi 등, 2013; Yanovsky와 Kay, 2002). 또한, 영양생장에서 생식생장으로 넘어가기 위한 한계일장을 가지고 있는 질적단일식물(obligate qualitative short-day plant)과 다르게(Gardner 등, 2006; Harmon 등, 2005; Mcclung, 2006), 배초향은 개화 속도가 늦어질 뿐, 일장이 길어져도(14/10hrs, 16/8hrs) 개화가 진행되는 양적단일식물(facultative quantitative short-day plant)의 특성을 보였다(Higuchi 등, 2013). 이를 통해 배초향은 꽃의 출현을 위한 한계 일장은 없으나, 광주기가 짧을수록 개화 및 화서의 발달이 촉진되는 양적단일식물임을 확인할 수 있었다.
각 처리 간 단계별 개화 수준은 명주기가 암주기보다 짧았던 10/14hrs가 명주기가 암주기보다 길었던 14/10hrs, 16/8hrs에 비해 유의적으로 높았고(Fig. 6과 7), 화서의 길이도 이와 유사한 경향을 보이는 것을 확인하였다. Kim 등(2021)은 배초향과 같이 총상화서로 꽃이 발생하는 긴산꼬리풀의 화서의 길이가 증가함에 따라 꽃의 발달 정도가 증가했다고 보고하였으며, Gardener 등(2020)은 영양생장기에서 생식생장기로 접어든 식물에서 동화산물이 화기, 과실, 종자 등의 생식생장 부위에 집중적으로 분배된다고 보고하였다. 이를 통해 배초향은 낮의 길이 10시간 내외 조건에서 생식생장으로의 전환이 빠르고 이에 따라 생식기관으로의 동화산물의 분배가 많아져 화서의 발달속도가 빨라진 것으로 판단된다.
배초향의 엽장, 엽수, 생체중, 건물중, 엽면적은 광주기가 짧을수록 감소하는 경향을 나타냈다(Table 1). 초장, 엽폭, SPAD는 처리 간 통계적으로 유의적인 차이를 나타내지 않았다. 이를 통해 배초향의 영양기관은 장일조건에 더 발달하는 것을 확인할 수 있다. Higuchi 등(2012)은 단일식물인 국화에 인위적인 야파(night interruption)처리를 하였을 때, 단일조건에 둔 국화에 비해 엽수가 증가하는 것을 확인하였으며, 생식생장이 일어나지 않는 돌연변이 국화에서 일반적인 국화에 비해 더 많은 엽수의 증가가 관찰되었다고 보고하였다.
Table 1.
Growth characteristics of Agastache rugosa Kuntze as affected by various photoperiod after 28 days from planting.
| Treatmentz |
Plant height (cm) |
Leaf length (cm) |
Leaf width (cm) |
No. of leaves |
Leaf area (cm2/plant) | SPAD |
Fresh weight (g/plant) |
Dry weight (g/plant) |
| 10/14hrs | 34.28 ay | 5.54 b | 4.63 a | 25.72 c | 389.79 b | 42.77 a | 12.18 c | 1.77 b |
| 12/12hrs | 36.34 a | 6.00 a | 4.90 a | 28.22 bc | 437.76 ab | 40.08 a | 13.82 bc | 2.07 b |
| 14/10hrs | 35.86 a | 5.62 ab | 4.93 a | 31.05 a | 432.04 ab | 41.78 a | 14.55 ab | 2.12 ab |
| 16/8hrs | 35.34 a | 6.05 a | 4.90 a | 29.72 ab | 484.17 a | 42.44 a | 16.17 a | 2.48 a |
zRefer to Fig. 3 for details on photoperiod.
따라서 장일조건의 배초향에서 단일조건의 배초향에 비해 영양기관이 발달한 것은 생식기관의 발달이 단일조건의 배초향에 비해 억제되었기 때문에(Fig. 6), 광합성을 통해 생산한 동화산물이 영양기관의 발달에 사용된 결과인 것으로 판단된다. 결론적으로 엽채류로 사용하는 배초향의 가식부위인 잎의 생육을 증가시키고 꽃의 출현을 지연시키기 위해서는 단일조건을 피하고 장일조건에서 영양생장을 시켜 배초향을 재배해야 할 것으로 판단된다.