서 론
재료 및 방법
1. 실험 재료 및 재배환경
2. 양액 처리 및 공급 방법
3. 생육조사
4. 시료 전처리 및 상층액 추출
5. Chlorophyll a, chlorophyll b 및 total carotenoid 함량 분석
6. Total glucosinolate contents 분석
7. Total phenolic contents 분석
8. 통계분석
결과 및 고찰
1. 생육 분석
2. 기능성 물질 함량 분석
서 론
십자화과는 전 세계적으로 영양적 및 경제적 가치가 높은 식물군으로(Rahman 등, 2018), 약 338개 속과 3,709개 종으로 구성되어 있다. 이 식물들은 주로 십자 모양의 꽃을 특징으로 한다(Cheng 등, 2014; Warwick 등, 2006). Brassica 속에는 적갓(Brassica juncea (L.) Czern.), 적겨자(Brassica juncea L.), 케일(Brassica oleracea L. var. acephala (DC.) Alef.) 등이 포함되고, 전세계적으로 유지종자, 채소, 샐러드 등 광범위하게 활용되고 있다(Salehi 등, 2021). 십자화과 식물은 글루코시놀레이트(GSLs, glucosinolates), 플라보노이드(flavonoids), 토코페롤(tocopherol), 카로티노이드(carotenoids), 비타민C(ascorbic acid)와 같은 성분들이 풍부하다고 알려져 있다(Dekker 등, 2000; Manchali 등, 2012; Nawaz 등, 2018; Verkerk 등, 2009). 특히 GSLs는 약 130가지 이상의 다양한 구조를 가지며(Nguyen 등, 2020), 십자화과에서는 200종 이상의 GSLs가 합성된다(Soundararajan와 Kim, 2018). 이러한 GSLs는 항암, 항산화, 항염 및 항균 등의 효능이 있어 많은 연구자들의 관심을 끌고 있다(Keck와 Finley, 2004; Miękus 등, 2020; Traka, 2016).
수경재배는 식물에 필요한 영양소를 정밀하게 공급할 수 있어 생산량 증대와 품질 개선 측면에서 경제적 효율성을 제공한다(Al Meselmani, 2022; Cho 등, 2018). 그러나 토양 재배에 비해 근권부의 완충 능력이 낮아, 양액이 부적절한 전기전도도(EC, Electrical Conductivity)로 공급되면 식물 스트레스 증가와 생산량 감소 등을 초래할 수 있다(Kim 등, 2018). 최근 수경재배 연구에서는 작물 생장을 극대화하기 위해 양액의 조성, pH 및 EC 관리가 중요하게 대두되고 있다(Gillespie 등, 2021; Othman 등, 2019). EC는 양액 내 염 농도를 나타내는 지표로, 수경재배 시스템에서 영양 상태를 평가하는 중요한 역할을 한다(Ding 등, 2022; Marques 등, 2019). Ding 등(2018)은 극단적으로 낮거나 높은 EC(0-9.6dS·m-1)에서 작물의 성장이 억제되고 광합성률이 저하된다고 보고하였으며, 극단적인 EC 조건에서 작물의 광합성, 생육, 항산화 효소 활성의 변화와 관련된 연구가 진행되어 왔다(Ding 등, 2018; Gillespie 등, 2021; Hosseini 등, 2021; Lee 등, 2012). 또한, EC 농도를 급격히 변화시키는, 즉 높은 EC에서 낮은 EC로 변화시키거나 그 반대로 변화시키는 처리를 할 경우, 작물의 생육 및 기능성 물질 변화와 관련된 연구가 진행되었다(Sakamoto와 Suzuki, 2020). 그러나 이러한 기존 EC 연구들은 주로 정식 후 일정한 EC 유지 또는 단기간의 EC 변화가 작물 생육과 기능성 물질에 미치는 영향을 다루었으며, 다양한 EC 농도와 처리 기간 변동에 대한 연구는 미흡한 실정이다. 따라서 본 연구에서는 EC 조절이 십자화과 작물의 생육 및 이차대사산물에 미치는 영향을 체계적으로 분석하고, 실질적인 농업적 적용 가능성을 모색하고자 한다. 이를 위해 육묘부터 정식까지 EC 1.5dS·m-1로 처리한 후, 수확 1주 및 3주 전 EC를 1.5, 3.0, 4.5, 6.0dS·m-1로 조정하여 십자화과 작물 3종의 생육과 기능성 물질 함량의 변화를 분석하였다.
재료 및 방법
1. 실험 재료 및 재배환경
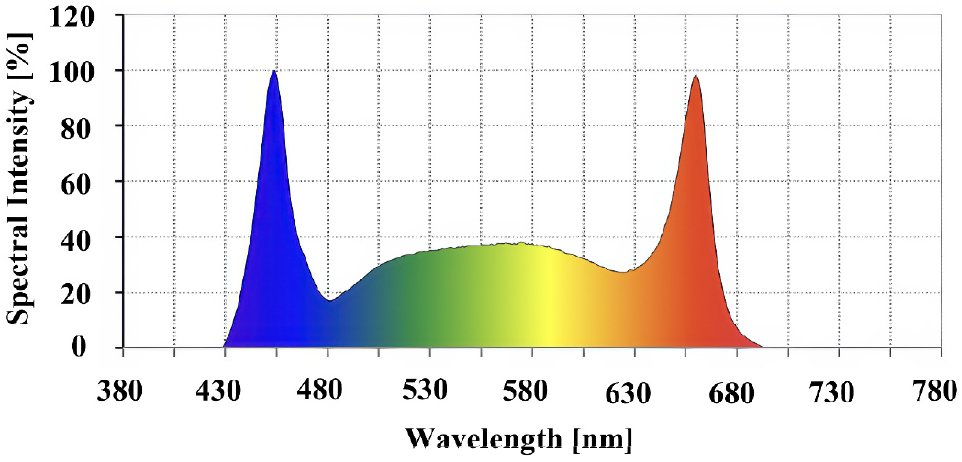
갓(Brassica juncea (L.) Czern., ‘적갓’), 적겨자(Brassica juncea L., ‘적대엽고채’), 케일(Brassica oleracea L. var. acephala (DC.) Alef, ‘레드러시안’) 종자를 아시아종묘(Asia seed Co., Ltd., Seoul, Korea)에서 구매하였으며, 포수된 암면플러그(AO plug, Grodan, Roermond, The Netherlands)에 파종하여 105구 육묘 트레이에 육묘하였다. 파종 후 3주간 LED 조명(H22P, APACK Inc., Korea)을광주기 14/10시간(명/암), 광강도 180±20μmol·m-2·s-1(Fig. 1), 온도 22±3℃, 상대습도 60±10% 조건에서 육묘하였다. 본 실험에 사용한 재배 베드[1,380mm(길이)×700mm(폭)×2,075mm(높이)]는 3단 구조로, 각 단의 높이는 400mm로 구성하였다. 각 단에는 PVC 재질의 박막수경(nutrient film technique, NFT)[1,275mm(길이)×115mm(폭)×55mm(높이)] 거터 3개씩 배치되었으며, 총 4개의 독립적인 재배 베드 모듈에서 실험을 진행하였다. 육묘 후 직경 70mm 포트에 넣고 100mm 간격으로 박막수경 시스템에 정식하여, 형광등(TLD 32W/865RS, Philips, Netherlands) 아래에서 광강도 180±20μmol·m-2·s-1, 온도 22±3℃, 상대습도 60±10% 조건에서 재배하였다.
2. 양액 처리 및 공급 방법
파종 후 본엽이 발생한 시점부터 Table 1에 제시된 Yamazaki 양액을 pH 6.5±0.5, EC 1.5dS·m-1로 2일 간격으로 저면 관수를 통해 공급하였다. 파종 이후에는 130L 크기의 양액 탱크를 재배 베드 모듈 하단에 설치하여 수중 펌프(PD-G050M, WILO Co., Ltd., Germany)를 사용해 24시간 동안 양액을 순환시켰다. 대조구와 처리구에는 각각 별도의 양액 탱크를 배치하였으며, 실험 시작 시 설정된 pH 및 EC를 기준으로 일주일마다 보정해주었다. EC 처리는 정식 후 1W와 3W로 구분하여 실행하였다. 1W 처리는 정식 후 3주간 양액 EC를 1.5dS·m-1로 유지한 후 수확 전 1주 동안 EC를 1.5(대조구), 3.0, 4.5, 6.0dS·m-1로 변경하였다. 3W 처리의 경우 정식 후 1주간 EC 1.5dS·m-1을 유지한 후, 수확 전 3주 동안 1W 처리와 동일한 범위의 EC로 변경하여 처리하였다.
Table 1.
Composition of nutrient solution.
3. 생육조사
정식 4주 후, 각 처리구에서 3주(n = 3)의 샘플을 수확하여 생육조사를 실시하였다. 지상부 생체중은 전자저울(MW-2N, CAS Co., Ltd., Korea)을 이용하여 측정하였으며, 지상부 건물중은 측정된 시료를 봉투에 넣어 80℃로 설정된 열풍 건조기(HB-501M, Hanbaek Scientific Technology Co., Ltd., Bucheon, Korea)에서 1주일간 건조한 후, 전자저울로 다시 측정하였다. 또한, 엽수와 엽면적은 엽면적 측정기(Li-3100C, Li-Cor Corporation, Lincoln, NE, USA)를 이용하여 측정하였으며, 엽록소 함량을 측정하기 위해 SPAD(SPAD 502, Minolta, Japan)를 이용하였다.
4. 시료 전처리 및 상층액 추출
액체질소로 샘플을 급속 냉각하여 -70℃에 냉동 보관한 후 동결 건조기(TFD5503, ilSinBioBase., Korea)를 이용하여 건조시켰으며, 건조된 시료를 분말화 하였다. 건조된 시료 20mg을 2.0mL의 Eppendorf-tube에 넣고, 90% H2O-Methanol 용매 2mL를 추가했다. Voltex mixer(SI-0246A, Coleparmer., USA)로 섞어준 후, 40°C, 20분 동안 ultrasonic Bath(powersonic420, Hwashin Tech Co., Ltd., Korea)의 중간강도로 초음파 처리를 하였다. 원심분리기(Smart 15 plus, Hanil., Korea)를 이용하여 4℃, 15,000RPM으로 5분간 원심 분리하여 상층액을 취하였다.
5. Chlorophyll a, chlorophyll b 및 total carotenoid 함량 분석
Chlorophyll a, chlorophyll b, total carotenoids 함량은 Lichtenthaler와 Buschmann(2001)의 방법으로 분석하였다. 앞서 취한 상층액 200µL를 96 well plate(SPL30096, SPL., Korea)에 분주한 후, microplate spectrophotometer(EpochTM, Agilent Technologies., USA)를 사용하여, 652, 665nm에서 흡광도를 측정하고 아래 방정식으로 계산하였다.
, 와 는 각각 665.2nm, 652.4nm, 470nm에서 시료의 흡광도 값을 의마하며, 은 chlorophylls a; 는 chlorophylls b; 는 total carotenoids를 나타낸다.
6. Total glucosinolate contents 분석
Mawlong 등(2017)의 방법에 따라 총 GSLs를 분석하였다. 상층액 50µL과 2mM sodium tetrachloropalladate(dissolved in 90% MeOH) 1.5mL를 1.5mL의 Eppendorf-tube에 혼합하여 실온에서 1시간 동안 반응시켰다. 이후 96 well plate(SPL30096, SPL., Korea)에 200µL 씩 분주하여 Microplate Spectrophotometer으로 425nm에서 흡광도를 측정하고 아래 방정식으로 계산하였다.
는 425nm에서 시료의 흡광도 값을 의미한다.
7. Total phenolic contents 분석
총 페놀함량(TPC)은 Severo 등(2011)의 방법을 변형하여 측정되었다. 표준물질인 galic acid(G7384-100G, Sigma-Aldrich, St Louis, MO, USA)를 이용한 표준검정곡선법으로 시료의 함량을 구하였다. 75μL의 상층액과 Folin-Ciocalteu reagent(F9252-100ML, Sigma-Aldrich, St Louis, MO, USA) 75μL, 3차 증류수 1,125µL를 1.5mL Eppendorf-tube에 혼합하여 5분 반응시켰다. 이후 7.5% Na2CO3 solution 225µL를 추가해 40분간 상온 반응시켰다. 96 well plate(SPL30096, SPL., Korea)에 200μL씩 분주하여 microplate spectrophotometer으로 765nm에서 흡광도를 측정하였고, gallic acid를 이용해 standard curve에 대입하여 함량 값을 계산하였다.
8. 통계분석
측정한 데이터의 처리 간 통계분석을 위해 SPSS(SPSS26, SPSS Inc., Chicago, IL, USA) 프로그램을 사용하였으며, 평균 간 유의차 검증을 위해 Tukey의 다중검정법으로 유의수준 p < 0.05에서 분석하였다.
결과 및 고찰
1. 생육 분석
생육분석 결과, 1W 처리의 경우 적갓의 지상부 생체중, 건물중, 엽면적은 EC 3.0dS·m-1에서 가장 높은 평균값을 나타내었지만, EC 6.0dS·m-1을 제외하고 다른 처리구간의 유의적 차이는 발생하지 않았다(Table 2). 3W 처리는 대조구와 비교하여 EC 3.0dS·m-1에서 지상부 생체중, 건물중, 엽면적이 각각 57.5, 52.4, 60.8% 유의미하게 증가한 결과값을 보여주었다. 적겨자의 경우 1W 처리의 EC 4.5dS·m-1이 지상부 생체중, 건물중에서 대조구와 비교하여 높은 평균값을 보였지만, 유의적으로는 차이가 없었다. 3W 처리에서 지상부 생체중, 건물중의 경우 대조구에 비해 각각 36.9, 29.1% 유의하게 감소하였다. 케일에서는 1W 처리의 EC 4.5dS·m-1가 지상부 생체중에서 대조구보다 51.6% 유의하게 증가했다. 지상부 건물중, 엽수, 엽면적, SPAD에서는 대조구보다 각각 14.6, 3.1, 73.4, 9.7% 증가하였지만 유의적 차이는 보이지 않았다. 3W 처리에서는 대조구보다 EC 4.5dS·m-1이 지상부 생체중, 건물중, 엽면적이 각각 127.2, 180.8, 136.1%로 통계적으로 유의적으로 증가하였다.
Table 2.
The growth parameters of leaf mustard, red mustard and kale at different EC treatment cycle and concentration.
| Species | Before harvest |
EC (dS·m-1) |
Shoot fresh weight (g) |
Shoot dry weight (g) | Leaf Number |
Leaf area (cm2) | SPAD |
| Leaf mustard | 1W | Control | 179.83 a | 10.73 a | 16.33 | 2549.90 a | 37.47 |
| 3.0 | 198.39 a | 10.83 a | 15.33 | 2176.80 a | 33.40 | ||
| 4.5 | 160.43 a | 7.60 b | 20.00 | 1973.59 a | 37.30 | ||
| 6.0 | 65.55 b | 3.20 c | 11.67 | 962.79 b | 39.73 | ||
| Significance | *** | *** | NS | * | NS | ||
| 3W | Control | 105.47 b | 5.97 b | 18.00 | 1622.50 b | 39.13 | |
| 3.0 | 166.09 a | 9.10 a | 26.33 | 2608.38 a | 35.37 | ||
| 4.5 | 109.30 b | 6.17 b | 21.33 | 1505.91 b | 43.23 | ||
| 6.0 | 79.09 c | 4.61 c | 16.00 | 1063.72 c | 51.77 | ||
| Significance | *** | *** | NS | *** | NS | ||
| Red mustard | 1W | Control | 96.94 ab | 5.03 ab | 8.67 | 911.10 | 29.27 ab |
| 3.0 | 110.38 a | 5.63 a | 9.33 | 1008.47 | 23.27 b | ||
| 4.5 | 117.13 a | 5.70 a | 10.00 | 1264.38 | 36.03 ab | ||
| 6.0 | 74.36 b | 3.42 b | 9.00 | 714.63 | 44.93 a | ||
| Significance | ** | * | NS | NS | * | ||
| 3W | Control | 89.53 a | 4.36 a | 8.67 | 995.66 | 25.80 b | |
| 3.0 | 73.82 ab | 3.75 ab | 10.67 | 1070.73 | 26.50 b | ||
| 4.5 | 56.72 b | 3.09 b | 9.00 | 664.90 | 37.03 ab | ||
| 6.0 | 85.88 ab | 4.22 ab | 10.33 | 773.22 | 44.97 a | ||
| Significance | * | * | NS | NS | ** | ||
| Kale | 1W | Control | 92.23 b | 6.17 ab | 10.67 | 835.86 | 40.27 |
| 3.0 | 113.00 b | 6.03 ab | 9.67 | 1205.58 | 34.90 | ||
| 4.5 | 139.83 a | 7.07 a | 11.00 | 1449.58 | 44.17 | ||
| 6.0 | 96.42 b | 4.97 b | 11.33 | 1260.55 | 44.30 | ||
| Significance | ** | * | NS | NS | NS | ||
| 3W | Control | 38.64 b | 1.82 b | 10.33 | 432.89 b | 40.93 | |
| 3.0 | 55.99 b | 2.98 b | 13.00 | 802.63 a | 33.80 | ||
| 4.5 | 87.79 a | 5.11 a | 17.00 | 1022.20 a | 45.00 | ||
| 6.0 | 101.45 a | 6.02 a | 16.67 | 994.36 a | 50.07 | ||
| Significancez | *** | *** | NS | *** | NS | ||
높은 염분 스트레스는 뿌리 주변의 삼투압을 증가시켜 작물의 수분 흡수를 방해하며, 이로 인해 뿌리에서 물 흡수가 줄어들고 식물체 내에 이온 불균형이 발생한다. 이러한 과정에서 세포 기능이 손상되고 광합성 및 생장에도 부정적인 영향을 미친다(Fu와 Yang, 2023; Lu와 Fricke, 2023; Rahneshan 등, 2018). 토마토(Choi 등, 2017)와 청경채(Ding 등, 2018) 등 다양한 작물에서 높은 염분 스트레스가 생체중과 생장에 부정적 영향을 미친다는 연구 결과가 보고되었다. 그러나 케일은 염분에 강한 내성을 가진 작물로, 염분 노출 기간에 따라 생장 반응이 달라진다(Devi와 Arumugam, 2019; Kimera 등, 2023). 본 실험에서도 1W 처리의 케일은 EC 4.5dS·m-1에서 지상부 생체중이 높았으나, EC 6.0dS·m-1에서 감소하였다. 반면, 3W 처리에서는 EC 농도가 증가함에 따라 생체중이 증가하여 EC 6.0dS·m-1에서 가장 높은 값을 보여준 것과 유사하다.
2. 기능성 물질 함량 분석
정식 4주 후 기능성 물질 함량을 분석한 결과, 적갓은 1W 처리에서 chlorophyll a, chlorophyll b, total chlorophyll, total carotenoid, total phenolic 함량이 EC 3.0dS·m-1에서 가장 높은 값을 보였으나, 대조구 대비 유의적 차이가 없었다(Fig. 2). 3W 처리에서 대조구 대비 EC 3.0dS·m-1에서 total glucosinolate, total phenolic은 각각 50.3, 79.4% 유의적으로 증가하였다. 적겨자는 1W 처리의 EC 4.5dS·m-1에서 chlorophyll a, chlorophyll b, total chlorophyll이 각각 41.8, 83.0, 55.4% 대조구보다 통계적으로 유의미하게 증가하였다(Fig. 3). Total glucosinolate와 total phenolic 함량은 대조구와 비교하여 EC 4.5dS·m-1에서 가장 높았으나 유의적인 차이는 없었다. 3W 처리의 EC 6.0dS·m-1에서 chlorophyll b, total chlorophyll 함량이 대조구와 비교하여 각각 58.3, 32.0% 유의하게 증가하였다. Total glucosinolate는 대조구와 처리구간의 유의적인 차이는 없었다. 케일의 경우 1W 처리의 3.0dS·m-1이 chlorophyll a, total chlorophyll 함량에서 대조구와 비교하여 각각 31.1, 50.5% 증가하였고, total chlorophyll은 유의미한 차이가 있었다(Fig. 4). Total carotenoid, total glucosinolate, total phenolic은 4.5dS·m-1에서 대조구보다 각각 201.2, 160.1, 271.9% 증가했으며, total phenolic은 유의한 차이가 발생하였다. 3W 처리에서 chlorophyll a, chlorophyll b, total chlorophyll, total carotenoid, total glucosinolate, total phenolic의 함량의 경우 EC 6.0dS·m-1에서 가장 높은 수치를 보였으며, total glucosinolate, total phenolic은 대조구와 비교하여 EC 6.0dS·m-1에서 232.9, 392.7% 증가하였다.
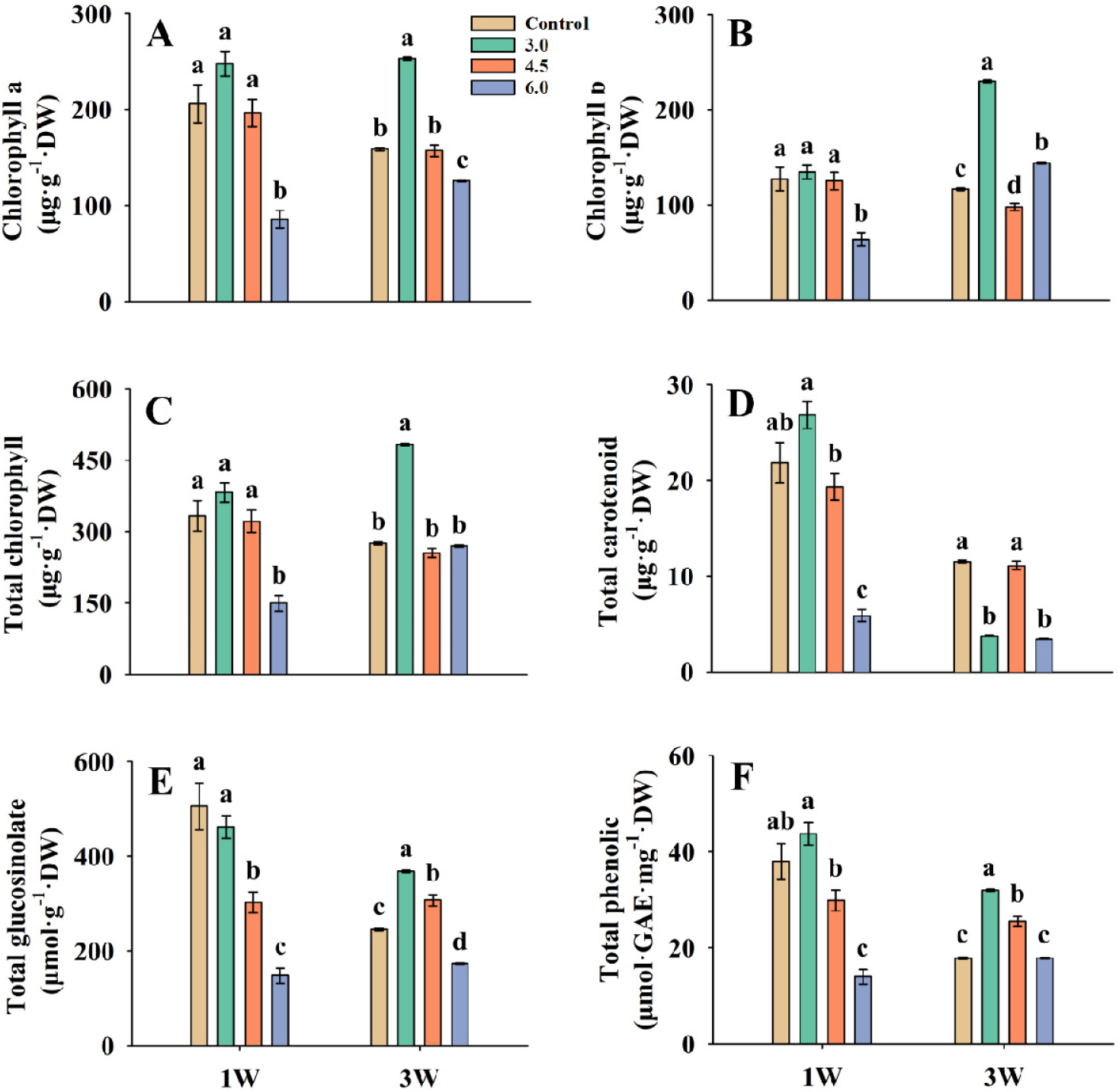
Fig. 2
Chlorophyll a (A), chlorophyll b (B), total chlorophyll (C), total carotenoid (D), total glucosinolate (E), and total phenolic (F) of leaf mustard in different EC under the 1W and 3W treatments before harvest. The bars represent the means and the error bars indicate standard error (n = 3). Different letters at the top of bars indicate significant difference (p < 0.05) by Tukey’s multiple range test.
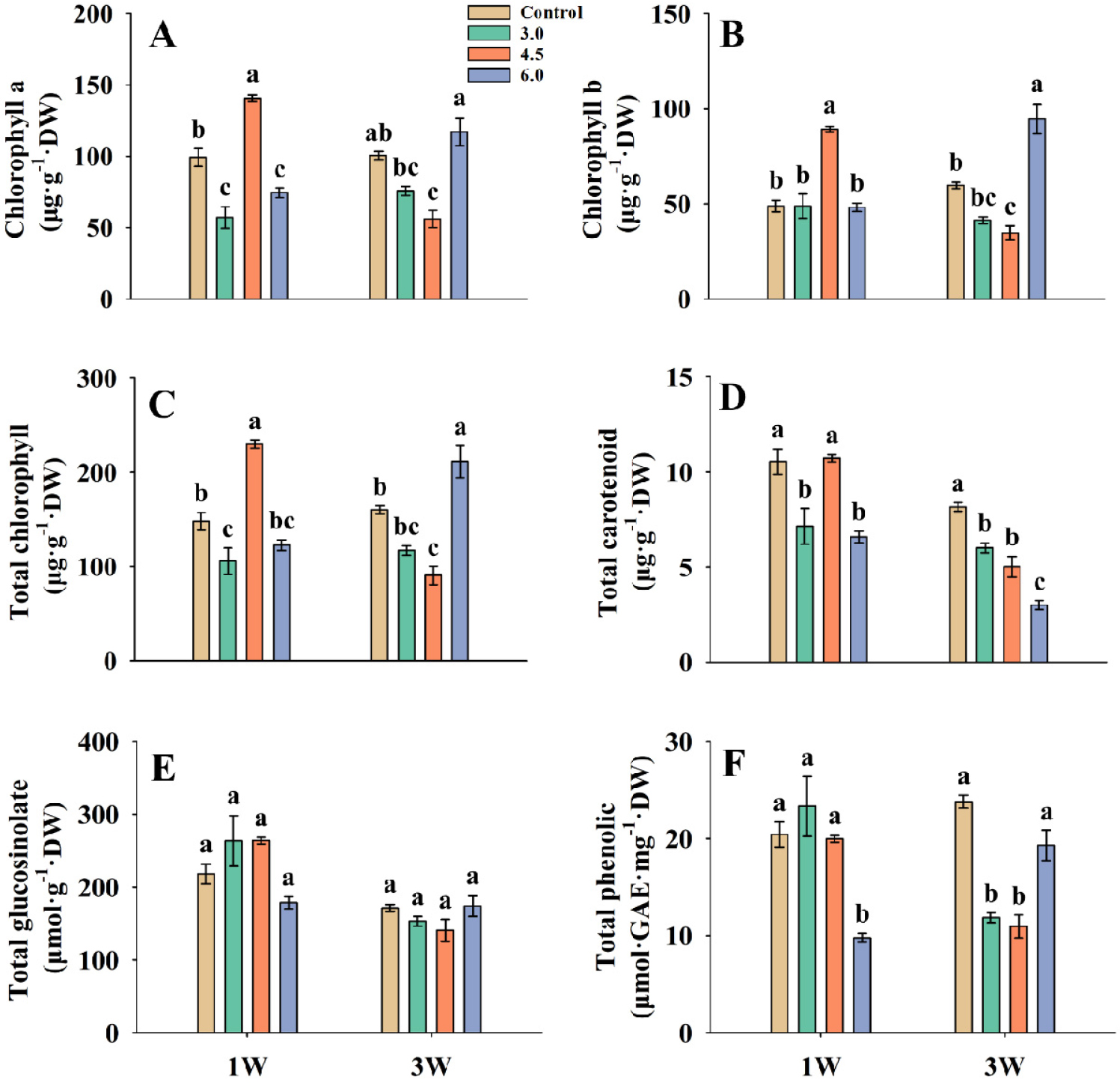
Fig. 3
Chlorophyll a (A), chlorophyll b (B), total chlorophyll (C), total carotenoid (D), total glucosinolate (E), and total phenolic (F) of red mustard in different EC under the 1W and 3W treatments before harvest. The bars represent the means and the error bars indicate standard error (n = 3). Different letters at the top of bars indicate significant difference (p < 0.05) by Tukey’s multiple range test.
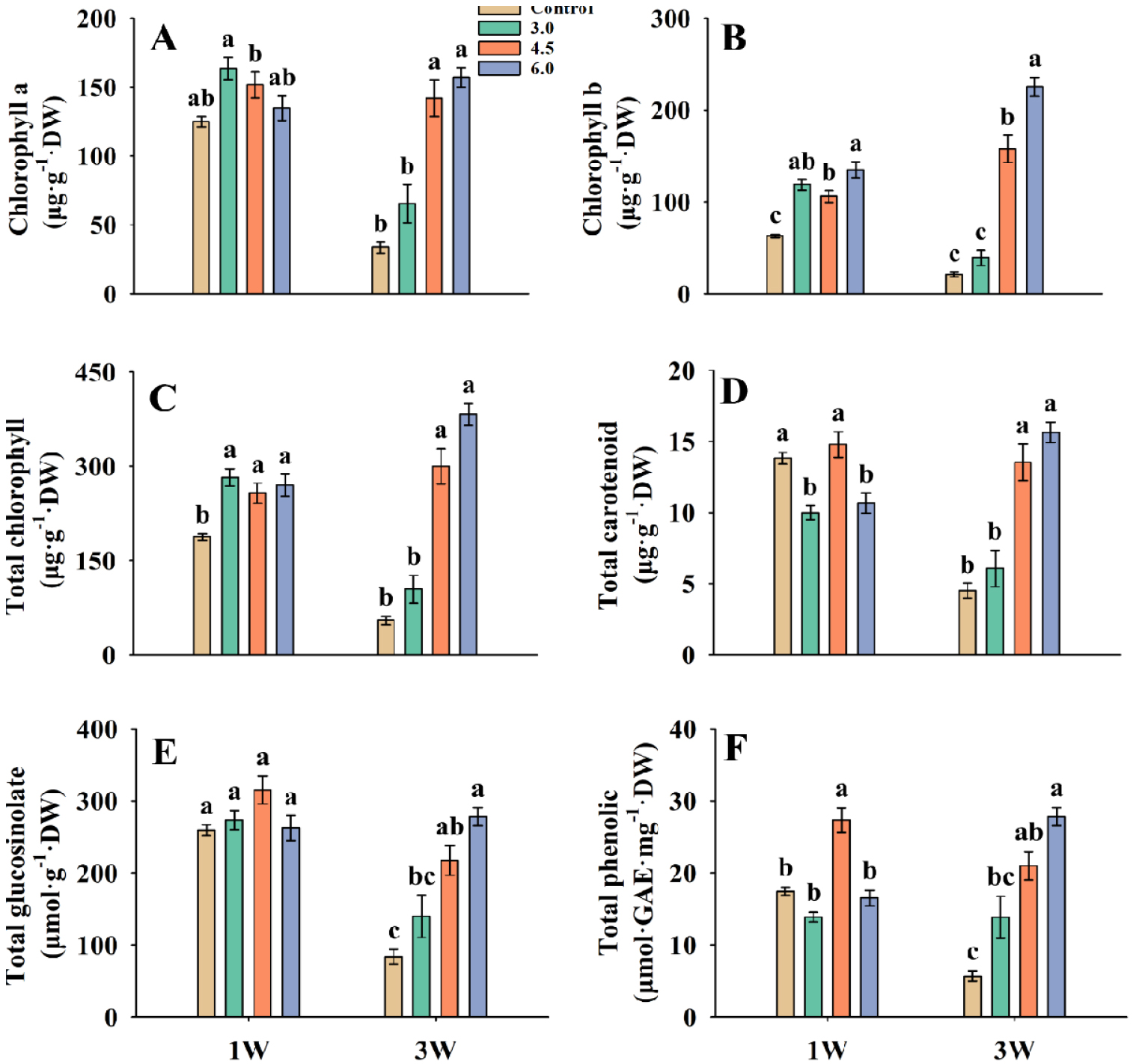
Fig. 4
Chlorophyll a (A), chlorophyll b (B), total chlorophyll (C), total carotenoid (D), total glucosinolate (E), and total phenolic (F) of kale in different EC under the 1W and 3W treatments before harvest. The bars represent the means and the error bars indicate standard error (n = 3). Different letters at the top of bars indicate significant difference (p < 0.05) by Tukey’s multiple range test.
López-Berenguer 등(2008)의 연구에 따르면, 브로콜리에 40, 80mM NaCl 처리를 했을 때, 80mM NaCl에서 glucosinolate 함량이 가장 높았으며, 염분 스트레스가 glucosinolate 및 phenolic 화합물 축적을 통해 식물의 방어 메커니즘으로 작용할 수 있음 제시했다. 본 연구에서도 적갓, 적겨자, 케일에서 염분 스트레스(EC 처리)가 glucosinolate 및 phenolic 화합물 함량을 증가시켰으며, 특히 장기 염분 노출(3W)에서 기능성 물질 축적을 촉진한 것을 알 수 있다. 식물은 염분 스트레스를 받으면 활성산소종(ROS, Reactive Oxygen Species)이 과도하게 생성되어 세포 손상과 대사가 방해된다(Fu와 Yang, 2023; Kesawat 등, 2023). 이를 방어하기 위해 식물은 항산화 효소의 생산을 증가하게 되며, 이 과정에서 기능성 물질이 축적되고(Kaur 등, 2019; Raja 등, 2017), 염분 내성이 강화된다(Saberi Riseh 등, 2021). 그러나 과도한 염분은 식물 세포의 이온 및 영양소 균형을 방해하여 생리적 및 대사적 기능을 저하시켜 방어 메커니즘이 제대로 작동하지 않을 수 있다(Misra 등, 2021). 추가로 종마다 염분 내성이 상이하게 나타나기 때문에(Flowers, 2004), 각 작물에 최적의 EC 농도를 규명하기 위해 양분 흡수량과 관련된 연구가 필요할 것으로 생각된다. 또한, 다양한 환경조건 뿐만 아니라 작물 품질에 영향을 미치는 요인들을 고려하여 여러 요인에 대한 복합적인 추가 연구도 필요하다고 사료된다.