서 론
재료 및 방법
1. 식물 재료 및 재배 환경
2. UV-A 조사처리
3. 생육 특성
4. 광합성 파라미터
5. 광계Ⅱ 최대양자수율
6. 생리활성 화합물
7. 통계처리
결과 및 고찰
1. 생육 특성과 광합성 파라미터
2. 광계Ⅱ 최대양자수율
3. 총 페놀함량, 항산화도 및 총 플라보노이드 함량
결 론
서 론
태양 복사(280-1100nm)는 자외선, 가시광선(광합성 활성 복사, PAR) 및 적외선 파장의 스펙트럼으로 구성 되어있다(Grant, 1997). 이 중, 자외선(UV) 복사는 형태학적 변화, 광합성, 스트레스 내성, 2차 대사산물 생합성 등과 같은 식물의 다양한 생리적 과정에 영향을 미칠 수 있다(Hollósy, 2002). 이런 반응은 UV 복사의 에너지 강도, 노출 기간 및 스펙트럼 범위에 따라서 그 정도가 다양하게 나타난다. UV는 복사 수준에 따라, 부정적인(distress) 혹은 긍정적인(eustress) 스트레스로 식물에게 작용될 수 있다(Hideg 등, 2013). “Distress”의 경우, 강한 UV 복사 노출에 의해 증가된 활성산소종(ROS)으로 인한 산화 스트레스 유발로 식물의 생장이 제한되거나 심할 경우 고사할 수 있는 수준의 자극을 말한다(Park 등, 2020; Fitzner 등, 2023). 반면, “eustress”는 적절한 혹은 식물이 견딜 수 있는 수준의 UV 복사로서, 식물의 생장이 제한되지 않고 내부 방어 기제가 활성화되는 것을 말한다(Neugart와 Schreiner, 2018; Fitzner 등, 2023). 내부 방어 기제의 일환으로 식물은 스트레스에 대응하기 위한 다양한 생리활성물질(폴리페놀, 안토시아닌 등)을 생산하고 축적한다(Lee 등, 2019a; Mao 등, 2021; Lee 등, 2022).
UV 복사는 총 태양 복사의 약 8-9%를 차지하며, 세 가지 유형으로 구별된다(Coohill, 1989); UV-C(200-280nm), UV-B(280-315nm), UV-A(315-400nm). 이 중 UV-C와 UV-B는 오존층에 의해 완전히 또는 대부분 흡수되기 때문에 지구 표면에 도달하는 대부분의 UV는 UV-A 복사이며(대략 95%), 생태계에 직∙간접적으로 영향을 미친다(Brazaitytė 등, 2015; Verdaguer 등, 2017). 상대적으로 높은 에너지를 갖는 UV-C와 UV-B는 적은 용량(dose)으로도 식물의 항산화능력을 초과하는 ROS를 단기간 내 쉽게 생성하여 DNA, RNA, 단백질, 엽록체 그리고 광합성 색소에 심각한 손상을 유도하기 때문에 “distress”로 쉽게 작용될 수 있지만(Qin 등, 2023), UV-A 복사는 식물에게 큰 손상을 주지 않으면서, 식물의 생장을 촉진하는 동시에 항산화 효과를 갖는 2차 대사산물 생합성을 촉진시킬 수 있어 “eustress”로 작용될 가능성이 높다(Brazaitytė 등, 2015; Lee 등, 2019b; Choi 등, 2022). 또한, UV-C와 UV-B는 인간의 피부, 눈, 면역체계를 손상시키기 쉽기 때문에, 식물재배 중 UV 보광은 재배자의 안전적 측면에서도 UV-A 광의 이용이 보다 적합할 수 있다(Lucas 등, 2015).
최근 LED를 포함한 인공 광원 기술의 발전으로, 수직농장 내에서 다양한 종류의 UV LED의 세기와 조사 시간을 조절하여 원예 작물의 형태적 및 생리적 반응을 조사하는 연구들이 진행되고 있다(Artés-Hernández 등, 2022). UV-A LED와 관련된 대부분의 연구는 10-30W·m-2 수준의 UV-A LED을 다양한 원예 작물에 조사하였을 때 긍정적인 효과를 나타내고 있다(Lee 등, 2019b; Choi 등, 2022; Jang 등, 2022). 따라서, UV-A 보광은 작물의 생장 및 품질을 향상시키기 위한 하나의 기술로 기대되고 있지만 작물에 따라 그 적정 조사 조건은 다를 수 있다.
시금치(Spinacia oleracea L.)는 식이섬유, 칼륨, 비타민A, 비타민C, 카로틴 등의 영양분이 풍부하여 수퍼푸드(super food)로 분류된다(Proestos, 2018). 시금치는 고온기에 취약한 호냉성 및 장일성 작물이며, 노지 재배의 경우 주로 고랭지에서 재배되지만 기후 변동으로 인해 시장에서 가격 변동이 심하다. 따라서 시금치의 생산은 외부 환경에 영향을 받지 않는 밀폐형 식물 생산 시스템인 수직농장에서 시도되고 있으며, 시금치는 낮은 식물 높이, 높은 재식 밀도 및 짧은 생장주기(1년생)로 인해 수직농장에서 적합한 작물이다(Gao 등, 2020). 최근 수직농장에서 시금치의 생산성 및 품질을 향상시키기 위해 환경 조절(광질, 광도, 양액) 및 스트레스 처리(UV 조사, NaCl 처리)와 같은 다양한 연구들이 시도되고 있다(Park 등, 2019; Bantis 등, 2020; Vaštakaitė-Kairienė 등, 2022; Miao 등, 2023; Semenova 등, 2023). 하지만 UV 조사에 따른 시금치의 생산성 및 품질과 관련된 연구는 주로 UV-B와 UV-C에 국한되어 있으며, 이 또한 주로 수확 후 품질 향상과 관련하여 살균 메커니즘(항균 효과 등)을 확인하기 위해 수행되고 있다(Artés‐Hernández 등, 2009; Escalona 등, 2010; Kasım와 Kasim, 2017; Martínez-Sánchez 등, 2019). 따라서, 수직농장에서 고품질 시금치 생산을 위한 최적의 UV-A LED 보광 조건을 확인해 볼 필요가 있다.
본 연구에서는 UV-A 광 조사가 시금치의 생장 및 생리활성물질 생합성에 어떠한 영향을 미치는지 확인하여 UV-A LED 보광 처리가 시금치의 생산성 및 품질 향상을 위한 기술로서 적용 가능한지를 확인하였다.
재료 및 방법
1. 식물 재료 및 재배 환경
시금치(Spinacia oleracea L. ‘Frontier’) 종자를 종자 성장팩(Seed germination pouch, CYGTM, USA)에 파종 후 2주간 육묘하였다. 2주된 시금치 묘는 폴리우레탄 스펀지[25 × 25 × 30mm(L × W × H)]를 사용하여 DFT 시스템용 수직농장 모듈[850 × 900 × 100mm(L × W × H)]에 정식 후 4주간 재배되었다. 재배 환경은 다음과 같다: 온도 20°C, 상대습도 70%, 이산화탄소 500µmol·mol-1, 광주기 12시간, 광원 백색 LED(D&W Special Light, Gwangmyeong, Korea), 광합성 유효 광양자속 밀도(PPFD) 200µmol·m-2·s-1, 호글랜드 양액(Hoagland와 Arnon, 1950) EC 1.2dS·m-1, pH 5.8. 배양액은 2주에 한 번 새 것으로 교체하였으며 pH & EC 미터기(Multi 3630 IDS; WTW, Weilheim, Germany)를 이용하여 3일에 한 번씩 pH를 보정하였다.
2. UV-A 조사처리
정식 후 3주차에 385nm의 피크 파장을 가지는 UV-A LED(Bissol LED, Seoul, Korea)를 기존 백색 LED 광원에 추가적으로 7일간 연속 조사하였다. 대조구는 UV-A LED가 보광 처리되지 않은 기존 광원에서 재배되었다. UV-A LED의 두 가지 조사 에너지는 20 및 40W·m-2였으며, Spectroradiometer(JAZ-EL 200, Ocean Optics, Dunedin, FL, USA)를 이용하여 작물의 정단부 높이를 기준으로 12개 구역을 측정하였다. 조사 광원과 에너지의 불균일한 분포에 의한 오차를 최소화하기 위해 작물의 위치를 매일 변경하였다.
3. 생육 특성
UV-A 처리 7일 동안 이틀에 한 번씩 샘플링하여 지상부 생체중을 전자저울로 측정하였다(SI-234; Denver Instruments, Denver, CO, USA). 측정 후 바로 지상부를 액체질소에 넣은 다음 ‒70°C 동결 건조기(Alpha 2-4 LSC plus, CHRIST, Osterode am Harz, Germany)에 72시간 이상 건조시킨 후 지상부 건물중을 전자저울로 측정하였다.
4. 광합성 파라미터
광합성 특성은 UV-A 처리 3일차에 완전히 확장된 잎에서 휴대용 광합성측정기(LI-6800; LI-COR, Lincoln, NE, USA)를 이용하여 측정되었다. 측정은 각 광원 아래의 빛이 투과되는 투명 챔버(6800-12A; LI-COR, Lincoln, NE, USA)를 이용하여 PPFD가 200µmol·m-2·s-1이 되는 지점에서 수행되었다. 챔버 내 온도는 20°C, reference CO2 농도는 500μmol· mol-1, 상대습도는 60±5%, 공기 유속은 700μmol·s-1로 유지되었다.
5. 광계Ⅱ 최대양자수율
UV-A 광조사에 의한 시금치의 스트레스 수준을 확인하기 위해 Closed Image Chlorophyll Fluorescence(FC800-C, PSI, Brno, Czech Republic)을 이용하여 광계Ⅱ 최대양자수율(Fv/Fm)을 측정하였다. 측정 전 각 처리구의 시금치를 암막 박스에 넣어 30분 간 암적응해 주었다. 시스템의 측정 조건은 actinic illumination, 20%; sensitivity, 18%; shutter, 20µs; super pulse illumination, 18%로 설정되었고, 최대 형광값(Fm) 및 최소 형광값(Fo)을 구한 후 Fv/Fm을 (Fm-Fo)/Fm으로 계산하였다. 그 후에는 FLUORCAM 7 software를 이용해 획득된 영상 이미지 중, 식물 개체당 완전히 펴진 잎의 3구역을 임의로 선택해 얻은 parameters의 평균값을 이용하였다.
6. 생리활성 화합물
6.1 총 페놀 함량과 항산화도
분석을 위해 각 처리구의 파우더 샘플 40mg씩 취하여 4mL의 80% 아세톤과 함께 5mL microtube에 혼합한 후, 초음파 기계(SK5210HP, Youngin Co., Gunpo, Korea)를 이용하여 15분간 추출하였다. 추출된 시료 용액 1.5mL을 2mL microtube에 옮겨 총 페놀 함량과 항산화도 분석을 위해 12시간 이상 각 4°C 및 ‒20°C 챔버에 보관하였다. 총 페놀 함량과 항산화도는 각각 Folin-Ciocalteau(Sigma-Aldrich Co., LLC, St. Louis, MO, USA)(Ainsworth와 Gillespie, 2007) 및 ABTS 방법(Miller와 Rice-Evans, 1996)으로 측정되었다. 이때, 최종 반응물의 흡광도는 각각 765와 730nm에서 분광광도계를 통해 측정되었다(Choi 등, 2022). 총 페놀 함량은 단위 건물중당 gallic acid(Acros Organics, Geel, Belgium)의 양(mg)으로, 항산화도는 단위 건물중당 trolox(6-Hydroxy-2,5,7,8,-tetramethylchromane-2-carboxyl acid)(Sigma-Aldrich Co., LLC, St. Louis, MO, USA)로 표기되었다.
6.2 총 플라보노이드 함량
각 처리구의 파우더 샘플을 40mg씩 취하여 4mL의 70% 에탄올(pH 3.2, formic acid)과 함께 5mL microtube에 혼합한 후, 15분간 초음파 추출하였다. 추출된 시료 용액 중 1mL을 2mL microtube에 넣어 ‒20°C 챔버에서 12시간 이상 반응시켰다. 샘플을 905 × g로 2분 동안 원심분리한 후, 5mL microtube에 250μL의 추출액과 1.25mL 증류수를 넣었으며 blank로는 추출액 대신 70% ethanol을 사용했다. 그 후, 5% NaNO2를 75μL 넣고 5분 대기한 뒤 10% AlCl3을 150μL 넣고 6분 동안 incubation 했다. 마지막으로, 1M NaOH 500μL을 넣은 다음 275μL 증류수를 추가하였다. 5분 후, 분광광도계를 이용하여 최종 반응물의 흡광도를 510nm에서 측정하였다. 총 플라보노이드의 표준곡선은 (+)-catechin(Sigma-Aldrich, St. Louis, MO, USA)를 이용하여 작성되었고, 단위 건물중당 catechin 양(mg)으로 기록했다.
7. 통계처리
실험은 완전임의배치법으로 디자인되었으며, 모든 결과(생육 특성, 광합성 파라미터, 광계Ⅱ 최대양자수율, 생리활성물질)들은 각 처리구별 4반복으로 측정되었다. 측정된 값들은 SAS software(Statistical Analysis System, 9.2 Version, SAS Institute, Cary, NC, USA)을 이용하여 분산분석(analysis of variance, ANOVA)을 진행하였으며, Tukey’s HSD test로 평균값을 비교하였다.
결과 및 고찰
1. 생육 특성과 광합성 파라미터
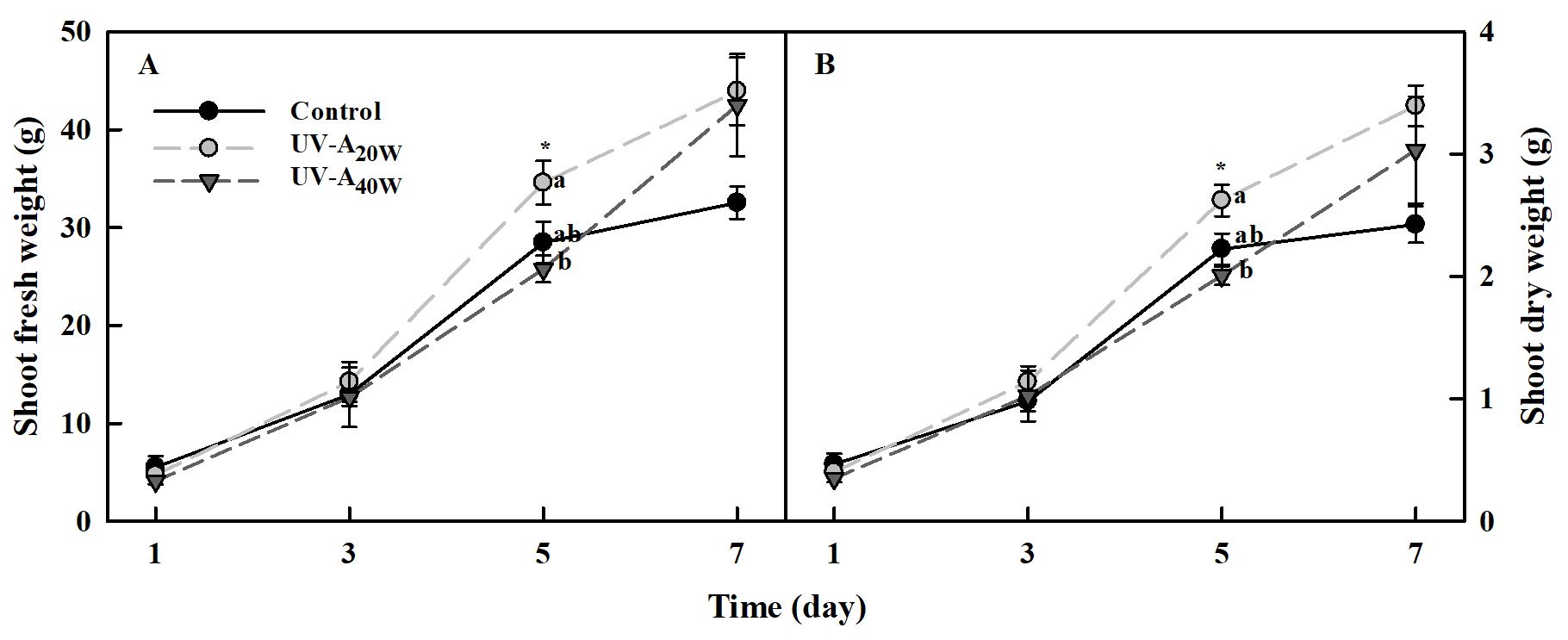
UV-A LED처리 1일에서 3일차까지의 지상부 생체중은 대조구 대비 유의적 차이가 나타나지 않았다(Fig. 1A). 처리 5일차에는 대조구 대비 UV-A20W 처리구가 약 1.3배 이상 유의적으로 증가하였다. 처리 7일차에는 UV-A40W에서도 증가하는 경향을 보였지만 유의적 차이는 나타나지 않았다. 지상부 건물중은 지상부 생체중과 동일한 경향을 나타냈으며, 처리 5일차에 UV-A20W 처리구만이 대조구 대비 약 1.4배 이상 유의적으로 증가하였다(Fig. 1B).
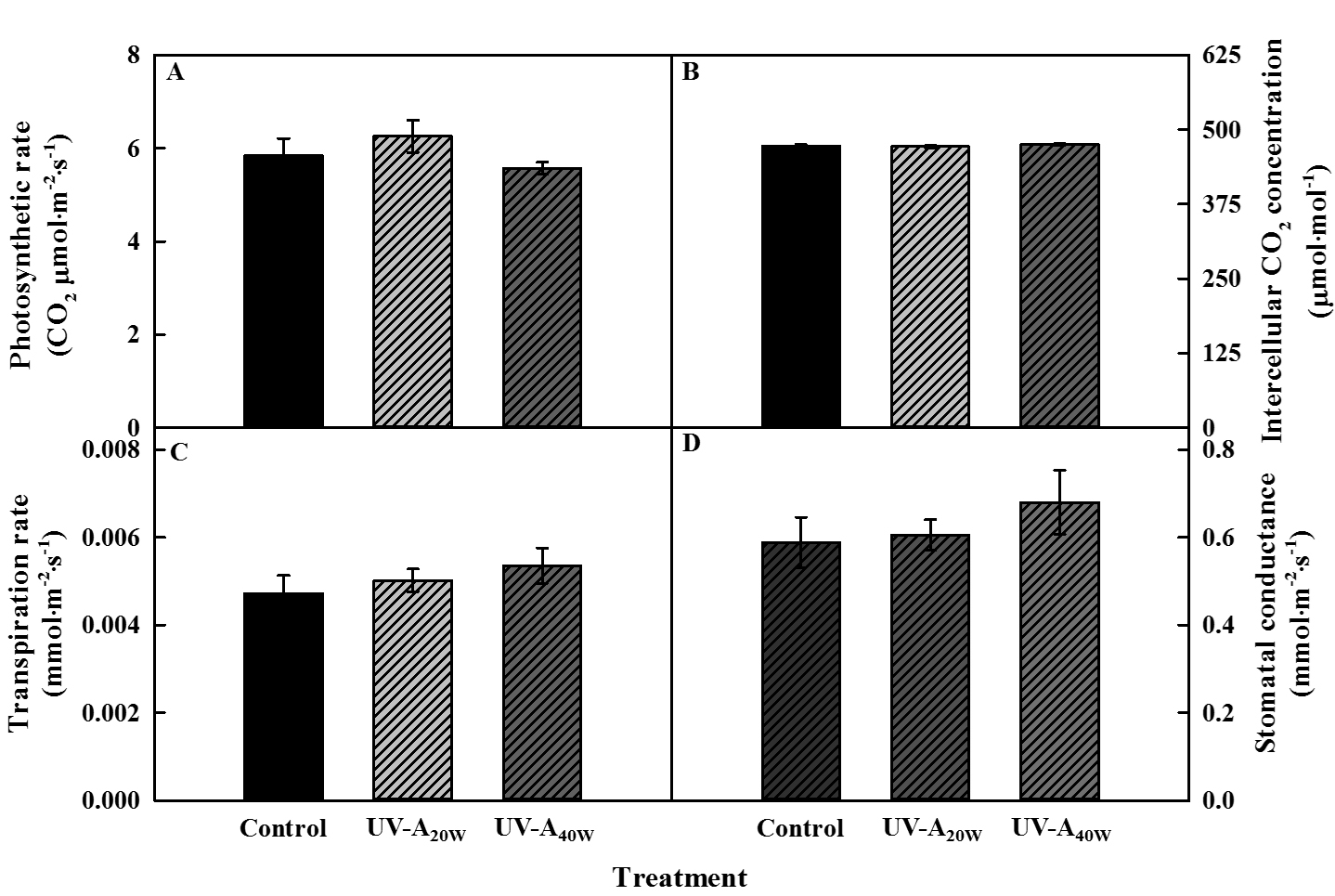
UV-A 처리 3일차에 광주기 동안의 광합성률은 UV-A A20W 처리구에서 대조구 대비 수치적으로 증가하였으나 유의적 차이는 나타나지 않았다(Fig. 2A). 그 외 세포 내 이산화탄소 농도, 증산율, 기공전도도 또한 대조구와 처리구 간에 유의적인 차이는 없었다(Fig. 2B-D).
두 가지 수준 UV-A LED(20 및 40W·m-2)의 7일간 연속 보광 조사는 시금치의 생장을 증대시킬 수 있음을 확인하였다. 최근 연구에 따르면, PAR 아래의 UV-A 보광 조사는 적상추, 아이스플랜트, 케일, 바질 등 다양한 작물의 생장 혹은 광합성률을 증가시킨다고 보고되었다(Samuoliene 등, 2020; Lee 등, 2021; Choi 등, 2022; Viršilė 등, 2023). Verdaguer 등(2017)은 주변 광도의 수준이 낮을 경우, UV-A 광이 광합성을 위한 대체 에너지원으로 이용될 수 있다고 제안한 바 있다. 또한 McCree(1971, 1972) 곡선을 살펴보면, 상대적으로 긴 UV-A 광 파장은 광합성에 이용될 수 있으며, 이 파장의 범위는 청색광과 중첩되는 400nm 부근에 밀접하게 위치한다. 즉, 상대적으로 장파장의 UV-A 조사는 다양한 작물의 생장을 증진시킬 가능성이 존재한다.
최근, 케일, 아이스플랜트, 상추를 사용한 연구에서 400nm 부근의 UV-A LED를 보광 처리하였을 때 유의적으로 광합성이 증대됨이 보고되었다(Samuoliene 등, 2020; Lee 등, 2021; Choi 등, 2022). 또한, 우리의 연구에서도 광포화점 이하의 광도 아래에서 400nm 파장에 가까운 385nm 파장의 UV-A 보광이 시금치의 바이오매스 축적에 기여하였기 때문에 선행 연구의 결과를 뒷받침한다. 하지만, 광합성 파라미터(광합성률, 세포 내 CO2 농도, 증산율, 기공 전도도)는 대조구와 비교하여 유의적인 차이를 나타내지 않았다(Fig. 2). 이러한 결과는 생장이 유의적으로 증대되었던 UV처리 5일째에 광합성을 측정했다면 UV-A LED 보광 처리구에서 유의적인 증대가 관찰되었을 가능성이 존재한다. 따라서, 이와 관련하여 광합성 효율을 고려한 추가적인 실험이 필요할 것으로 판단된다.
2. 광계Ⅱ 최대양자수율
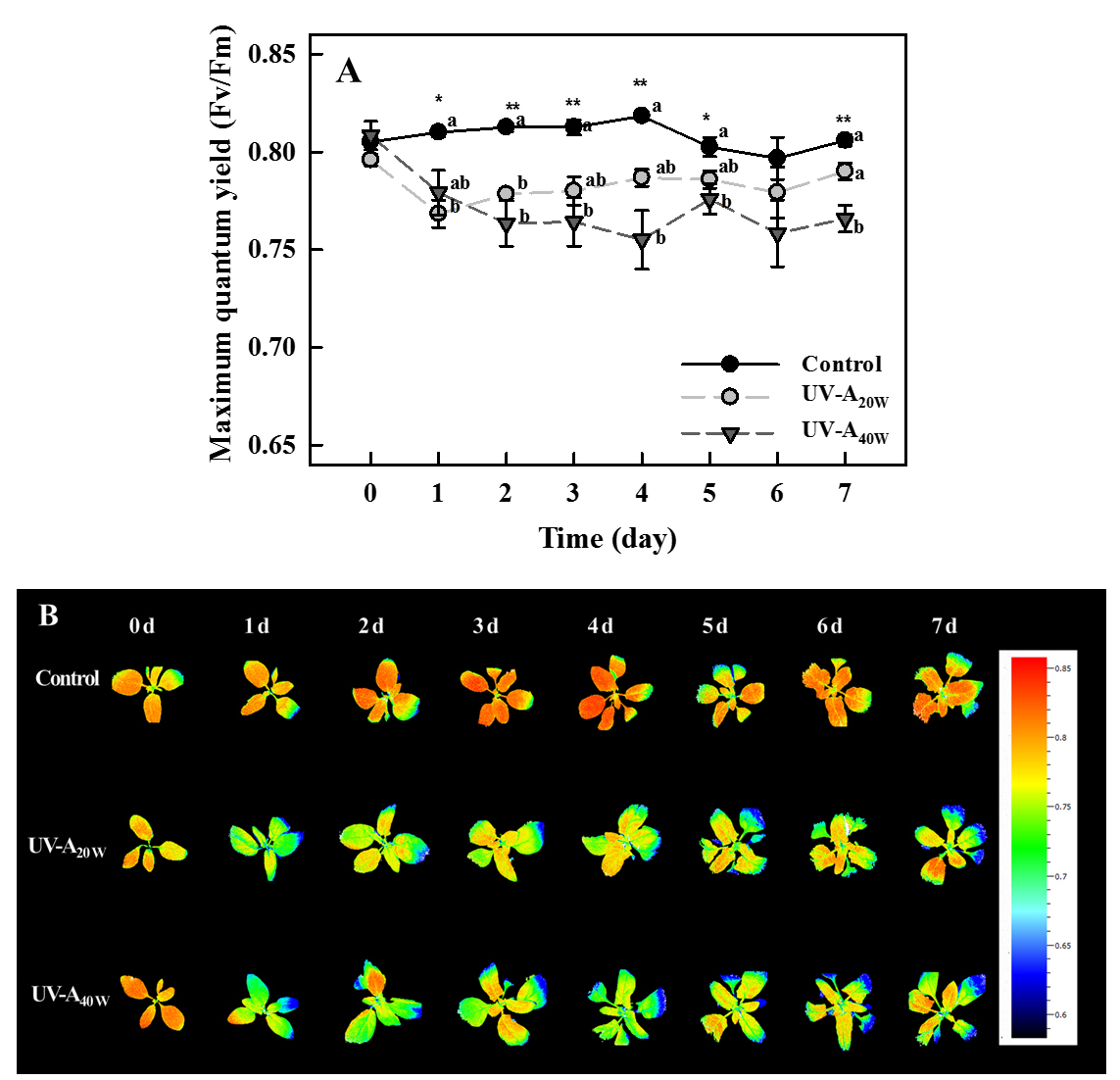
UV-A 처리 7일동안 PSII 최대양자수율(Fv/Fm)은 대조구 대비 모든 UV-A 처리구에서 유의적으로 감소하였다(Fig. 3A). UV-A 처리구들은 0.75에서 0.79 사이의 값을 가졌으며, UV-A40W 처리구가 UV-A20W 처리구보다 더 낮은 경향을 나타내었다. 대조구의 경우, 대부분 약 0.8 이상의 값을 유지하였다. 이런 패턴은 형광 데이터를 이미지로 시각화한 결과에서 명확하게 나타났다(Fig. 3B).
PSII 최대양자수율(Fv/Fm)은 PSII의 광 수확 안테나(light-harvesting antenna)에 의해 흡수된 광이 화학에너지로 변환되는 최대 효율을 의미한다(Baker와 Rosenqvist, 2004). 이 값은 전자의 이동에 따라 전자전달 과정에서 발생하는 불필요한 에너지를 방출할 때 결정되며, 스트레스 발생 시 전자 수송 과정 중 전자 전달 속도가 떨어지면서 값이 감소하게 된다(Baker와 Rosenqvist, 2004). Fv/Fm 값은 비파괴적으로 다양한 비생물학적 스트레스에 대한 광합성 기구의 변화 및 스트레스 수준을 측정하는데 이용되며, 스트레스 수준이 클수록 더 낮은 값을 나타낸다(Murchie와 Lawson, 2013; Lee 등, 2019a; Park 등, 2020). 정상적인 상태의 식물에서는 0.8에서 0.84 사이의 값을 나타내며, PSII가 불활성화된 경우 0.8 미만의 값을 가지면서 식물이 스트레스를 받았다고 간주된다(Murchie와 Lawson, 2013). 이전 연구에 따르면, UV-A 광 조사는 Fv/Fm값을 0.8 미만으로 감소시키는 경향을 보였으며, 특히 상대적으로 파장이 짧거나 더 높은 에너지를 가진 경우 더욱 급격하게 감소하는 경향을 나타내었다(Lee 등, 2019b; Samuoliene 등, 2020; Lee 등, 2021; Kang 등, 2022). 우리의 연구에서도 UV-A20W 처리보다 UV-A40W 처리에서 Fv/Fm 값이 더 크게 감소하였으며, 이는 이전 연구의 결과를 뒷받침한다. 그러나, UV-A 조사로 인한 시금치의 형태학적 손상 또는 생장 억제가 발견되지 않았으므로, 20W 및 40W·m-2의 조사 수준은 식물에게 강한 스트레스를 유발시키지 않았다고 판단할 수 있다.
3. 총 페놀함량, 항산화도 및 총 플라보노이드 함량
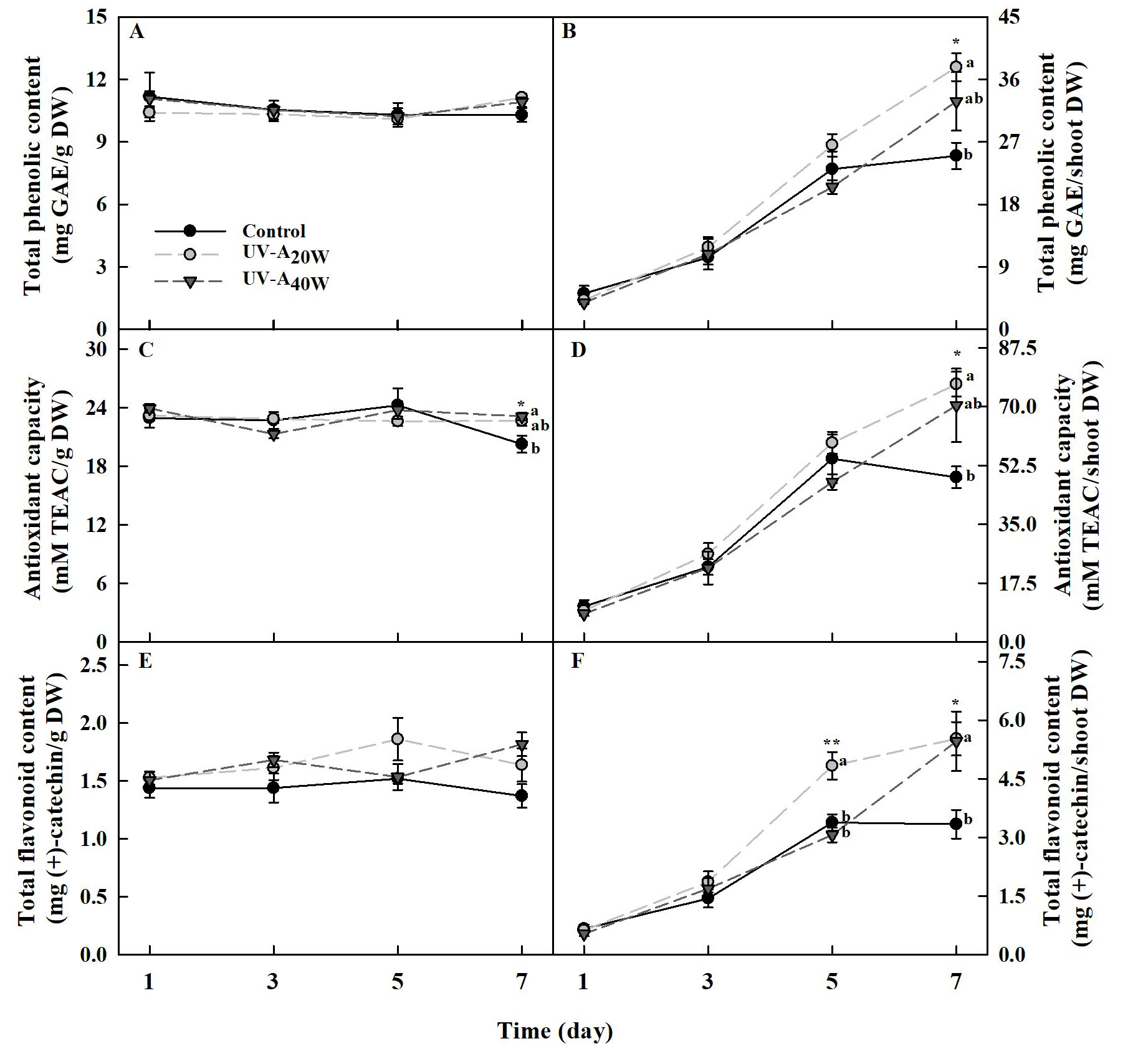
UV-A 처리는 건물중당 총 페놀 함량을 증가시키지 않았다. 건물중당 항산화도의 경우, UV-A 처리 7일차에 대조구 대비 UV-A40W 처리구에서 1.14배 유의적으로 증가하였다. 건물중당 총 플라보노이드 함량은 UV-A 처리구들에서 높은 경향을 나타냈지만 유의적인 차이는 나타나지 않았다. 하지만, 식물체당 총 페놀 함량, 항산화도는 UV-A 처리 7일차에 대조구 대비 UV-A20W 처리구에서 약 1.5배 유의적으로 증가하였다. 식물체당 총 플라보노이드 함량은 UV-A 5일차 및 7일차에 UV-A20W 처리구가 대조구 대비 각각 약 1.4배 및 1.6배 유의적으로 증가하였다.
대기 수준보다 높은 UV복사는 식물에게 스트레스를 유발하며 페놀, 플라보노이드, 알칼로이드, 그리고 테르페노이드와 같은 다양한 2차 대사산물의 생합성 및 축적을 유도한다(Jordan, 2002). 특히, 페놀과 플라보노이드계 화합물들은 UV를 강하게 흡수하고 높은 항산화 활성을 가지기 때문에 식물의 UV 내성에 매우 중요한 역할을 한다(Jenkins, 2008). 이전 연구에 따르면, 토마토 묘목에 UV-A 광이 보광되었을 때 총 플라보노이드와 UV-흡수 화합물이 유의적으로 증대되었으며(Zhang 등, 2020), 적상추에서도 비타민C, 플라보노이드, 폴리페놀, 그리고 안토시아닌 함량이 유의적으로 증대되었다(He 등, 2021a). 더하여, 케일(Chinese kale, Kale)과 브로콜리 새싹(microgreens)에서도 총 페놀 함량과 총 플라보노이드 함량이 유의적으로 증대되었다(Lee 등, 2019a, 2019b; He 등, 2021b; Gao 등, 2021). 우리의 결과에서도, 두 가지 수준(20, 40W·m-2)의 UV-A LED를 7일간 처리하였을 때 시금치의 식물체당 총 페놀 함량, 항산화도, 그리고 총 플라보노이드 함량이 유의적으로 증대되어 이전 연구 결과들과 동일한 경향을 나타내었다(Fig. 4).
한편, 플라보노이드와 하이드록시시남산(hydroxycinnamic acids)은 UV 복사로부터 식물을 보호해주는 두 가지 주요 페놀성 그룹이며, 이 화합물은 각각 240-545nm와 227-332nm 범위의 흡수대를 가지고 있다(Cerovic 등, 2002). 두 페놀성 그룹은 표피세포에 존재하여 해로운 자외선이 잎의 내부 세포로 침투되는 것을 보호하는 차단제 역할을 하며, 동시에 PAR를 엽육세포에 전달한다(Jordan, 2002). 우리의 연구에서도 플라보노이드 뿐만 아니라 하이드록시시남산 화합물이 시금치의 표피세포에 축적되었을 가능성이 존재한다. 더하여, UV-A 광은 페놀성 화합물에 의해 흡수되었다가 blue-green 형광으로 여기되어 재방사 되는데 이로 인해 들뜬 전자가 간접적인 광합성 에너지원으로 이용되어 시금치의 지상부 생체중 및 건물중을 증진시켰을 가능성도 존재한다(Mantha 등, 2001)(Fig. 1).
UV 복사에 대한 식물의 반응은 에너지의 양(dose-response)과 UV 스펙트럼 구성에 따라 달라질 수 있다(Ibdah 등, 2002). Lee등(2019)는 케일에서 5일간 UV-A LED를 처리하였을 때 370nm 보다 385nm의 피크파장을 가진 LED 처리구에서 항산화적 페놀릭 화합물이 유의적으로 증대되었다. Li 등(2020)의 연구에서는 케일(Chinese kale)과 청경채 식물에서 380nm보다도 400nm의 피크파장을 가진 UV-A LED 처리구에서 kaempferol과 glucosinolate 함량(aliphatic flucosinolates, indolic glucosinolates, total glucosinolates, gluconapin)이 유의적으로 증대되었다. 즉, UV-A 파장 내에서도 사용한 LED의 피크파장에 따라 식물의 형태학적 그리고 생리 화학적인 변화가 유도될 수 있다. 더하여, 같은 피크파장을 갖는 LED를 처리하더라도 식물이 받은 총 복사량에 따라 식물체의 반응이 달라질 수 있다(Chen 등, 2019; Kang 등, 2022). 이전 연구에 따르면, Chen 등(2019)은 상추 식물에 UV-A 광 처리(피크 파장 365nm, 10, 20, 그리고 30μmol·m-2·s-1)를 했을 때, UV-A의 세기가 높아질수록 바이오매스뿐만 아니라 안토시아닌과 아스코르브산 함량이 더 크게 증대된다고 보고하였다. Kang 등(2022)의 연구에서도 바질 식물에서 동일한 피크 파장의 UV-A LED를 3가지 세기(10, 20, 30W·m-2)로 처리했을 때 유사한 결과를 나타내었다. 본 연구 결과, 시금치 단위 건물중당 총 페놀 함량에서는 대조구와 비교하여 7일 동안 두 가지 UV-A LED 처리구와 큰 차이가 관찰되지 않았다(Fig. 4A). 하지만 항산화도는 비교적 높은 에너지 수준(40W·m-2)에서 7일째에 유의적인 증대가 관찰되었고, 총 플라보노이드 함량은 유의적인 차이는 관찰되지 않았으나 처리 5, 7일째에 수치적인 증대가 관찰되었다(Fig. 4C, E). 반면, 시금치 지상부 건물중당 총 페놀 함량, 항산화도, 그리고 총 플라보노이드 함량은 UV 처리 기간이 길어질수록 점차 증대되는 경향을 보였는데(Fig. 4B, D, F), 이는 UV-A LED 처리에 의해 증대된 생육에 기인한 결과로 보인다(Fig. 1). 우리의 결과와 동일하게, Choi 등(2022)의 연구에서도 7일간 케일 식물에 UV-A LED를 조사하였을 때, UV 처리 기간이 증가할수록 지상부 건물중과 함께 총 페놀 함량, 항산화도, 총 플라보노이드 함량이 증대되는 결과를 나타내었다.
식물에서 2차 대사산물의 축적은 유전적 요인과 환경 조건의 복합적인 효과에 의해 영향을 받는다. 실제로 2차 대사산물의 함량과 구성은 주로 유전적으로 조절되지만, 생산은 광(가시광선, UV, 광도, 광주기 등), 수분, 온도, 영양분 등을 포함한 환경 요인에 따라 달라질 수 있다(Bian 등, 2015; Beiranvandi 등, 2022). 따라서, 수직농장에서 생산되는 시금치의 고품질화 및 품질 표준화를 위해서는 수직농장 내에서 조절되는 다양한 환경 요인들과 UV-A 보광의 상호작용에 대한 추가적인 연구가 필요하다.
결 론
본 실험을 통해 385nm 피크파장을 가진 UV-A 단기적 보광 조사에 의한 시금치의 생리학적 반응을 평가하였다. UV-A LED 광 조사는 시금치의 생장 및 광합성률을 억제하지 않았으며 바이오매스 축적에 기여할 수 있음을 확인하였다. UV-A 광 조사는 시금치의 Fv/Fm 수준을 감소시켰지만, 생장 및 광합성의 억제가 발생하지 않았음을 기반으로 과도한 스트레스가 아니었음을 알 수 있었다. 또한 UV-A 에너지 수준에 상관없이 처리 7일째에 총 페놀 함량, 항산화도, 그리고 총 플라보노이드 함량이 증대되었다. 이를 통해, 인공광 이용형 수직농장에서 수확 전 UV-A LED 보광 처리는 시금치의 생장 및 품질을 향상시킬 수 있는 하나의 기술로써 활용이 가능할 것으로 판단되었다. 하지만, 작물의 생장 및 품질(2차 대사산물)과 관련하여 UV-A LED 광 조사는 UV-A의 조사 형태(피크파장, 기간, 에너지 등)뿐만 아니라 재배 환경에 따라서도 그 효과가 달라질 수 있으며, UV-A LED 역시 추가적인 에너지를 필요로 하기 때문에, 추후 에너지 효율까지 고려한 심층적인 연구가 필요할 것으로 판단된다.