서 론
재료 및 방법
1. 식물재료 및 정식
2. 플라즈마 발생 장치 및 플라즈마수 분석
3. 생육조사 및 성분 분석
4. 통계 분석
결과 및 고찰
1. 생육분석
2. 기능성 물질 분석
서 론
플라즈마는 전자, 이온과 중성입자 등이 동시에 존재하는 반응성이 매우 높은 기체 상태를 뜻한다(Song, 2016). 전기에너지를 통해 생성되는 플라즈마는 핵융합 발전, 초고온 열원 등에서 100℃ 이하의 낮은 온도에서 발생하는 저온 플라즈마(non-thermal plasma)를 통한 독성물질 제거나 세균, 바이러스, 곰팡이 등에 살균 및 의료 분야에 이르기까지 다양하게 활용된다(Heinlin 등, 2010; Emmert 등, 2013). 플라즈마는 사용 목적에 따라 여러 가지 방식으로 발생시킬 수 있는데, 그 중 코로나 방전(corona discharge)이나 유전체장벽방전(dielectric barrier discharge, DBD)등의 방식은 대기압에서 공기 또는 산소(O2)를 OH라디칼, 과산화수소(H2O2) 및 오존(O3) 등 활성산소종(reactive oxygen species)과, 질산염(NO3-)같은 활성질소종(reactive nitrogen species, RNS) 등을 생성한다(Lock 등, 2006; Deng 등, 2006; Kang 등, 2002). 플라즈마가 수중에서 발생 될 경우, 기체상태의 플라즈마와 액상물질간의 반응을 통해 생성된 활성종은 용존 되는데, 이를 플라즈마 활성수(plasma-activated water)로 정의한다(Leys, 2009; Kang 등, 2015).
플라즈마 활성수의 주된 성분인 활성질소종(reactive nitrogen species, RNS)은 식물체에 공급하는 양액을 구성하는 요소 중 하나로, 질소(N)는 전사 및 mRNA 안정성에 영향을 미치는 경로를 통해서 특정 단백질의 발현을 조절하며(Sugiharto와 Sugiyama, 1992), 아미노산에 결합하여 뿌리발달, 신진대사 등의 신호전달로도 작용할 수 있다. 또한, 질소 공급원은 알칼로이드(Zhong, 2001), 안토시아닌 등의 화합물의 2차 합성에 중요한 역할을 한다고 보고되었다. 그리고 질소의 함량이 높아지면 화훼류에서 개화까지의 기간이 단축된다는 연구 결과도 발표되었다(Amarjeet 등, 1996). 그뿐만 아니라 플라즈마 활성수 생성 과정에서 발생하는 H2O2는 안정적인 활성산소종(reactive oxygen species, ROS)으로, 식물에서 신호 분자의 역할을 한다(Hung 등, 2005). 식물체에 H2O2를 처리할 경우 생장조절 호르몬인 abscisic acid(ABA)와 gibberellic acid(GA)이 조절되어 종자 발아를 촉진시키며(Bahin 등, 2011), 산화스트레스와 관련한 이차대사산물의 증가에 영향을 주는 것으로 알려져 있다(Orozco-Cárdenas 등, 2001). 유칼립투스(Eucalyptus pulverulenta)의 경우 H2O2 0.5%와 1%에 침지했을 때 α-pinene과 1,8-cineole의 함량이 증가했다고 보고되었으며(Baik와 Yi, 2018), 렌틸콩에서 항산화 능력과 phenolic acid 함량의 증가를 촉진하는 것으로 알려졌다(Swieca, 2015). 또한, 생성된 플라즈마수로 식물을 재배했을 때 콩의 발아율 및 줄기 생장을 향상시켰으며(Zhang 등, 2017), 무는 발아율이 80%, 토마토는 줄기가 60% 더 높았다고 보고되었다(Sivachandiran 등, 2017).
상추(Lactuca sativa L.)는 1년생 초본식물로 지상부는 쌈 채소 및 샐러드로 사용되고 있으며 비타민 A, B, C와 다량의 철분 및 섬유소를 포함하고 있는 것으로 알려져 있다(Jang 등, 2007). 상추의 폴리페놀(polyphenol) 중 하나인 rutin은 플라보노이드 배당체로(Kreft 등, 1999) 섭취 후 3,4-dihydroxyphenyl acetic acid(DHPAA), 3,4-dihydroxytolene (DHT), 3-hydroxyphenyl acetic acid(HPAA)와 같은 다양한 대사산물로 전환되고(Jaganath 등, 2009; Pashikanti 등, 2010; ) 혈관의 투과성과 동맥 경화의 위험을 감소시키며 고혈압을 감소시키는 효능이 있다고 보고되었다(Wojcicki 등, 1995). 또한, 상추가 가진 기능성 물질 중 quercetin도 flavonoid 계열의 성분으로 인체에서 항염증 및 항산화 효과가 있으며(Lee 등, 2015; Kang 등, 2010), epicatechin은 알츠하이머와 같은 신경성 질환을 예방할 수 있다고 보고되었다(Lee 등, 2006). 그 외에도 기능성 색소로 카로티노이드(carotenoid)와 안토시아닌(antocyanin) 성분이 존재하며(Mulabagal 등, 2010), 이러한 2차 대사산물을 증가시키기 위해 많은 연구가 이루어지고 있다.
수경재배는 토양 없이 물을 이용해 작물에 양분을 공급하는 시스템으로, 안정적인 수확이 가능하고 균일한 크기의 작물을 생산할 수 있다는 특징이 있다. 국내 수경재배는 무농약 고품질 원예작물에 대한 소비자의 기호가 늘어가면서 증가하였으며, 최근에는 친환경적인 방식으로 상품의 품질을 높이려는 연구와 기술의 전환이 이루어지고 있다(Yu와 Bae, 2005). 또한, 소비자는 면역력 증진, 항바이러스 효과 등과 같이 기능성 강화식품에 대한 관심도가 높아지고 있으며(Rha 등, 2014), 이에 따라, 식물의 2차 대사산물을 이용하여 제품 가공 및 개발 연구가 활발해지고 있다(Lee 등, 2018).
따라서 본 연구에서는 담액수경재배 시스템(deep flow technique, DFT)과 플라즈마 발생장치를 결합하여 상추 재배기간 동안 간헐적 플라즈마수 처리가 생육 및 페놀류 함량에 미치는 영향에 대해 알아보고자 수행되었다.
재료 및 방법
1. 식물재료 및 정식
상추(Lactuca sativa L.) 종자(Kwonnong Co. Ltd., Cheongju, Korea)를 240공 암면배지(Kiemplug standard tray, Grodan, Denmark)에 파종하여 22±2℃에 48시간 동안 암 처리 후 광 강도 220±10μmol·m-2·s-1, 습도 70-75%의 조건에서 21일간 육묘하였으며 저면관수로 2일 간격으로 관수하였다. Hoagland 양액(NO3-N 14me·L-1, NH4-N 1me·L-1, PO4-P 3me·L-1, K 6me·L-1, Ca 8me·L-1, Mg 4me·L-1, SO4-S 4me·L-1)을 사용하여 본엽이 발생한 시점부터 급액 하였다. 파종 후 3주째 본엽이 3-4매 전개되었고 이후 균일한 묘를 선정하여 semi-DFT(Gafatec Co. Ltd., Jincheon, Korea) 3개의 재배 장치에 14주씩 총 42주를 정식하여 온실에 설치된 선반에 정치하였다. 온실은 복합환경제어기(Magma, Green Control System Ltd., Korea)를 통하여 주야간 환기 설정온도와 난방 설정온도 18-24℃를 유지하였으며, 정식 후 양액의 농도는 EC 1.2±0.2dS·m-1, pH 6.5±0.2로 설정하였으며 3일에 한 번씩 측정하였다.
정식간격은 평균 6cm로 매우 밀식 조건이었으며, 2주 후에 정식 거리로 인한 뿌리의 양분 경합 방지 및 지상부 생육의 발달 정도를 고려하여 솎아주기 작업을 실시하였고, 양액의 pH 및 EC 변화를 고려하여 1주일 간격으로 새로 갈아주었다. 총 4주간 semi-DFT 시스템에서 상추를 재배하였으며, 이후 수확하여 생육조사 및 기능성 물질 분석을 실시하였다.
2. 플라즈마 발생 장치 및 플라즈마수 분석
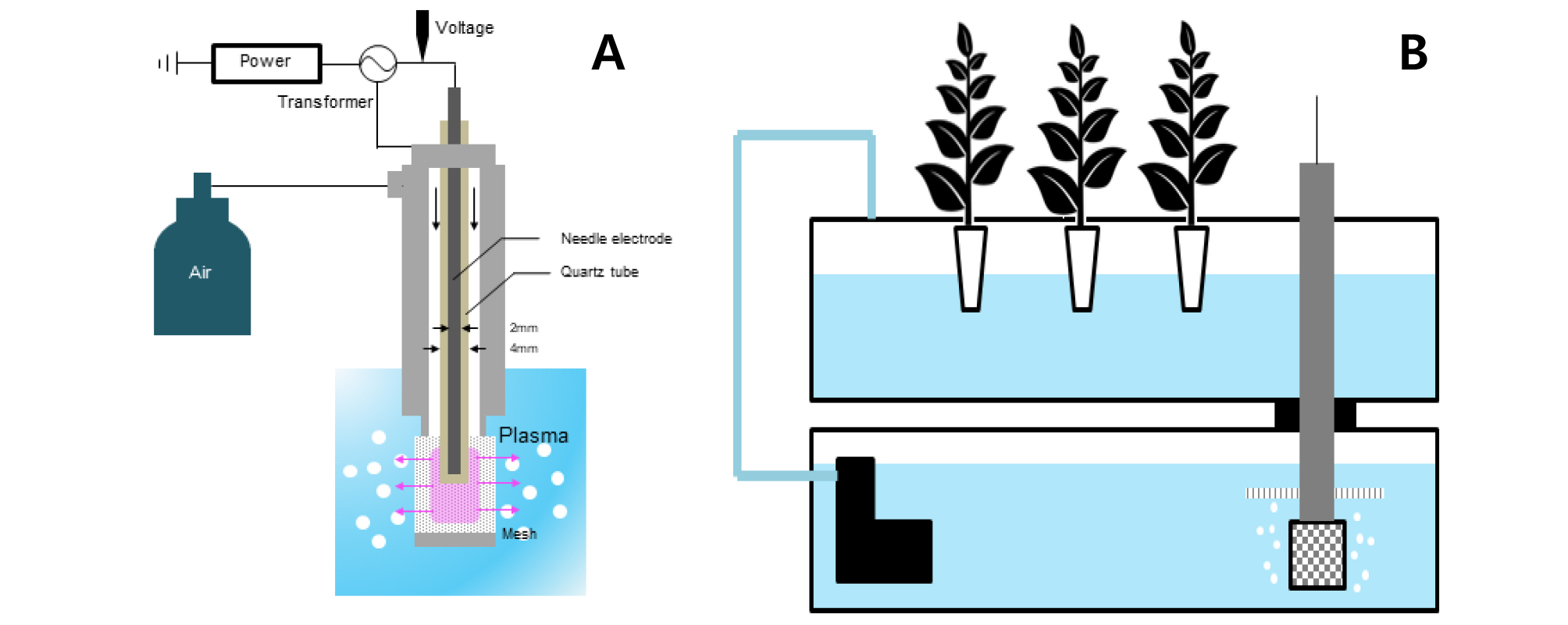
플라즈마는 그림과 같이 코로나 방전을 이용해 수중에서 생성이 되었다(Fig. 1A). 전극은 반경 2mm이며, 전극을 둘러싸고 있는 석영관은 반경 4mm로 구성이 되었다. 전원장치를 통해서 전압을 조절하였으며 변압기(transformer)를 통해 증폭을 시켜 방전이 이루어지는 방식으로 설계하였다. 플라즈마 발생용 변압기의 주파수는 25kHz 정현파로 최대전압은 4.2kV와 5.7kV로 인가하였다. semi-DFT에서 플라즈마 장치가 작동하는 동안 수중에 흐르는 전류는 최대 30mA로 측정이 되었다. 플라즈마수 생성 시간 동안 주입되는 기체는 산소가스를 사용하였으며, 2L·min-1의 속도로 주입을 하였다. 생성된 플라즈마는 유동과 함께 메쉬형 전극을 통해 양액으로 용존 되도록 그림(Fig. 1B)과 같이 플라즈마 발생장치를 담액수경재배 시스템과 결합을 하였다.
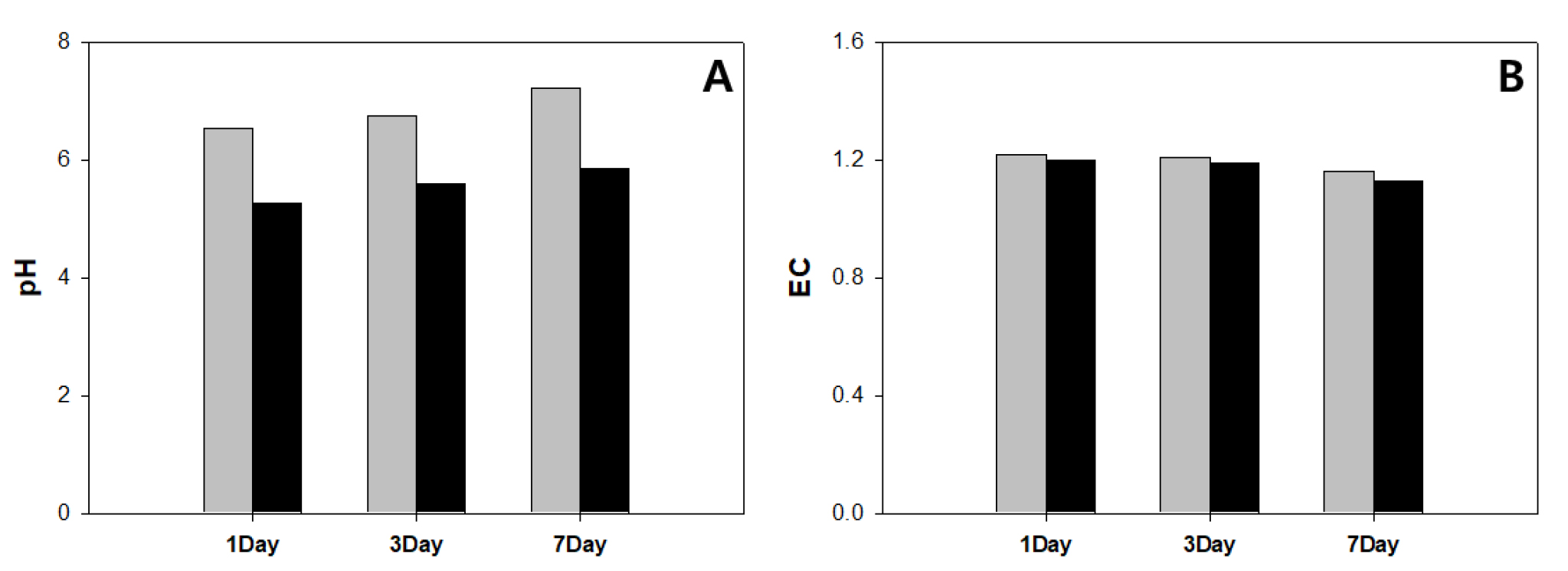
재배기간 동안 플라즈마는 하루에 8시간 주기로 1시간 작동시켰으며, 24시간동안 총 3시간 작동시켰다. 작동 시간대는 7-8시, 15시-16시, 23-24시로 설정을 하였으며, 수중 플라즈마가 발생하는 동안 pH 및 EC의 변화를 알고자 양액 교체한 날을 기준으로 1일, 3일, 7일차에 측정을 실시하였다. 측정은 양액(nutrient solution, NS)에서 플라즈마 발생 전과 발생 중 2가지의 경우로 나누어 측정하였고, 그 결과 pH는 시간이 지날수록 높아졌으며 플라즈마 처리 중에는 급격히 감소하는 모습을 나타내었다(Fig. 2A). EC는 생육기간 동안 변화량이 많지 않았으며, 플라즈마 발생 중에도 큰 차이가 나타나지 않았다(Fig. 2B).
3. 생육조사 및 성분 분석
상추의 생육조사는 수확 후 캘리퍼스(SD500-300PRO, Shin Con CO. Ltd., Korea)를 이용하여 상추의 가장 큰 엽을 기준으로 엽장, 엽폭, 근장을 측정하였으며, 처리구별 비파괴 엽록소 함량을 측정하기 위하여 SPAD-502(Minolta Camera Co. Ltd., Japan)을 이용하여 단위면적당 엽록소 수치를 측정하였다. 지상부의 생체중과 지하부의 생체중은 전자저울(MW-2N, CAS Co. Ltd., Korea)을 이용하여 측정하였다. 건물중 측정을 위해 지상부와 지하부를 각각 시료분석용 봉투에 넣어 70℃로 설정한 건조기(HB-501M, Hanbaek Scientific Technology Co. Ltd., Bucheon, Korea)를 사용하여 1주일간 건조시킨 후 동일한 전자저울로 측정하였다.
상추의 기능성 물질 함량 분석을 위해 지상부와 지하부로 나누어 시료분석용 봉투에 넣은 후 동결건조기(TFD5503, Ilshin BioBase Co. Ltd., Korea)를 이용하여 –79℃ 초저온 냉동고에 4일간 건조시켰다. 이후 건조된 상추를 믹서기(SMX 800SP, Shinil Co. Ltd., Korea)를 이용하여 분쇄하고 유발과 유봉을 이용하여 분말화 하였다. 각 처리구와 대조구 상추 분말 0.05g을 MeOH(2ml의 80%)에 넣은 후 1시간 동안 초음파처리(Sonication)하고 13000 rpm으로 10분간 원심분리를 진행하였다. 그리고 상등액을 추출하여 syringe filter로 필터링 후 HPLC용 vial에 담았다. 폴리페놀 함량 분석은 1260 Infinity II(Agilent Technologies Co. Ltd., The United States)를 이용하였으며, 컬럼(Column)은 optimapak C18 column(250×4.6mm, 5μm)을 사용하였으며, 컬럼 온도는 30℃, 유량은 1.0 mL/min, 검출 파장은 280nm로 설정하였다. 이동상 용매로는 0.15% 아세트산을 포함한 solvent A 와 80% MeOH를 solvent B로 사용하여 분석을 진행하였다.
4. 통계 분석
생육조사를 위하여 각 처리구 당 4주의 샘플을 분석하였으며, 페놀 함량 분석을 위해서 각 처리구 당 3주의 상추가 이용되었다. 측정 데이터의 통계 분석은 SPSS 20(SPSS 20, SPSS Inc., Chicago, IL, USA)프로그램을 이용하여 변량분석(ANOVA)을 실시하였으며, 각 처리구의 평균간 유의성 검증을 위하여 Tukey의 다중검정법(P≤0.05)을 이용하였다.
결과 및 고찰
1. 생육분석
담액수경재배 시스템과 플라즈마 발생장치를 결합한 전압차에 따른 상추의 생육조사 결과 대조구가 4.2kV, 5.7kV에 비해 엽장은 각각 1.07cm, 0.35cm 더 길었다(Fig. 3A). 엽폭 또한 대조구 처리가 4.2kV, 5.7kV와 비교했을 때 17.6%, 12% 더 높아 가장 수치가 컸으며, 엽의 형태에서는 가장 좋은 결과를 보였으나, 유의성 검사 결과 유의적 차이는 발생하지 않았다. 그리고 정식 후 생육기간 동안 형태적인 측면으로 보았을 때 초기 단계에서 플라즈마 발생장치를 결합한 처리구가 발생장치에 가까운 위치에서 자리할수록 생장이 느린 점을 확인할 수 있었다. 단위면적 당 엽록소 함량을 나타내는 SPAD는 5.7kV 처리구가 40.08로 가장 높았지만, 마찬가지로 유의적 차이는 발생하지 않았으며(Fig. 3B), 엽면적은 지상부의 엽장과 엽폭의 수치가 컸던 대조구가 4.2kV와 5.7kV에 비해 28.8%, 18.22% 더 높았다(Fig. 3C). 근장은 지상부의 생육결과와 반대로 4.2kV가 48.35cm로 대조구 및 5.7kV와 비교했을 때 42.5%, 42.3% 더 길었으나, 유의적인 차이는 발생하지 않았으며 이는 플라즈마수 처리 동안 미량의 오존 가스가 발생되면서 피해를 입었기 때문으로 추정된다(Fig. 3D). 마찬가지로 지상부 및 지하부의 생체중, 건물중의 조사 결과 유의적인 차이는 발생하지 않았다. 지상부 생체중은 대조구가 53.76g으로 가장 좋았으며, 4.2kV 및 5.7kV와 비교하여 39.6%, 10.8%씩 높았고 지상부의 건물중 또한 생체중과 경향이 같았다(Fig. 3E). 지하부의 생체중 및 건물중의 평균값은 대조구가 더 높은 경향을 나타내었다(Fig. 3F). 지하부의 생체중은 대조구가 4.2kV, 5.7kV에 비해 17.9%, 10.4% 더 높았으며, 건물중은 8%, 10.1%만큼 증가하였다.
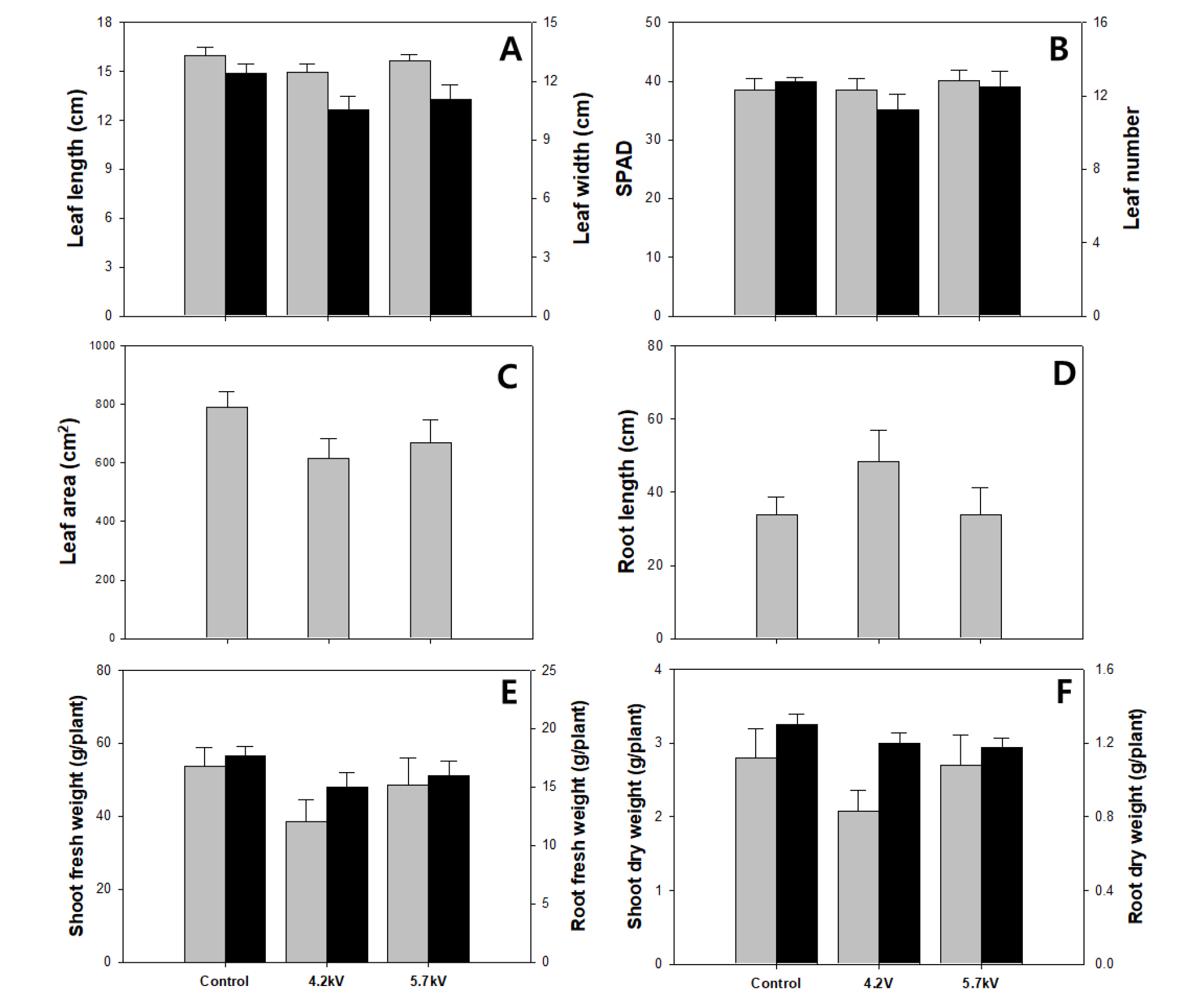
Fig. 3.
Leaf length and leaf width (A), SPAD and leaf number (B), leaf area (C), root length (D) shoot fresh weight and root fresh weight (E), shoot dry weight and root dry weight (F) of the lettuce grown in the plasma activated water for 4 weeks. Gray bars represent left items, black bars represent right items. The data represent the means and the vertical bars indicate standard errors of Lactuca sativa L.(n=4).
플라즈마를 수중에서 발생시키게 되면 활성산소종(ROS) 및 활성질소종(RNS)이 생성 되는데 그 중 O3가 대기중으로 방출이 된다(Sakiyama 등, 2012). 이렇게 발생하는 오존(O3)은 식물의 잎을 통해 들어와 물질대사에 영향을 끼치는 2차 대기오염물질 중 하나이고(Woo 등, 2004), 식물체에 있어 생체막에 피해를 주며, 투과성 증가로 인한(Heath, 1987) 수침 증상 및 백색 반점이나 갈변 등의 가시적 장해를 유발한다(Beckerson과 Hfstra, 1980). 또한, 잎에 영향을 미쳐 광합성의 양을 감소시키며 동화 산물의 분배를 억제함으로 root/ shoot ratio에 관여하는 것으로 보고되어 있다(Wulff 등, 1996; Coleman 등, 1996). 본 연구에서 정식 후 상추의 생육기간 동안 플라즈마수 처리구에서 초기에 잎이 갈변하여 괴사하는 현상이 일부에서 나타났으며, 대조구에 비해서 지상부의 발달이 늦어지는 경향을 확인할 수 있었다. 이는 플라즈마 발생장치로부터 발생된 O3가스 또는 래디컬에 의해 초기 생육이 불량해지고 지속적인 스트레스에 노출 되어 생육이 억제된 것으로 판단된다.
수경재배에서 플라즈마를 발생시키면 수중 pH가 감소하는데, 이는 질소와 산소가 질산을 생성하기 때문으로 보고되었다(Kim과 Park, 2012). 앞서 언급한 대로 본 실험에서 4.2kV 처리구를 1일, 3일, 7일차에 측정한 결과 플라즈마 발생 시간 동안 평균 1.3±0.2가 떨어진 것을 확인할 수 있었으며, 전기전도도(EC)는 0.1이 낮아졌다. 양액의 pH 및 EC 변화는 식물의 양분 흡수에 관여하여 생육에 영향을 주는 것으로 알려져 있다(Trejo-Tellez 와 Gomez-Merino, 2012). 하지만 상추의 경우 pH 5.0-7.0까지는 생육적인 측면에서 차이가 발생되지 않는다고 보고되었으며(Park 등, 1999), Bres 등(1992)의 연구에서는 pH를 5.0-6.5까지의 생육을 보았고 그 결과 pH 값이 Mg, P, Ca의 함량에 영향을 주지만 그 차이가 상추의 생육과 관련이 있는 것은 아니라고 보고하였다. 따라서 본 실험에서 이루어진 양액에서 pH의 변화는 상추의 재배에 적절한 수준에서 이루어졌고, 생육 결과에 영향을 미치지 못한 것으로 판단된다.
상추가 재배기간 동안 제대로 생육이 이루어지지 못하고 일부에서 O3 가스로 인한 초기 괴사 및 갈변현상의 발생을 확인하였으며, 그로 인해 광합성 속도 감소로 인한 생육차이가 나타난 것으로 추정되며, 따라서 이후 지상부 생육 조사에서 유의성은 인증되지 않았지만, 식물체 생육이 저조한 결과가 생긴 것으로 생각된다. 따라서 플라즈마수 공정장치와 수경재배 시스템을 결합하기 위해서는 시스템을 분리하여 플라즈마 발생 후, 오존가스를 분리 또는 흡착시켜 제거한 후 사용하는 방식의 적용이 필요하다고 판단된다.
2. 기능성 물질 분석
담액 수경재배 시스템에 플라즈마 장치를 결합하여 상추를 4주간 재배한 후 기능성 물질을 분석하였다. 상추의 단위 중량당 epicatechin 함량에서는 5.7kV처리가 가장 유의적으로 높았으며, 대조구 및 4.2kV 처리구와 비교했을 때 54.8%, 19.9% 증가한 수치를 나타내었다(Fig. 4A). Rutin의 경우 대조구 처리가 플라즈마 4.2kV, 5.7kV 처리구에 비해 73.7%와 20.2%씩 유의적으로 높았다. 총 페놀의 함량도 마찬가지로 대조구가 처리구에 비해 유의적으로 함량이 높았으며 4.2kV와 5.7kV의 사이에서 유의적 차이는 발생되지 않았다(Fig. 4B). 플라즈마 수 처리에 따른 상추 지상부의 페놀류의 함량분석을 통해 epicatechin의 경우 증가되었으며, rutin과 총 페놀에서는 대조구에서 높은 경향을 나타내어 기능성 물질의 종류에 따라서 증감 패턴이 다양할 것으로 사료된다.
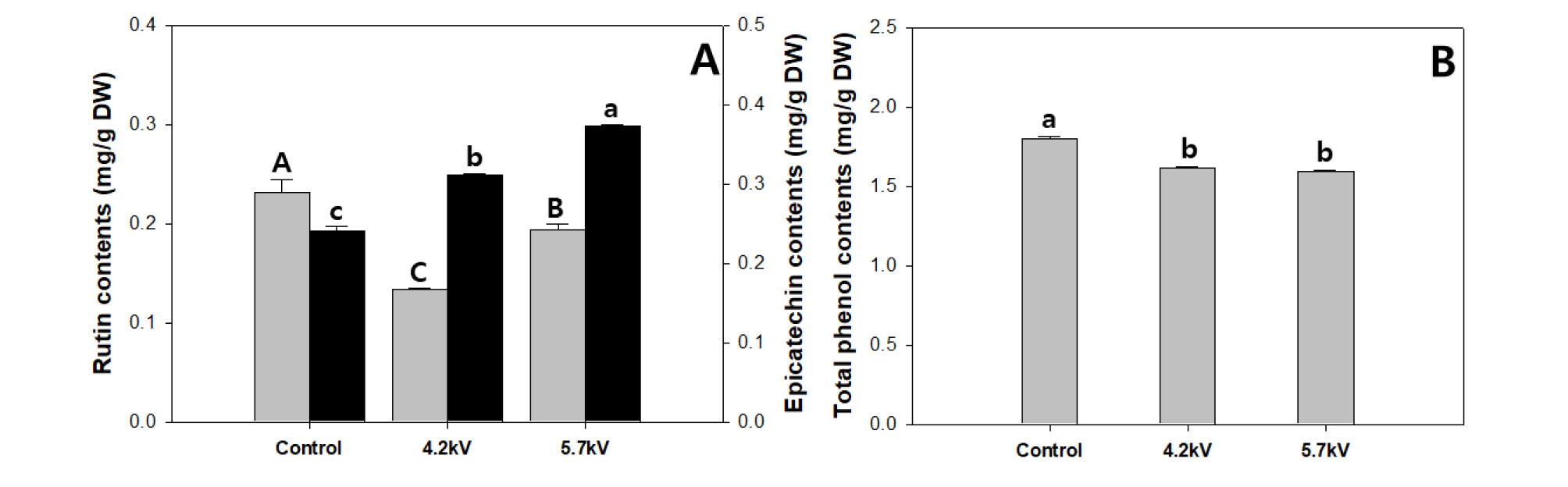
Fig. 4.
Rutin and epicatechin contents (A), total phenolic contents (B) of lettuce grown in plasma activated water for 4 weeks. Gray bars represent left items, black bars represent right items. The data represent the means and the vertical bars indicate standard errors (n=3). Different letters at the top of bars indicate significances of Lactuca sativa L.(P≤0.05).
뿌리에서는 총 4가지(epicatechin, rutin, quercetin, total phenolic)의 페놀류가 검출되었다. Epicatechin은 4.2kV 처리구가 단위 무게 당 함량이 가장 많았으며, 대조구 및 5.7kV와 비교했을 때 각각 151%, 22.9%만큼 유의적으로 높은 값을 보였다(Fig. 5A). Rutin의 경우 플라즈마수 공정 처리에 따른 함량 차이를 가장 많이 나타내었으며 epicatechin과 동일한 경향을 보였다. 4.2kV 처리구가 유의적으로 가장 높았으며, 제일 낮은 값을 나타낸 대조구와 비교했을 때 약 63배 많은 함량을 나타내었다. 5.7kV 처리구에서 생장한 상추의 rutin 함량은 대조구에 비해 약 37배 높았다. Quercetin 함량은 대조구와 4.2kV 처리구간에 유의적 차이는 발생하지 않았으나, 5.7kV 처리구를 대조구와 4.7kV 처리구와 비교했을 때 각각 40.1%, 30.1% 만큼 유의적으로 증가하였다(Fig. 5B). 총 페놀 함량은 4.2kV 처리구가 가장 많은 함량을 보였지만, 5.7kV와 유의적인 차이는 없었으며, 대조구와 비교했을 때 61.5% 증가한 수치를 보였다. 플라즈마 처리수가 직접 접촉되는 근권부의 경우 거의 모든 페놀류에서 유의적으로 높게 나타났으며, 향후 뿌리채소의 수경재배 방식에 적용할 경우 기능성 물질 증대기술로 적용할 수 있을 것으로 사료된다.
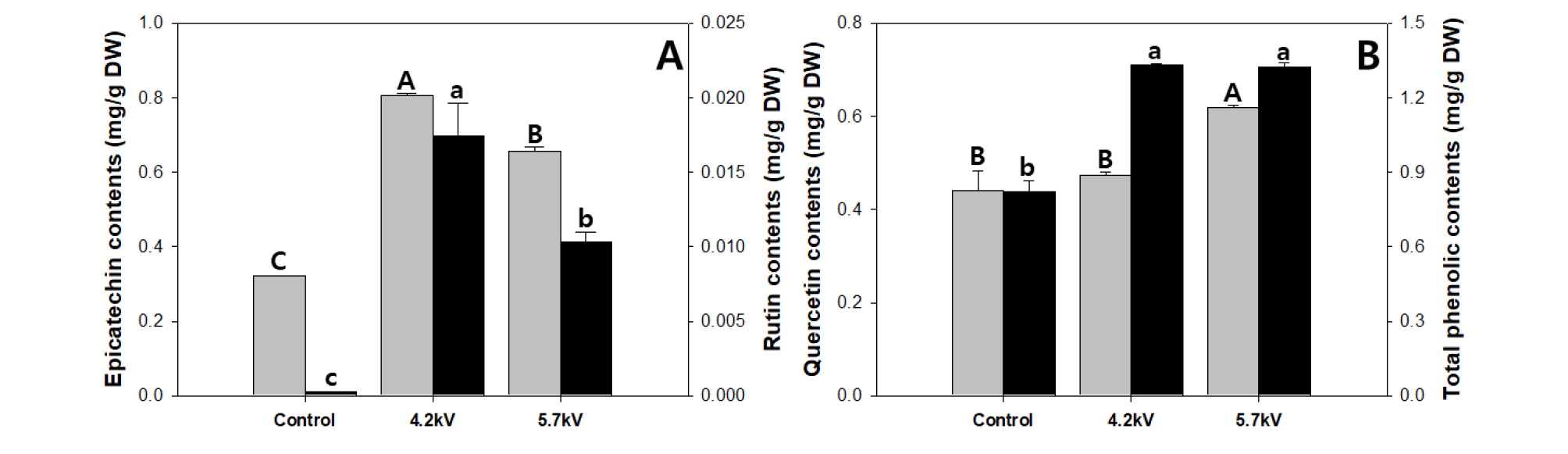
Fig. 5.
Epicatechin conctents and rutin contents (A), Quercetin contents and total phenolic contents (B) of the lettuce root grown in plasma activated water for 4 weeks. Gray bars represent left items, black bars represent right items. The data represent the means and the vertical bars indicate standard errors (n=3). Different letters at the top of bars indicate significances in of Lactuca sativa L.(P≤0.05).
앞선 내용에서 언급했듯이, 플라즈마수 공정 동안 수중에서 활성질소종(RNS)이 생성이 되는데, 만들어진 RNS 중에서 NO3-는 식물체의 근권부에 있어서 질소(N)의 공급원이 된다. 질소는 상추의 페놀산 및 플라보노이드의 생합성에 관여한다고 알려져 있는데, Becker(2015)의 연구에 의하면 phenylpropanoids의 생합성을 담당하는 페닐알라닌(phenylalanine)의 활성이 낮은 질소 농도에서 더 높다고 보고되었으며, 녹색 채소의 지상부에서 질산염의 함량이 높아질수록 비타민 C를 감소시킨다는 연구 결과도 발표되었다(Moazafar, 1996). 하지만 Mampholo의 연구(2018)에서는 적정량의 질소 공급은 phenolic acid, flavonoids, ascorbic acid를 증가시켰다고 하였으며, 이는 상추 유전자형에 의해서 다르게 나타날 수 있다고 주장하였다. 따라서 본 실험에서 사용한 품종에 대해 플라즈마수 처리에 따른 NO3- 생성이 기능성 물질 함량을 증대시킨다는 것은 이후 실험을 통한 구명이 필요할 것으로 생각된다.
플라즈마 공정 동안 발생하는 활성산소종(reactive oxygen species, ROS)은 자연환경에서 스트레스에 노출된 식물이 스스로 생성하며(Apel과 Hirt, 2004), ROS로부터 세포막과 유기체를 보호하기 위해 식물 스스로가 항산화 효소를 활성시킨다(Mittler 등, 2004). ROS 중 과산화수소(hydrogen peroxide, H2O2)는 항산화 효소, phenyl ammonium lyase(PAL), 단백질 등에 영향을 주는 것으로 보고되었으며(Hung 등, 2005; Habibi, 2014), 저농도의 H2O2는 페놀화합물과 같은 식물 내 2차 대사산물의 합성을 유도할 수 있다고 알려져 있다(Moskova 등, 2009). H2O2를 뿌리에 처리할 경우 항산화 효소의 활성을 높이며 지질 과산화 완화를 통하여 환경 스트레스에 대한 내성이 증가하며(Christou 등, 2014), 적정 수준에서 과산화수소의 농도가 높아지면 NO3-의 흡수 또한 증가하는 경향을 보인다는 연구가 보고되었다(Mori와 Watanabe, 2017). 본 실험에서는 ROS의 농도를 측정하지 않았지만, 플라즈마수 처리 시간동안 생성되는 H2O2 및 NO3-가 상추의 기능성 물질 함량 증대에 영향을 미친 것으로 생각된다.
담액수경재배에서 플라즈마 처리수 공정장치를 결합한 시스템이 상추의 재배에 있어서 기능성 물질 함량 변화에 미치는 영향을 분석한 결과 플라즈마 활성수 처리는 지상부의 생장에는 부의 효과를 나타내었나, 근권부의 페놀류와 같은 이차대사산물의 함량을 증대시키는 결과를 나타내었다. 본 실험에서는 플라즈마 활성수를 지속적으로 발생시켜 처리하였으나, 간헐적 발생에 따른 생리 장해를 줄이는 방안과 이차대사산물의 축적을 다시 검증할 필요성이 있으며, 본 기술을 뿌리채소에 적용할 경우 가식부인 지하부에 포함된 높은 기능성 물질을 기대할 수 있을 것으로 사료된다.