© The Korean Society for Bio-Environment Control. All rights reserved.
ABSTRACT
서 론
식물의 생육 환경을 정밀하게 조절하여 계획적인 생산 을 가능케 한 식물공장시스템의 개념은 1957년 덴마크 크리스텐센 농장의 cress 새싹채소 생산에서 시작했다고 할 수 있다(Lee 등, 2015). 특히 새싹채소는 폐쇄형 시 스템에서 재배가 용이하기 때문에 적합한 인공광 적용이 매우 중요한데, 식물의 생장과 내적 품질이 광질에 크게 영향을 받기 때문이다. 적색광은 줄기 신장 촉진 (Buschmann, 2007), 청색광에 의한 적상추의 안토시아닌 함량과 케일 새싹의 glucoraphanin 함량 등 항산화능 증 가에 효과적이라고 알려졌으며(Johkan 등, 2010), 적색광 과 청색광의 혼합광에서 광합성효율과 생육이 효과적으 로 상승한다고 보고되어 왔다(Johkan 등, 2010;Yorio 등, 2001). 또한 근적외선광은 군락내의 초장 신장 촉진 효과(Casal, 2013)가 알려져 있고, 인공광의 근적외선광 의 비율이 높아질수록 배추과 새싹채소의 총 플라보노이 드와 비타민C 함량은 증가하였다고 보고되었다(Jo와 Lee, 2018). Han 등(2018)은 파장대별로 서로 다른 소자 가 필요한 LED와는 달리 초미세 반도체 입자로 다양한 파장대를 설정할 수 있는 Quantum Dot-LED (QDLED) 를 폐쇄형 식물공장의 광원으로 소개하였는데, QD-LED는 다양한 파장대의 적색광을 조사할 수 있어 상추의 생육 촉진 효과가 있다고 하였다.
새싹채소는 성채에 비해 단백질, 비타민, 무기질, 식이 섬유 등의 유용한 영양소가 풍부한 것으로 알려져 있다. 또한 항산화 성분의 약리작용을 기대하게 만드는 건강식 품으로서 각광을 받고 있다(Kim 등, 2014). 새싹채소는 본 잎이 나오기 전 떡잎 상태 일 때 유용한 생리활성 물질의 생성량이 최대치가 되어 성체에 비해 4-100배 이상 함유되어 있다고 보고되었다(Ha 등, 2009). 재배과 정에서 농약을 사용하지 않기 때문에 종자 단계에서부터 미생물에 오염되어 있거나, 재배 중 오염되기 쉬워 철저 한 살균 안정성이 요구되는 것이 새싹 채소의 특징이다 (Jun 등, 2009). 국내 새싹채소 시장규모의 증가와 지속 적인 수요가 요구되는 시점에서 가장 소비자들에게 널리 알려져 있는 작물은 무순이다. 무 싹은 phase 2 enzyme 유도능력으로 항암 등의 효과를 나타내는 것으로 알려져 있고(Lee와 Lee, 2006), 적무(Raphanus sativus L.) 새싹 은 일반 무순과 다르게 배축이 적색을 띠며 항산화 효능 까지 우수한 것으로 알려져 있다(Kim 등, 2014). 적무 주 성분으로는 색소 성분인 pelargonidin-type anthocyanins과 phenol계 compounds, phenolic acids 함량이 높고 kaempferol 같은 flavonoids 성분인 것으로 보고되었다 (Jing 등, 2014). 국내 적무 새싹에 관한 연구는 새싹종 자 소독제 및 열 처리에 따른 미생물 제어 및 발아율 (Jun 등, 2010)와 새싹의 비만 억제 효과(Kim 등, 2014) 등이 보고된 바 있다.
이에 본 연구는 배추과 새싹채소의 기능성 향상에 효 과적인 것으로 알려진 근적외선과 몇 가지 파장대의 광 원이 새싹 적무의 종자 발아와 생육, 그리고 항산화능 등의 품질과 미생물 증식 정도에 미치는 영향을 알아보 고자 수행하였다.
재료 및 방법
1. 광원에 따른 적무 발아율 비교
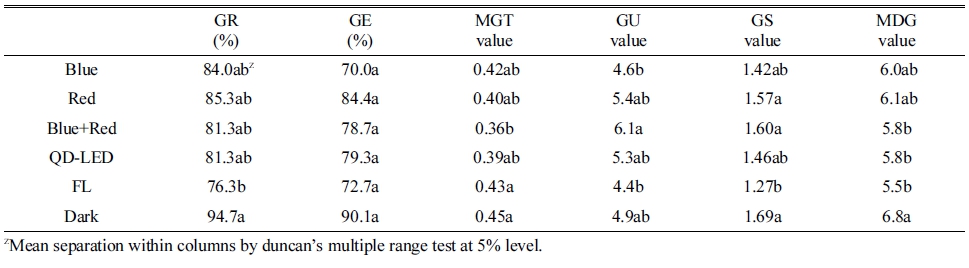
적무(Raphanus sativus L.) 종자(Asia seed, Korea)를 새싹 전용 재배 용기에 부직포를 이용하여 25개 종자를 3반복으로 치상 후 챔버내에서 청색(Blue), 적색(Red), 청색+적색(Blue+Red) 그리고 청색+적색+원적색 혼합광 (QD-LED)광을 43±2μmol·m-2·s-1로 조사하였고, 대조구로 명조건(형광등 Fluorescent lamp-FL) (Daytime, Alim, Korea)과 암조건(Dark)을 두었다(Fig. 1). 발아율은 챔버내 온도 20±2°C와 70±5% 습도로 설정하여 12시간 간격으로 총 3.5일간 조사하였다. 조사된 수치를 이용하여 발아율 (Germination rate, GR), 발아세(Gemination energy, GE), 평 균발아일수(Mean germination time, MGT), 발아균일도 (Germination uniformity, GU), 발아속도(Germination speed, GS), 그리고 평균발아속도(Mean daily germination, MDG)를 아래의 식으로 계산하였다(Jeon 등, 2013).
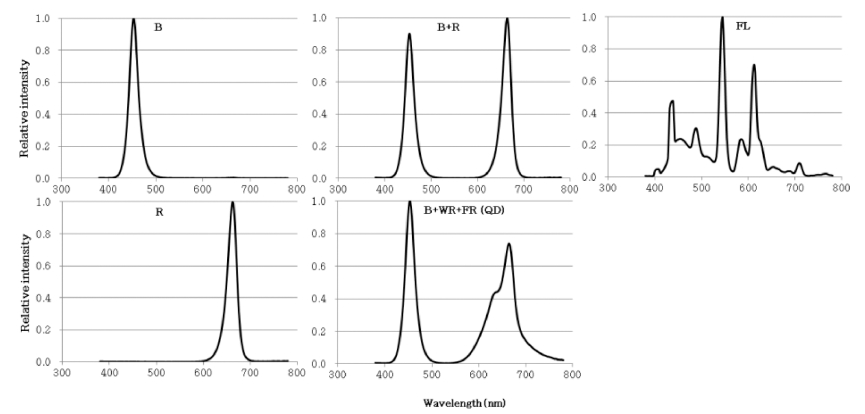
Fig. 1
Relative spectral distribution of the LEDs (Blue, Red, B+R), QD-LED (B+WR+FR) and FL (cool white fluorescent lamp) used in this study. Photosynthetic photon flux was about 43±2 μmol·m-2·s-1 in each treatment. Spectral scans were recorded at the top of the pots and averaged at 5 points of each treatment.
(N: 총 발아종자수, S: 총 공시 종자수, Nx: 가장 많이 발아한 날까지 총 발아종자수, Ni: 조사 당일의 발아종 자수, Ti: 치상 후 조사일수, T: 총 조사일수)
2. 광원에 따른 생육 및 품질 비교
발아율이 가장 우수하였던 암조건에서 7일간 재배 후 24시간동안 광처리를 실시하였다. 새싹 적무 생산을 위 해 적무 종자를 온수에 약 24시간 shaking 한 후, 5g씩 6반복으로 치상하여 챔버내 온도 20±2°C와 70±5% 습도 의 암조건에서 7일간 재배하였다. 배축이 6-8cm 인 상 태일 때 광조사를 시작하였는데, 처리한 광원은 청색 (Blue), 적색(Red), 청색+적색(Blue+Red)의 LED광과 청 색+적색+원적색 혼합된 QD-LED광 그리고 형광등(FL) 이었는데 광도는 43±2μmol·m-2·s-1 이었고, 24시간 조사 하였다(Fig. 1). 또한 암막을 설치하고 재배한 암조건 (Dark)을 두었다. 광조사 전과 후에 색차계(CR-400, Konica minolta, Japan)를 이용하여 자엽과 배축의 색 변화를 측정하였고, 처리구별로 수확 한 후 생체중과 초 장을 조사하였다.
DPPH 라디컬 소거능은 Oboh (2005)의 방법에 준하여 생체시료 0.5g을 메탄올 20mL과 섞어 균질화 한 후 균 질 시료 0.1mL와 0.4mM DPPH 메탄올 용매를 혼합하 여 암조건에서 30분 방치한 후 분광 광도계(Biomate 3S, Thermo Scientific, USA)를 사용하여 516nm의 흡광 도에서 측정하였다. DPPH 라디컬 소거능은 백분율로 나타내었으며 다음과 같은 공식을 적용하였다.
|
$$\mathrm{DPPH}\;\mathrm{Radical}\;\mathrm{scavenging}\;\mathrm{ability}\;(\%)\;=\;\lbrack1\;-\;(\mathrm{Sample}\;\mathrm A516\mathrm{nm}/\;\mathrm{Blank}\;\mathrm A516\mathrm{nm})\rbrack\;\times\;100$$
| |
총 페놀 함량은 Folin-Denis 방법으로 측정하였다 (Zhang 등, 2006). 시료 용액(1mg/mL) 100μL와 증류수 900μL를 혼합하고, Folin-Ciocalteau’s phenol reagent 100μL를 가하여 잘 섞은 후 5분간 상온에서 반응시켰다. 여기에 20% Na2CO3 300μL를 가하여 혼합한 다음 증류 수를 가하여 2mL로 조정하였다. 이 용액을 상온에서 2 시간 동안 방치한 후 760nm에서 흡광도를 측정하였고, gallic acid를 이용한 검량선과 비교하여 총페놀 함량을 mg gallic acid equivalents(GAE)/g으로 나타내었다.
총 안토시아닌 함량은 적무 새싹의 생체중 2g을 채취 하여 95% ethanol과 1.5N HCI을 85:15(v/v)로 혼합한 추출액을 막자사발에 2mL를 넣고 마쇄하였다. 마쇄한 용액을 마이크로 튜브에 1mL를 취한 후 4°C 암조건 하 에서 24시간 보관 후 13,000rpm에서 20분간 원심 분리 하여 얻은 상등액을 희석하였다. 그리고 분광 광도계 (Biomate 3S, Thermo Scientific, USA)의 535nm 에서 흡광도를 측정하여 총 안토시아닌 함량을 산출하였다 (Fuleki와 Francis, 1968;Islam 등, 2019).
|
$$\mathrm{Anthocyanin}\;(\mathrm{mg}/100\mathrm g\;\mathrm{fresh}\;\mathrm{wt}.)\;=\;(\mathrm{absorbance}\;\mathrm{at}\;530\mathrm{nm}\;\times\;\mathrm{volume}\;\mathrm{of}\;\mathrm{extraction}\;\mathrm{solution}\;\times\;100)/(\mathrm{wt}.\;\mathrm{of}\;\mathrm{sample}\;\mathrm{of}\;\mathrm{gram}\;\times\;98.2)$$
| |
3. 광원에 따른 미생물 증식
시료 2g을 무균백(sterile sample bag)에 담고 멸균수 18mL을 가하여 10배 희석시켜 stomacher(Power, mixer, B&F KOREA, Korea)를 이용하여 3분간 균질화하였다. 균질화된 시료 0.2mL을 취하여 20ml의 멸균수로 희석하 여 최종 1000배 희석액을 제조하였다. 배지는 Petrifilm TM count(3M Microbiology products, USA)를 사용하였 고, 희석액 1.0mL을 배지 위에 분주하여 세균(35°C, 48 시간), 대장균(35°C, 24시간), 그리고 곰팡이(25°C, 72시 간) 각각 배양하여 자동균수 측정기(Petrifilm Plate Reader, 3M, USA)로 집락수(colony form unit: CFU)를 계산하였다(Lee 등, 2009).
통계처리는 Microsoft Excel 2013 program과 IBM SPSS Statistics 24 program을 사용하여 표준편차와 던 컨의 다중범위검정으로 분석하였다.
결과 및 고찰
1. 광원에 따른 적무 발아율 비교
새싹용 적무 종자의 발아율(GR)은 치상후 3.5일째에 암조건(Dark)에서 94.7%로 가장 높았고, 모든 LED처리 와 QD-LED에서 81-85%, 명조건(FL) 처리에서는 76.3% 로 가장 낮았다(Table 1). Jun과 Lee (2014)가 보고한 적무 새싹 발아율 연구에서도 대조구(암조건)의 발아율 이 90% 이상인 것과 유사한 결과를 보였다. 발아세(GE) 는 암조건이 가장 높았으며, 평균발아일수(MGT)는 청색 +적색(Blue+Red)가 가장 빨랐으며, 발아균일도도 청색+ 적색이 가장 높은 수치를 나타내었다. 발아속도는 암조 건, 청색+적색, 그리고 Red가 다른 처리구에 비해 높았 으며, 평균발아속도는 암조건이 가장 높은 수치를 보였 다(Table 1). 최종 발아율이 명조건은 처리구중 가장 낮 았으며, 암조건은 가장 높게 나타나 적무 새싹 종자는 암조건에 발아하는 것이 효율적인 것으로 생각된다. Yi (1997)는 무는 암발아 종자로 알려졌으나, 무의 품종에 따라 광조사에 따른 발아율이 다를 수 있다는 보고되었 다(Lee와 Kim 1998). 또한 무 이외에 작물에서 광질에 의한 발아 연구에서 백수오는 적색, 청색, 암조건보다 형광등에서 가장 낮은 발아율을 보였고(Yoo 등, 2013), 해당화 종자도 형광등보다 청색광에서 높은 발아율을 나 타내었으나(Lee 등, 2011), 유채 종자는 청색광에서 일 반 형광등보다 낮은 발아율을 보였다(Cho 등, 2008). 이 와 같이 종자의 발아에 미치는 광질의 효과는 작물이나 품종에 따라 다르게 나타나는 것으로 판단된다. 광유무 에 의한 종자 발아의 변화는 작물의 재배방식에도 영향 을 줄 수 있어, 노지재배에서 복토의 두께를 좌우하기도 한다(Lee와 Baek, 2013). 밀폐된 시설에서 생산되는 새 싹채소는 암조건에서 발아율이 높은 것은 발아기간 중 광조사가 필요 없어 생산비 절감에도 도움이 된다고 하 겠다.
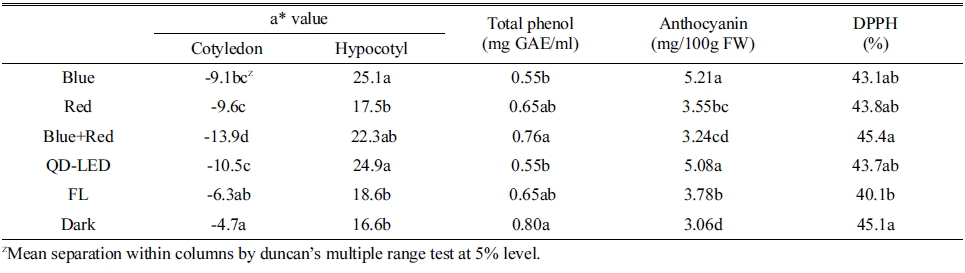
Table 1. The gemination rate (GR), germination energy (GE), mean germination time (MGT), germination uniformity (GU), germination speed (GS), and mean daily germination of red radish seed and sprout after 3.5 days of light irradiation.
2. 광원에 따른 생육 및 품질 비교
재배 종료일에 처리별로 수확 한 적무 새싹의 생체중 은 모든 처리구간의 차이에 통계적 유의성은 없었다 (Fig. 2). 본 연구에서 처리한 적색광(Buschmann, 2007), 적색+청색의 혼합광(Johkan 등, 2010;Yorio 등, 2001), 근적외선광(Casal, 2013)처리에 따른 초장, 줄기 신장 촉 진 및 광합성효율이 상승한다고 보고되었으나, 광처리에 따른 생육 지표에 유의적인 차이가 없었던 것은 광처리 를 7일간 암조건에서 재배한 후 24시간 동안만 진행하 였기 때문에 광원에 의한 생육 반응의 차이가 나타나지 않았다고 판단된다.
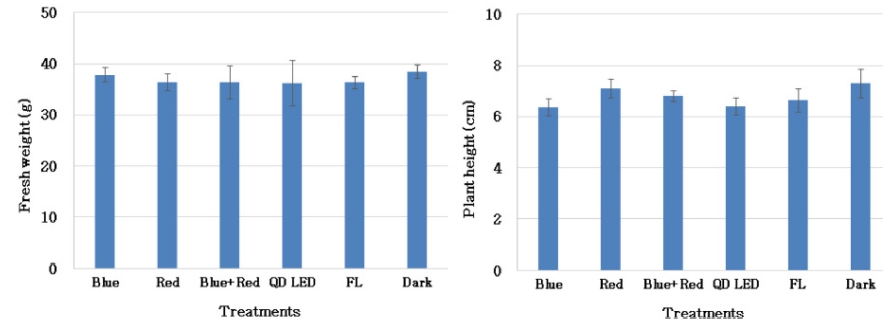
Fig. 2
The fresh weight and plant height of red radish sprout after 24 hours of light irradiation. Vertical bars represent ± SD (n = 5).
적무 새싹의 항산화 능력을 radical 소거능 측정법 (DPPH)을 이용하여 측정하였다(Que 등, 2006). 청색+적 색과 암조건이 처리구 중 유의성 있는 수치를 나타내며 가장 높았다(Table 2). 그리고 모든 처리구가 40-45% 소 거능을 보였는데, 순무 싹 에탄올 추출물을 500μg·mL-1 로 첨가하였을 때 나타낸 43.39%와 유사한 수치를 나타 내었다(Ha 등, 2009). 항산화 능력은 작물의 항산화물질 의 함량과 항산화 관련 효소의 활성에 의해 달라질 수 있는데(Rice-Evans 등, 1997), Thevetia peruviana의 세 포에서도 다른 광처리보다 페놀함량이 높았던 암조건에 서 높은 ABTS와 FRAP 활성을 보였으며, 두 활성 모두 페놀함량과 고도의 정의 상관관계를 나타낸 보고(Arias 등, 2016)와 유사한 결과였다.
Table 2. The color a* value (cotyledon and hypocotyl), total phenol, anthocyanin, and radical scavening ability (DPPH) of red radish sprout after 24 hours of light irradiation.
페놀 함량은 암조건과 청색+적색이 처리구 중 가장 높게 나타났다(Table 2). 광질에 대한 식물의 페놀 함량 에 관해서는 다양한 연구결과가 발표되었다. 다채는 청 색+적색 혼합 LED광 조사시 청색광의 비율의 높아질수 록 증가하였고(Kim 등, 2013), 보리싹에서는 청색+적색 보다 청색 단독처리가 더 높았으며(Lee 등, 2010b), 적 상추 어린잎에서는 적색+청색광에서 함량증가가 나타나 지 않았다(Johkan 등, 2010). 또한 암조건에 대해서 Jo 와 Lee(2018)는 무싹의 페놀 함량은 암조건보다 광조건 에서 함량이 높았고 하였으나, Thevetia peruviana의 세 포배양 중에는 암조건에서 가장 높은 수치를 보였으며 (Arias 등, 2016), 7일 동안 광처리하여 수확한 보리싹에 서는 암조건이 다른 광처리와 같은 수준이었다(Lee 등, 2010b). 따라서 광질에 의한 혹은 광도에 의한 페놀 함 량 변화에 대해서는 보다 세밀한 연구가 필요하다고 판 단된다.
안토시아닌 함량은 청색과 QD-LED가 다른 처리구에 비해 유의성 있는 수치를 나타내며 높았고, 청색+적색, 명조건, 적색, 암조건 순이었는데, 이는 배축의 색도와 거의 유사한 결과를 보였다(Table 2). 단색광일 경우 청 색광에서 안토시아닌 함량이 높았다는 보고(Johkan 등, 2010)와 일치하였으며, 청색광 및 자외선(UV) 조사가 안 토시아닌 축적에 효과적이라는 보고와 유사하였다(Wang 등, 2012). Hirner 등(2001)과 Konczak-Islam 등(2000)은 450nm의 피크파장을 포함한 430-470nm의 청색광 LED 가 안토시아닌 같은 페놀계 화합물을 합성시키는데 크게 기여한다고 보고하였다.
암조건 직후의 자엽과 배축 색도와 24시간 광조사 후 의 색도를 비교를 위해 녹색에서 적색을 나타내는 a* 값을 표기하였다. 자엽은 광조사 전 초기값에 비해 24시 간 광조사 후 모든 처리구가 녹색이 증가하였데, 청색+ 적색이 가장 높았으며 다음으로 QD-LED에서 높았다 (Table 2). 광조사에 따른 광합성 작용으로 엽록소가 생 성되면서 녹색을 띄게 되는데, 엽록소 함량을 증가시키 기 위해서는 청색광과 적색광의 적절한 비율의 조절이 필요하다고 하였다(Lee 등, 2010a). 배축은 암조건에서 재배시에도 적색을 띄었으며, 광처리에 의해 적색 정도 가 높아지지 않았다. 24시간 처리 후 배축의 색도는 청 색과 QD-LED가 초기값과 가장 유사하였고, 다음으로 청색+적색에서 높았다(Table 2). 이는 청색과 QD-LED 그리고 청색+적색의 청색광에 의한 것으로 판단되는데, 청색광과 UV-A가 흡수색소인 크립토크롬(cryptochrome) 이 광수용체로서의 역할을 하기 때문에 안토시아닌 색소 발현을 증가시킬 가능성이 있다고 보고하였다(Giliberto 등, 2005).
3. 광원에 따른 미생물 증식
새싹채소의 재배 및 수확시기에 따른 높은 미생물 오 염 가능성을 줄이고자 LED 광조사가 살균에 효과가 있 는지 조사하였다. 총 세균은 모든 처리구가 높게 나타났 으며, 대장균인 E.coli는 QD-LED가 다른 처리구에 비해 가장 낮았다. 총 곰팡이 수의 경우는 명조건에서 유의성 있는 가장 낮은 수치를 보였다(Fig. 3). 국내 신선 농산물 에 대한 미생물 허용기준은 정해진바 없으나, 비가열 조 리식품에 대한 미생물적 안전기준은 총 세균 6 logCFU·g-1, 대장균은 3 logCFU·g-1 이하로 보고된바 있 다(Solberg 등, 1990). 본 실험에서 QD-LED광에서 E. coli의 살균효과가 우수했던 것은 QD-LED에 포함되어 있는 적외선에 의한 것으로 판단되는데 Hamanaka 등 (2000)은 밀에 적외선을 조사하였을 때 bacterial count가 5.7×104 cfu·g-1 에서 0.73×103 cfu·g-1 로 감소하였다고 보 고하였다. Jung 등(2011)도 적외선은 중간 전달 매체 없 이 에너지를 전달하여 열손실 없이 피사체를 가열시키는 효과가 있어 고춧가루의 살균에도 효과적이었다고 하였 다. 곰팡이의 살균효과는 형광등에서 높았는데, 황누룩곰 팡이(Koji mold, Aspergillus oryzae)에 430, 550, 및 610nm 광을 이용하여 94.2mmol·m-2·s-1의 세기로 백색광 을 24시간 조사하였을 때, 암조건과 적색광 처리에 비해 현저히 낮은 포자수를 나타내었다는 보고가 있다 (Hatakeyama 등, 2007). 그러나 곰팡이는 비가열 조리식 품에 대한 미생물적 안전기준은 없다. 본 연구에서는 광 처리 조건은 일반적인 싹채소 생산에 적용되는 낮은 광 도라 24시간의 짧은 기간 동안 진행되었기 때문에 광처 리의 효과가 눈에 띄게 나타나지 않았다. 따라서 다양한 광도와 기간에서 추가 연구가 진행되어야 할 것이라 판 단된다.
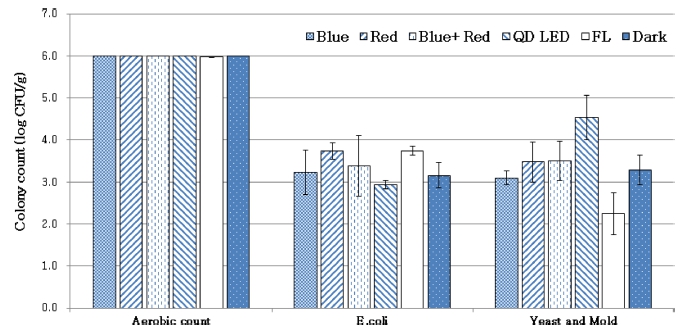
Fig. 3
The total aerobic colony count, E.coli, and yeast and mold of red radish sprout after 24 hours of light irradiation.Vetical bars represent ± SD (n = 4).
사 사
본 연구는 농림축산식품부의 재원으로 농림식품기술기 획평가원의 첨단생산기술개발사업(116111-03)과 2017년 도 강원대학교 대학회계 학술연구조성비(520170198)로 수행하였음.
References
Arias, J.P., K. Zapata, B. Rojano, and M. Arias. 2016. Effect of light wavelength on cell growth, content of phenolic compounds and antioxidant activity in cell suspension cultures of
Thevetia peruviana. J Photochem Photobiol B Biol. 163:87-91. 10.1016/j.jphotobiol.2016.08.01427541569
Buschmann, C. 2007. Variability and application of the chlorophyll fluorescence emission ratio red/far-red of leaves. Photosynth. Res. 92:261-271. 10.1007/s11120-007-9187-817525834
Casal, J.J. 2013. Photoreceptor signaling networks in plant responses to shade. Annu. Rev. Plant Biol. 64:403-427. 10.1146/annurev-arplant-050312-12022123373700
Cho, J.Y., D.M. Son, J.M. Kim, B.S. Seo, S.Y. Yang, B.W. Kim, and B.G. Heo. 2008. Effects of various LEDs on the seed germination, growth and physiological activities of rape (
Brassica napus) sprout vegetable. Korean J. Plant Res. 21(4):304-309.
Fuleki, T. and F.J. Francis. 1968. Quantitative methods for anthocyanins. 1. Extraction and determination of total anthocyanin in cranberries. J. Food Sci. 33:72-77. 10.1111/j.1365-2621.1968.tb00887.x
Giliberto, L., G. Perrotta, P. Pallara, J.L. Weller, P.D. Fraser, P.M. Bramley, A. Fiore, M. Tavazza, and G. Giuliano. 2005. Manipulation of the blue light photoreceptor cryptochrome 2 in tomato affects vegetative development, flowering time, and fruit antioxidant content. Plant Physiol. 137:199-208. 10.1104/pp.104.05198715618424PMC548851
Ha, J.O., T.M. Ha, J.J. Lee, A.R. Kim, and M.Y. Lee. 2009. Chemical components and physiological functionalities of
Brassica campestris ssp
rapa sprouts. J Korean Soc Food Sci Nutr. 38(10):1302-1309. 10.3746/jkfn.2009.38.10.1302
Hamanaka, D., S. Dokan, E. Yasunaga, S. Kuroki, T. Uchino, and K. Akimoto. 2000. The sterilization effects of infrared ray on the agricultural products spoilage microorganisms. 2000 ASAE Annual International Meeting, Technical Papers: Engineering Solutions for a New Century. 2:971-979.
Han, S.J., I.L. Choi, J.Y. Kim, Y.G. Shin, and H.M. Kang. 2018. Effect of LED and quantum dot (QD-LED) irradiation on the growth and leaf color of red romaine. Hortic. Sci. Technol. 36:78(Abstr.).
Hatakeyama, R., T. Nakahama, Y. Higuchi, and K. Kitamoto, 2007. Light represses conidiation in koji mold
Aspergillus oryzae. Bioscience, Biotechnology, and Biochemistry. 71(8):1844-1849. 10.1271/bbb.6071317690479
Hirner, A.A., S. Veit, and H.U. Seitz. 2001. Regulation of anthocyanin biosynthesis in UV-A-irradiated cell cultures of carrot and in organs of intact carrot plants. Plant Sci. 161:315-322. 10.1016/S0168-9452(01)00408-3
Islam, M.Z., Y.T. Lee, A.M. Mahmuda, I.L. Choi, and H.M. Kang. 2019. The effect of phosphorus and root zone temperature on anthocyanin of red romaine lettuce. Agronomy 2019. 9(2):1-12. 10.3390/agronomy9020047
Jeon, K.S., K.S. Song, C.H. Kim, J.H. Yoon, and J.J. Kim. 2013. Effects of seed pre-treatment and germination environments on germination characteristics of
Ligularia fischeri seeds. Protected Horticulture and Plant Factory. 22(3):262-269. 10.12791/KSBEC.2013.22.3.262
Jing, P., L.H. Song, S.Q. Shen., S.J. Zhao, J. Pang, and B.J. Qian. 2014. Characterization of phytochemicals and antioxidant activities of red radish brines during lactic acid fermentation. Molecules. 19:9675-9688. 10.3390/molecules1907967525004074PMC6271779
Jo, J.S. and J.G. Lee. 2018. Evaluation of individual glucosinolates, phytochemical contents, and antioxidant activities under various red to far-red light ratios in three
Brassica sprouts. Protected Horticulture and Plant Factory. 27(4):415-423. 10.12791/KSBEC.2018.27.4.415
Johkan, M., K. Shoji, F. Goto, S. Hashida, and T. Yoshihara. 2010. Blue light-emitting diode light irradiation of seedling improves seedling quality and growth after transplanting in red leaf lettuce. HortScience. 45(12):1890-1814. 10.21273/HORTSCI.45.12.1809
Jun, S.Y., T.H. Kim, J.H. Kwon, and Y.K. Lee. 2009. Microbiological evaluation in situ of each process in seed sprouting. Korean J Food Preserv. 16:971-976.
Jun, S.Y., Y.H. Kim, J.M. Sung, J.W. Jeong, K.D. Moon, J.H. Kwon, and Y.K. Lee. 2010. Effects of seed decontamination treatments on germination of red radish seeds during presoaking. J Korean Soc Food Sci Nutr. 39(10):1528-1534. 10.3746/jkfn.2010.39.10.1528
Jun, S.Y. and Y.K. Lee. 2014. Effects of heat treatments on the microbial reduction and germination rates of red radish sprout seeds (
Raphanus sativus). Korean J Food Preserv. 21(4):544-548. 10.11002/kjfp.2014.21.4.544
Jung, J.J., E.J. Choi, Y.J. Lee, and S.T. Kang. 2011. Effects of infrared pasteurization on quality of red pepper powder. Korean J. Food Sci. Technol. 43(2):156-160. 10.9721/KJFST.2011.43.2.156
Kim, D.H., S.J. Kim, S.I. Jeong, C.J. Cheon, and S.Y. Kim. 2014. Antiadipogenic effects of red radish (
Raphanus sativus L.) sprout extract in 3T3-L1 preadipocytes. Journal of Life Science. 24(11):1224-1230. 10.5352/JLS.2014.24.11.1224
Kim, W.B., H.J. Jo, J.G. Lee, J.W. Choi, J.G. Kim, and M.H. Park. 2013. Baby leaves growth, minerals, phenol, and flavonoid content of
Brassica campestris L. according to LED red/blue light ratio. Kor. J. Hort. Sci. Technol. 31:60-61(Abstr.).
Konczak-Islam, I., M. Yoshinaga, M. Nakatani, N. Terahara, and O. Yamakawa. 2000. Establishment and characteristics of an anthocyanin-producing cell line from sweetpotato storage root. Plant Cell Rep. 19:472-477. 10.1007/s00299005075830754885
Lee, G.S., C.S. Choi, H.J. Lee, Y.A. Jang, and J.G. Lee. 2015. Effect of air temperature on growth and phytochemical content of beet and ssamchoo. Kor. J. Hort. Sci. Technol. 33(3):303-308. 10.7235/hort.2015.14061
Lee, H.S. and O.B. Kim. 1998. Effect of temperature and photoperiod on germination of
Raphanus sativus var.
acanthiformis. Institute of Basic Science Seowon University. The Bulletin of institute. 12:23-37.
Lee, J.G., S.S. Oh, S.H. Cha, Y.A. Jang, S.Y. Kim, Y.C. Um, and S.R. Cheong. 2010a. Effects of red/blue light ratio and short-term light quality conversion on growth and anthocyanin contents of baby leaf lettuce. J. Bio-Environ. Con. 19:351-359.
Lee, J.Y., J.H. Lee, G.Y. Ki, S.T Kim, T.H. Han. 2011. Improvement of seed germination in
Rosa rugosa. Kor. J. Hort. Sci. Technol. 29(4):352-357.
Lee, K.A., Y.A. Lee, and I.S. Park. 2009. Sanitation effect of sprouts by chlorine Water. Journal of Life Science. 19:751-755. 10.5352/JLS.2009.19.6.751
Lee, N.Y., M.J. Lee, Y.K. Kim, J.C. Park., H.K. Park, and J.S. Choi. 2010b. Effect of light emitting diode radiation on antioxidant activity of barley leaf. Journal of Korean Society for Applied Biological Chemistry. 53:658-690. 10.3839/jksabc.2010.104
Lee, S.O. and I.S. Lee. 2006. Induction of quinone reductase, the phase 2 anticarcinogenic marker enzyme, in hepa1c1c7 cells by radish sprouts,
Raphanus sativus L. J Food Sci. 71:144-148. 10.1111/j.1365-2621.2006.tb08917.x
Lee, S,Y. and J.P. Baek. 2013. Effects of temperature, light condition, and priming treatment on seed germination of
Bidens bipinnata L. Protected Horticulture and Plant Factory. 22(2):188-191. 10.12791/KSBEC.2013.22.2.188
Oboh, G. 2005. Effect of blanching on the antioxidant properties of some tropical green leafy vegetables. LWT. 38:513-517. 10.1016/j.lwt.2004.07.007
Que, F., L. Mao, C. Zhu, and G. Xie. 2006. Antioxidant properties of chinese yellow wine, its concentrate and volatiles. LWT-Food Sci Technol. 39:111-117. 10.1016/j.lwt.2005.01.001
Rice-Evans, C.A., N.J. Miller, and G. Paganga. 1997. Antioxidant properties of phenolic compounds. Trends Plant Sci. 2:152-159. 10.1016/S1360-1385(97)01018-2
Solberg, M., J.J. Buckalew, C.C. Chen, D.W. Schaffner, K. O'Neil, J. Mcdowell, L.S. Post, and M. Boderck. 1990. Microbiological safety assurance system for foodservice facilities. Food Technol. 44(12):68-73.
Wang, Y., B. Zhou, M. Sun, Y. Li, and S. Kawabata. 2012. UV-A light induces anthocyanin biosynthesis in a manner distinct from synergistic blue + UV-B light and UV-A/blue light responses in different parts of the hypocotyls in turnip seedlings. Plant Cell Physiol. 53:1470-1480. 10.1093/pcp/pcs08822706033
Yi, K.A. 1997. Regulation of ascorbate peroxidase activity by a catalase inhibitor, 3-amino-1,2,4-triazole in dark geminating radish cotyledons. Graduate school, Kangwon national university. 10.1007/BF03030461
Yoo, J.H., E.S. Seong, J.G. Lee, C.J. Kim, J.H. Choi, G.H. Lee, I.S. Hwang, E.B. Hwang, J.D. Lim, Y.S. Ahn, C.B. Park, and C.Y. Yu. 2013. Comparison of the characteristics of seed germination and the first stage of growth in
Cynanchum wilfordii (Maxim.) by different light conditions. Korean J. Medicinal Crop Sci. 21(5):329-333. 10.7783/KJMCS.2013.21.5.329
Yorio, N.C., G.D. Goins, H.R. Kagie, R.M. Wheeler, and J.C. Sager. 2001. Improving spinach, radish, and lettuce growth under red light-emitting diodes (LEDs) with blue light supplementation. HortScience. 36:380-383. 10.21273/HORTSCI.36.2.38012542027
Zhang Q, J. Zhang, J. Shen, A. Silva, D.A. Dennis, and J.C. Barrow. 2006. A simple 96-well microplate method for estimation of total polyphenol content in seaweeds. J Appl Phycol. 18:445-450. 10.1007/s10811-006-9048-4