서 론
재료 및 방법
1. 실험 재료 및 처리
2. ABA 대사체 분석
3. 탄수화물 대사체 분석
4. Glucosinolate 대사체 분석
5. 통계 분석
결과 및 고찰
1. ABA 대사체 함량 비교
2. 탄수화물 대사체 함량 비교
3. Glucosinolate 대사체 함량 비교
4. 다변량 상관 분석
결 론
서 론
배추는 김치의 주재료이며 한국에서 널리 재배되는 엽채류이다. 배추는 호냉성 채소로 정의되며(Opena와 Lo, 1979), 생육 최적 온도는 18-20°C 범위이고, 생육 최저 한계 온도는 4-5°C이다. 2020년 기준에 따르면, 배추의 전체 재배 면적은 30,949 ha, 생산량은 약 2,242천 톤이며, 10a 당 생산량은 7,442 kg이었다(KOSIS, 2022). 배추의 생산시기는 전체 생산량 중 가을 재배가 44.8%로 가장 많았고, 봄재배 18.8%, 고랭지재배 16.3%, 겨울재배는 13.6% 정도였다(KOSIS, 2022). 특히 봄배추의 경우에는 육묘기가 저온기에 해당하므로 저온에 의한 화아 분화 위험성이 높고 정식 후에도 고온 장일 조건에서 추대가 촉진되어 생육이나 품질 저하 등의 문제가 발생할 수 있다(Lee 등, 2011).
저온 스트레스 시 생물자극제 처리는 일반적으로 저온 보호 물질로 이어지는 생합성 경로를 자극하여 삼투 분자의 축적을 증가시키며, 막 안정성을 증가시켜 저온 피해를 줄이는 기능을 한다(Bulgari 등, 2019). 글루탐산은 식물의 성장과 발달에 중요한 역할을 하는 필수 아미노산의 전구체이며, proline, γ-aminobutyric acid(GABA), glutathione 등과 같은 항산화제로 전환된다(Qiu 등, 2020). 글루탐산의 처리는 비생물적 스트레스 조건에서 배추의 생장과 수확량을 유지하기 위한 재배적으로 적용가능한 화학적 처리 방법으로, 저온 스트레스 시 광합성 조절과 항산화효소 활성을 증가시켜 저온으로 인한 생리학적 손상을 완화시킬 수 있었다(Lee 등, 2017). 또한, 다양한 작물에서 삼투압, 염분, 질소 결핍 및 저온 스트레스를 줄이는데 효과적인 것으로 밝혀졌다(Sadak과 Abdelhamid, 2015; Lei 등, 2017; Kan 등, 2017).
Abscisic acid(ABA)는 종자 휴면, 발아, 노화 및 환경에 대한 스트레스 내성과 관련하여 식물의 다양한 생장 단계를 조절한다. 따라서, 스트레스 호르몬으로서 ABA는 비생물적 스트레스에 대한 내성 및 방어 반응 역할을 한다(Lee와 Luan, 2012; Wilkinson과 Davies, 2010). ABA는 건조 및 고온 스트레스로 인한 피해를 줄이고(Zandalinas 등, 2016), 수분 부족을 줄임으로써 가뭄 내성을 높인다. 또한, ABA는 공변세포에서 당과 유기산의 대사 변화를 조절하기도 한다(Jin 등, 2013). 상승된 ABA 함량을 줄이는 것은 ABA 이화작용과 비활성화라는 두 가지 경로를 통해 가능하다. 더 높은 ABA 함량은 주요 이화 경로를 활성화하여 8'-hydroxy-ABA를 형성하고, 이는 phaseic acid(PA)로 전환된 다음 dihydrophaseic acid(DPA)으로 전환된다(Kushiro 등, 2004). ABA 비활성화는 비활성 ABA-glucose ester(ABA-GE)가 형성되는 경로를 통해 나타난다(Xu 등, 2002). PA는 옥수수와 보리에서 기공 폐쇄를 유도하는 경우도 있다(Sharkey와 Raschke, 1980). ABA는 sucrose 수송체, sucrose 합성 및 invertase 유전자의 발현을 변경하여 sucrose 대사를 조절할 수 있다(Rezaul 등, 2019). 예를 들어, 쌀에서 이 과정은 꽃가루 발달 단계 시 작은 이삭에서 ATP 형성을 유지한다(Islam 등, 2018). 또한, ABA로 전처리 된 쌀은 처리되지 않은 쌀에서 발견되는 것보다 더 높은 수준의 전분, 가용성 당 및 비구조 탄수화물을 나타낸다(Robertson 등, 1994).
Glucosinolate는 2차 대사산물로 배추과 작물에 풍부하게 있다. Glucosinolate 함량은 환경 조건(del Carmen Martínez-Ballesta 등, 2013)과 식물의 생장 단계(Hong과 Kim, 2014)에 영향을 받는다. 또한, 비생물적 스트레스는 다음과 같은 다양한 메커니즘에 따라 식물의 glucosinolate 프로파일을 변경할 수 있다. 생합성의 사슬 연장 단계는 환경 스트레스의 영향을 받는다. 스트레스 인식은 세포질에서 2차 메신저의 합성을 향상시켜 액포에서 세포질로 glucosinolate를 방출한다. Myrosinase 활성은 식물의 내성을 촉진하는 분자인 isothiocyanate를 생성하게 된다(Ishida 등, 2014). Glucosinolate의 생합성 경로는 애기장대에 의해 거의 대부분 설명되었다.
글루탐산의 엽면 처리와 저온이 배추의 호르몬 및 2차 대사산물의 함량에 미치는 영향에 대한 연구가 미흡하다. 이 연구에서 글루탐산의 엽면 처리가 생육 초기 배추에 저온 스트레스 내성에 기여할 것이라고 가설로 생각하였다. 따라서, 이 연구의 목적은 글루탐산의 엽면 처리와 함께 이상 저온 온도 조건에서 배추의 ABA, 탄수화물 및 glucosinolate 대사체의 변화를 프로파일 하는 것이었다. 그리고 저온 스트레스 내성은 스트레스 호르몬, 1차 및 2차 대사산물의 함량을 나타내는 지표로서, ABA, 탄수화물 및 glucosinolate의 함량을 각각 분석하여 평가하였다.
재료 및 방법
1. 실험 재료 및 처리
2021년 3월 26일 한국 완주에 위치한 국립원예특작과학원 노지(35°83′N, 127°03′E)에 상업용 상토와 일반 흙을 채운 625L 플라스틱 상자에 배추(Brassica rapa L. subsp. pekinensis (Lour.) Hanelt ‘춘광’, Sakata Seed Co., Korea)를 정식하였다. 실험의 처리는 3가지 주/야간 온도 수준, 즉 11/-1°C(Extremely low; E), 16/4°C(Moderately low; M) 및 21/9°C(Optimal; O) 및 2가지 글루탐산 엽면 처리 농도 수준, 즉 0(Glu 0) 및 10-mg·L-1(Glu 10)이었다. 온도 처리는 주/야간 각각 12/12시간 동안 수행하였고, 4735 × 4625 × 3860mm(각각 길이, 너비 및 높이; Modified CEEWS model, Environmental Growth Chambers, Chagrin Falls, OH, USA) 규격의 이상기상 생장상에서 4일 동안 처리하였다. 글루탐산 엽면 처리는 온도처리 직전 정식 후 10일에 1회 배추의 엽면이 충분히 적실 수 있도록 처리하였다. 온도와 글루탐산 처리를 제외한 다른 환경조건은 실험 동안 동일하였다. 식물은 온도 처리 기간을 제외하고 노지에서 재배되었다. 분석 시료는 각각 2일 및 4일 후 수집되었고 부위는 지상부 녹색 부분을 수집했다. 잎을 액체 질소에 바로 동결 후 동결 건조하고 액체 질소에서 막자사발을 사용하여 미세 분말로 마쇄한 다음 ABA, 탄수화물 및 glucosinolate 대사체 함량을 분석할 때까지 -40°C로 유지하였다.
2. ABA 대사체 분석
ABA 대사체 추출 절차는 Ordaz-Ortiz 등 (2015)에 의해 개발된 방법을 수정하여 수행하였다. (+)-ABA는 Sigma-Aldrich (Dorset, UK)에서 구매하였고, 나머지 ABA 대사체((-)-DPA, (+)-ABA-GE, (-)-PA 및 (±)-7′-OH-ABA) 및 내부 표준 물질([2H3]-DPA (-)-7′,7′,7′-d3-DPA; [2H5]-ABA-GE (+)-4,5, 8′,8′,8′-d5-ABA-GE; [2H3]-PA (-)-7′,7′,7′-d3-PA; [2H4]-7’-hydroxy-ABA(±)-5, 8′,8′,8′-d4-7′-OH-ABA; [2H6] -ABA (±)-3′,5′,5′,7′,7′,7′-d6-ABA)은 National Research Council of Canada-Plant Biotechnology Institute에서 구매하였다. 동결 건조된 배추 시료(50mg)는 methanol/water/formic acid(75:20:5, v/v/v)을 함유한 추출 용매 5mL를 첨가한 후 4°C에서 sonification을 사용하여 5분간 진탕하였다. 400ng·mL-1 농도의 내부 표준 물질(5가지 중수소화 표지된 화합물) 75µL를 추출물에 첨가한 후 혼합물을 4℃의 암조건에서 shaking incubator를 사용하여 2시간 동안 추출하였다. 추출 후 1,960 × g로 10분간 원심분리한 후 상층액을 15mL 튜브로 옮기고 -105°C의 암조건에서 24시간 동안 동결 건조하였다. 잔여물은 water/acetonitrile/formic acid(90.0:9.9:0.1, v/v/v)을 함유한 재용해 용매 400µL를 첨가한 후 10분 동안 원심분리(1960 × g, 4°C)하였다. 상층액을 0.2-µm PTFE 필터를 통해 여과하고 insert가 있는 vial로 옮겼다. 전체 추출물은 UPLC-MS system에 주입하여 내인성 ABA 대사체를 정량화 하였다. ABA 대사체 분석에는 5개의 표준물질을 사용하였다; ABA, phaseic acid(PA), dihydrophaseic acid(DPA), ABA-glucose ester(ABA-GE) 및 7’-hydroxy-ABA. 모든 실험 절차는 ABA 대사체가 빛에 민감하기 때문에 어두운 조건에서 수행되었다.
질량 분석은 PDA 검출기가 장착된 Acquity UPLC I-Class system(Waters Co., Milford, MA, USA)에 연결된 Xevo G2-XS Qtof MS 질량분석기(Waters Co.)에서 분석하였다. 모든 대사체는 Q-tof-MS scan mode의 negative mode에서 분석되었고, cone voltage는 10-40V으로 하였다. 시료 10µL를 Acquity UPLC HSS T3 column(1.8µm; 2.1 × 50 mm; Waters Co.)에 주입하여 분석하였다. UPLC 분석 조건으로 이동상 A는 0.1% formic acid를 포함한 water, 이동상 B는 0.1% formic acid를 포함한 acetonitrile를 사용하였으며, 이동상의 속도는 0.35mL·min-1, 컬럼 온도는 30°C를 유지하였다.
3. 탄수화물 대사체 분석
표준물질로 사용된 sucrose, D-(+)-glucose, D-(-)-fructose, 1-kestose 및 nystose는 Sigma-Aldrich에서 구매하였다. 동결 건조된 배추 시료(50mg)는 62.5% methanol 2mL를 첨가한 후 55°C에서 shaking water bath를 사용하여 15분 동안 추출하였다. 추출물을 16,000 × g에서 10분 동안 원심분리한 후 상층액을 0.2µm PTFE 필터를 통해 여과하였다. 분석 전에 1:5로 희석하여 vial로 옮겼다. 시료 20µL를 880nm로 설정된 RI 검출기가 장착된 Alliance HPLC system(Waters Co.)에 주입하여 분석하였다. 탄수화물 대사체는 Sugar-Pak I column(6.5 × 300 mm; Waters Co.)을 사용하여 분리되었다. 이동상은 0.01M Ca-EDTA를 사용하였고, 이동상의 속도는 0.5mL·min-1, column 온도는 90°C를 유지하였다.
4. Glucosinolate 대사체 분석
19개의 glucosinolate 표준물질은 Cfm Oskar Co. (Marktredwitz, DE)에서 구매하였다; glucoiberin, glucolepidiin (GLP), progoitrin, epiprogoitrin, glucoraphanin, glucoraphanin, sinigrin, gluconapin, sinalbin, glucomoringin, glucobarbarin, glucotropaeolin, glucobrassicanapin(GBN), glucoerucin, glucobrassicin(GBS), 4-hydroxyglucobrassicin, 4-methoxyglucobrassicin(4MGBS), neoglucobrassicin(GNBS), and glucobasturtiin(GNS). Bhandari 등 (2015)에 의한 분석법에 따라 glucosinolate를 추출하고 탈황화 시켰다. Endomyrosinase를 비활성화 시키기 위해, 동결 건조된 배추 시료(50mg)는 75% methanol을 첨가한 후 75°C에서 shaking water bath를 사용하여 2번 반복하여 추출하였다. 추출물을 12,000 × g, 4°C에서 5분간 원심분리한 후 상층액을 2mL tube에 옮겼다. 2번 반복 추출 후에 얻어진 상층액을 합하여 crude glucosinolate로 간주하였다. 이 혼합물을 0.7mL의 diethylaminoethyl-Sephadex A-25(Sigma-Aldrich, St. Louis, MO, USA)가 채워진 Mini Bio-Spin Chromatography Column (Bio-Rad Laboratories, Hercules, CA, USA)에 적용하였다. Glucosinolate를 탈황화 시키기 위해 200µL sulfatase(EC 3.1.6.1, Helix pomatia H-1 type, Sigma-Aldrich)을 column에 첨가한 후 밀봉하여 상온에서 18시간 동안 처리하였다. Desulfo-glucosinolate를 0.5mL의 water로 3회 추출 후 0.2µm PTFE 필터로 여과하고 즉시 HPLC로 분석하였다.
Desulfo-glucosinolate는 229nm로 설정된 DA 검출기가 장착된 1260 HPLC system(Agilent Technologies, Santa Clara, CA, USA)에 주입하여 분석하였다. Guard column이 장착된 Acquity UPLC ⓇBEH-C18 column(1.7m; 2.1 × 100 mm; Waters Co.)을 사용하여 분리되었다. 이동상 A는 water, 이동상 B는 100% acetonitrile를 사용하였으며, 이동상은 0.2µL·min-1, column 온도는 30℃를 유지하였다.
5. 통계 분석
난괴법 3반복으로 박스에서 임의로 각 3주에서 분석 시료를 수집하여 분석한 후 SAS 프로그램(SAS 9.4, SAS Institute Inc., NC, USA)을 이용하여 분산분석을 수행하였고, 평균 간의 비교는 최소유의차 검정을 이용하였다. 온도와 글루탐산 엽면 처리에 따른 ABA, 탄수화물, glucosinolate 대사체 간의 상관분석은 R 프로그램(RStudio 3.6.3, RStudio Inc., MA, USA)을 이용하여 구하였다.
결과 및 고찰
1. ABA 대사체 함량 비교
생육 초기 배추의 온도 및 글루탐산 엽면 처리에 따른 ABA 대사체의 함량을 비교하였다. 생육 초기 단계에서, 5개의 ABA 대사체 중 4개의 대사체가 검출되었다. 배추에서 대사체 함량은 온도와 글루탐산 엽면 처리에 따라 다양하였다(Fig. 1). 처리 2일 후, O 및 Glu 0 처리 후 ABA, DPA 및 ABA-GE 함량이 모든 처리 중에서 가장 높았고(각각 18.1, 635.0 및 17.1ng·g-1 dry weight), E 및 Glu 10 처리 후 PA 함량이 모든 처리 중에서 가장 높았다(602.3ng·g-1 dry weight). ABA, PA 및 ABA-GE 함량은 E 처리에서 Glu 0 처리보다 Glu 10 처리에서 함량이 더 높았다. 이는 글루탐산의 엽면시비 효과인 것으로 판단된다. 처리 4일 후, ABA, PA, DPA 및 ABA-GE 함량은 M 처리에서 Glu 0 처리보다 Glu 10 처리에서 함량이 더 높았다. 또한, ABA 함량은 처리 2일 후보다 4일 후에 모든 처리구에서 증가하였다. 하지만, M 및 O 처리에서 급격한 증가를 보였다. 신호 전달제로서 ABA는 기공을 조절하고 수분 손실을 감소시켜 저온 스트레스에 대한 내성을 향상시킬 수 있었다(Bharath 등, 2021). Oliver 등 (2007)은 저온 스트레스가 쌀에 내인성 ABA 축적을 증가시킨다고 보고하였다. 또 다른 연구에서는 보리 지엽에서 ABA, PA 및 DPA는 가뭄 스트레스 하에서 높은 농도로 나타났다(Seiler 등, 2011). 하지만, 본 연구의 저온 처리에 의해 대사체들의 뚜렷한 증가를 보이지는 않았다. 특히, PA 함량은 처리 2일 후보다 4일 후에 E 및 Glu 10 처리구에서 급격하게 감소한 반면, DPA 함량은 그 처리구에서 현저하게 증가한 것을 확인하였다. 이는 E 및 Glu 10 처리구에서 PA가 DPA로 전환된 것으로 판단된다.
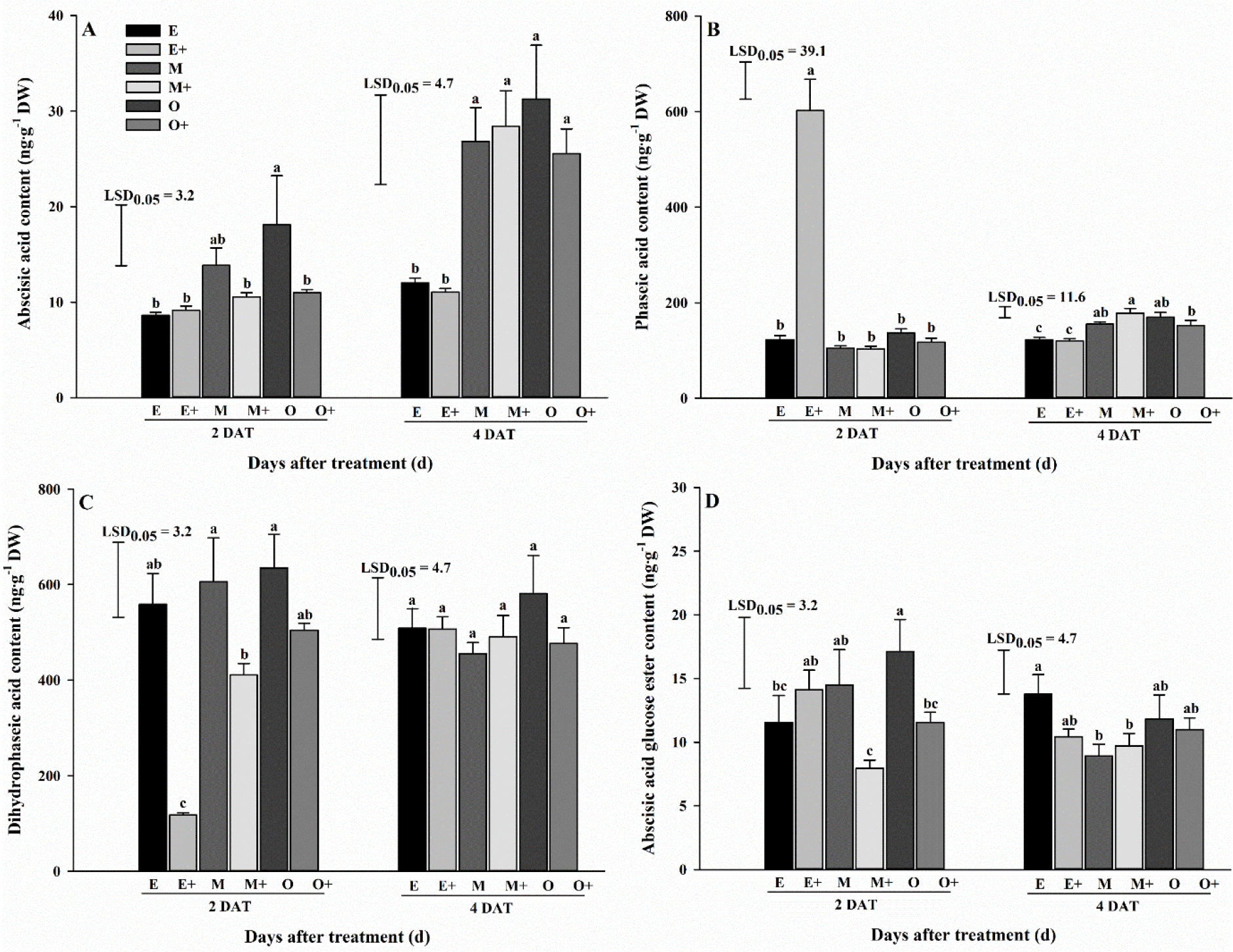
Fig. 1.
Comparison of abscisic acid metabolite contents of Kimchi cabbage following glutamic acid foliar application at two and four days after commencing extreme temperature treatment during early growth stage. Error bars represent standard error (n = 9). Mean separation within columns determined by least significant difference test. A, Abscisic acid content; B, Phaseic acid content; C, Dihydrophaseic acid content; D, Abscisic acid glucose ester content. E, Extremely low + Glutamic acid 0 mg·L-1; E+, Extremely low + Glutamic acid 10 mg·L-1; M, Moderately low + Glutamic acid 0 mg·L-1; M+, Moderately low + Glutamic acid 10·mg L-1; O, Optimal + Glutamic acid 0 mg·L-1; O+, Optimal + Glutamic acid 10 mg·L-1; DAT, Days after treatment; DW, Dry weight.
2. 탄수화물 대사체 함량 비교
HPLC 분석은 생육 초기 배추에서 2가지 탄수화물, 즉 glucose와 fructose는 검출되었지만, sucrose, nystose및 kestose는 검출되지 않았다. 탄수화물 대사체의 함량은 온도 및 글루탐산 엽면 처리에 따라 변화하였다(Fig. 2). 처리 2일 후, glucose 및 fructose 함량은 O 및 Glu 0 처리에서 함량이 가장 높았고(51.2 및 110.7mg·100g-1 dry weight), E 처리에서는 Glu 0 처리보다 Glu 10 처리에서 함량이 더 높았다. 처리 4일 후, glucose 함량은 E 및 Glu 10 처리에서 가장 높은 반면(52.1mg·100g-1 dry weight), fructose 함량은 처리 2일 후와 동일하게 O 및 Glu 0 처리에서 함량이 가장 높았다(134.6mg·100g-1 dry weight). 또한, glucose 함량은 E 및 M 처리에서 Glu 0 처리보다 Glu 10 처리에서 함량이 더 높았다. Fructose 함량은 M 처리에서 Glu 0 처리보다 Glu 10 처리에서 함량이 더 높았다. Glucose 함량은 E 및 M 처리에서 처리 2일 후보다 처리 4일 후에 증가하였다. 다른 연구결과에 따르면, 애기장대는 5°C의 저온에 노출되었을 때, sucrose, glucose 및 fructose 함량이 증가하여 내성을 증가시킨다고 보고되었다(Maruyama 등, 2009; Weiszmann 등, 2018). 하지만, 우리의 결과는 glucose 함량은 처리구간 유의한 차이가 없었고, fructose 함량은 O 처리에서 함량이 높았다. 스트레스 기간 동안 식물은 glucose 대신 전분과 fructan을 에너지원으로 사용한다고 보고되었고(Kaplan과 Guy, 2004), 이로 인해 fructose를 E 및 M 처리에서 사용한 것으로 판단된다.
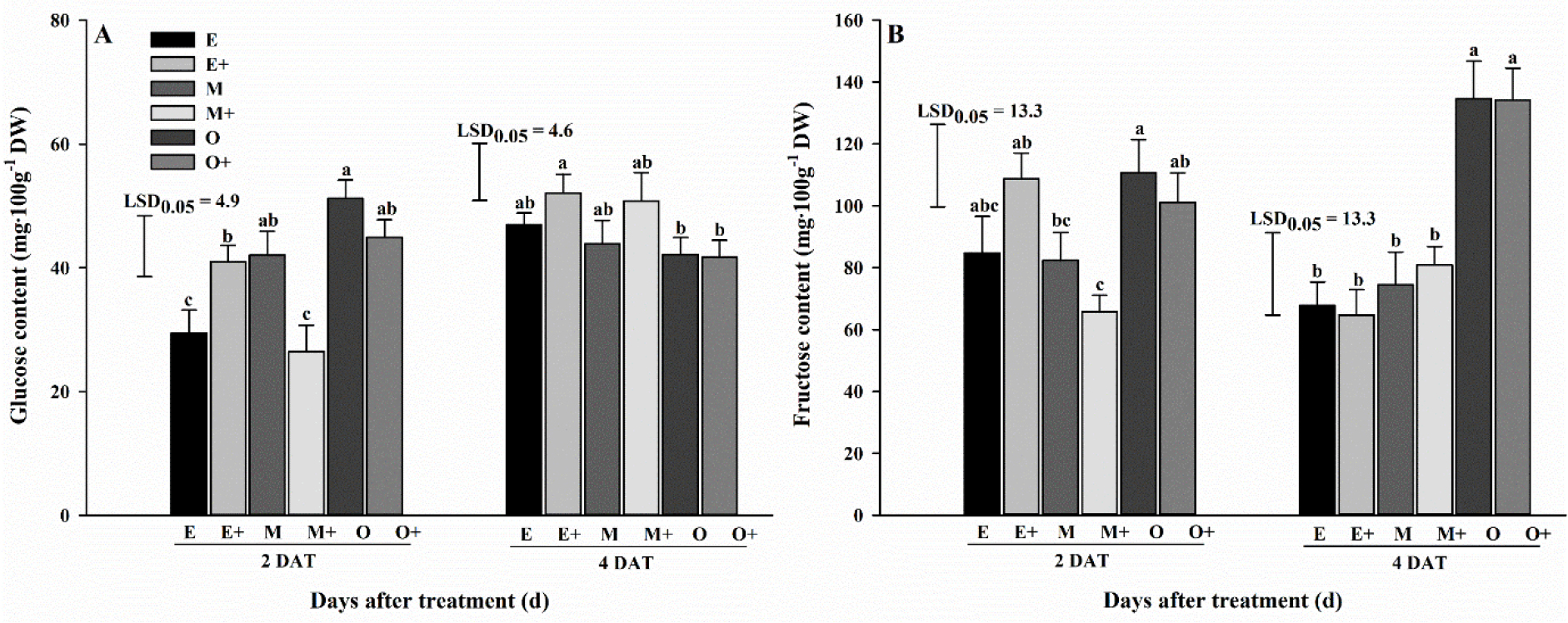
Fig. 2.
Comparison of carbohydrate metabolite contents of Kimchi cabbage following glutamic acid foliar application at two and four days after commencing extreme temperature treatment during early growth stage. Error bars represent standard error (n = 9). Mean separation within columns determined by least significant difference test. A, Glucose content; B, Fructose content. E, Extremely low + Glutamic acid 0 mg·L-1; E+, Extremely low + Glutamic acid 10 mg·L-1; M, Moderately low + Glutamic acid 0 mg·L-1; M+, Moderately low + Glutamic acid 10·mg L-1; O, Optimal + Glutamic acid 0 mg·L-1; O+, Optimal + Glutamic acid 10 mg·L-1; DAT, Days after treatment; DW, Dry weight.
3. Glucosinolate 대사체 함량 비교
HPLC 분석은 생육 초기 배추에서 19개의 glucosinolate 중에서 GLP, GBN, GBS, 4MGBS, GNBS 및 GNS를 포함한 6개의 glucosinolate가 검출되었다. Glucosinolate 함량은 온도 및 글루탐산 엽면 처리에 따라 다양하였다(Tables 1 and 2). 처리 2일 후(Table 1), GLP 및 GNS 함량은 O 및 Glu 10 처리에서 모든 처리 중에서 가장 높았다(0.94 및 0.90µmol·g-1 dry weight). GBN, GBS, 4MGBS 및 GNBS 함량은 O 및 Glu 0 처리에서 모든 처리 중에서 가장 높았다(0.52, 1.31, 1.71 및 4.82µmol·g-1 dry weight). 4MGBS 함량은 E 처리에서, GNBS 함량은 M 처리에서 Glu 0 보다 Glu 10 처리에서 함량이 더 높았다. 처리 4일 후(Table 2), GLP, GBS, 4MGBS, GNBS 및 GNS 함량은 E 및 Glu 10 처리에서 모든 처리 중 가장 높았다(0.72, 2.05, 1.67, 9.40 및 0.85µmol·g-1 dry weight). GBN 함량은 M 및 Glu 0 처리에서 모든 처리 중 가장 높았다(0.74µmol·g-1 dry weight). GLP, GBS, 4MGBS 및 GNS 함량은 E 처리에서 Glu 0 보다 Glu 10 처리에서 함량이 더 높았고, GNBS 함량은 E 및 M 처리에서 Glu 0 보다 Glu 10 처리에서 함량이 더 높았다. Ljubej 등(2021a)의 연구에 따르면, 케일은 저온 처리(8°C, 7일) 시 대조구(21°C, 7일) 보다 total glucosinolate 함량은 유의하게 높고, indole glucosinolate 함량은 변화가 없으며, aliphatic glucosinolate 함량은 높아졌다고 보고하였다. 24시간 동안 8°C 조건을 처리한 케일은 total glucosinolate 함량이 증가하였다는 유사한 연구결과도 있었다(Ljubej 등, 2021b). 또한, 브로콜리에서는 낮은 온도(0°C)에서 aliphatic 및 indole glucosinolate 함량이 모두 감소하였고, 이는 저온 처리 결과로 세포파괴 동안 glucosinolate 가수 분해 및 분해 때문이라는 결과도 보고되었다(Sarıkamış과 Çakır, 2016). 우리의 결과는 GBN 및 GBS 함량은 처리 2일 후보다 4일 후에 모든 처리에서 증가하였고, 4MGBS 및 GNS 함량은 E 및 M 처리구에서 함량이 증가하였다. 따라서, 앞선 보고와 달리 aliphatic, indole 및 aromatic glucosinolate가 모두 저온 처리에 의해 증가하는 것을 확인하였다.
Table 1.
Comparison of glucosinolate contents of Kimchi cabbage following glutamic acid foliar application at two days after commencing exposure to increased temperatures during early growth stage.
| Temperature |
Glutamic acid concentration (mg·L-1) |
Aliphatic glucosinolate (µmol·g-1DW) |
Indole glucosinolate (µmol·g-1DW) |
Aromatic glucosinolate (µmol·g-1DW) | |||||
| GLP | GBN | GBS | 4MGBS | GNBS | GNS | ||||
|
Extremely low (11/-1°C) | 0 | 0.69 bcz | 0.45 ab | 1.19 a | 1.20 d | 2.80 abc | 0.48 c | ||
| 10 | 0.46 d | 0.34 b | 0.88 b | 1.23 cd | 2.25 c | 0.56 c | |||
|
Moderately low (16/4°C) | 0 | 0.78 b | 0.48 ab | 1.25 a | 1.43 bc | 4.40 abc | 0.61 c | ||
| 10 | 0.62 c | 0.46 ab | 1.19 a | 1.35 bcd | 4.54 ab | 0.62 bc | |||
|
Optimal (21/9°C) | 0 | 0.83 ab | 0.52 a | 1.31 a | 1.71 a | 4.82 a | 0.82 ab | ||
| 10 | 0.94 a | 0.47 ab | 1.17 ab | 1.50 ab | 2.51 bc | 0.90 a | |||
| Significancey | |||||||||
| Temperature (A) | *** | NS | NS | *** | * | *** | |||
| Glutamic acid concentration (B) | * | NS | * | NS | NS | NS | |||
| A × B | ** | NS | NS | NS | NS | NS | |||
Table 2.
Comparison of glucosinolate contents of Kimchi cabbage following glutamic acid foliar application at four days after commencing exposure to increased temperatures during early growth stage.
| Temperature |
Glutamic acid concentration (mg·L-1) |
Aliphatic glucosinolate (µmol·g-1DW) |
Indole glucosinolate (µmol·g-1DW) |
Aromatic glucosinolate (µmol·g-1DW) | |||||
| GLP | GBN | GBS | 4MGBS | GNBS | GNS | ||||
|
Extremely low (11/-1°C) | 0 | 0.67 abz | 0.58 b | 1.57 b | 1.26 c | 3.47 b | 0.54 c | ||
| 10 | 0.72 a | 0.53 b | 2.05 a | 1.67 a | 9.40 a | 0.85 a | |||
|
Moderately low (16/4°C) | 0 | 0.70 ab | 0.74 a | 1.69 ab | 1.54 ab | 3.47 b | 0.69 bc | ||
| 10 | 0.61 bc | 0.70 a | 1.65 ab | 1.37 bc | 4.56 b | 0.72 ab | |||
|
Optimal (21/9°C) | 0 | 0.55 c | 0.52 b | 1.37 b | 1.33 c | 3.50 b | 0.65 bc | ||
| 10 | 0.56 c | 0.56 b | 1.50 b | 1.36 bc | 2.91 b | 0.73 ab | |||
| Significancey | |||||||||
| Temperature (A) | *** | *** | * | NS | *** | NS | |||
| Glutamic acid concentration (B) | NS | NS | NS | NS | ** | ** | |||
| A × B | NS | NS | NS | *** | *** | * | |||
처리 2일 후(Table 1), GLP, 4MGBS 및 GNS는 온도에 대한 유의성이 있었고, 그 중 GNS는 온도와 글루탐산 엽면 처리에 대한 상호작용 효과가 있었다. 처리 4일 후(Table 2), GLP, GBN 및 GNBS는 온도에 대한 유의성이 있었고, GNBS 및 GNS는 글루탐산 엽면 시비에 대한 유의성이 있었다. 또한, 4MGBS 및 GNBS는 온도와 글루탐산 엽면 처리에 대한 상호작용 효과가 있었다.
4. 다변량 상관 분석
ABA, 탄수화물, glucosinolate 대사체에 대한 pearson 상관계수는 생육 초기 단계에서 온도와 글루탐산 엽면 처리에 의해 영향을 받았다(Figs. 3 and 4). 처리 2일 후(Fig. 3), E 및 Glu 10 처리에서 PA와 ABA-GE, glucose 및 fructose 함량 간 양의 상관관계가 있었다(각각 0.82, 0.71 및 0.94). Glu 10 처리에 대해 E 및 M 처리에서 glucose와 fructose 함량 간, GLP와 GBS 함량 간 각각 양의 상관관계가 있었다. 처리 4일 후(Fig. 4), 모든 처리에서 DPA와 ABA-GE 함량 간 양의 상관관계가 있었다. E 및 Glu 10 처리에서 fructose와 DPA 및 ABA-GE 함량 간 양의 상관관계가 있었다(각각 0.74 및 0.81).

Fig. 3.
Pearson correlation coefficient for analyzed components following glutamic acid foliar application two days after commencing extreme temperature during head formation stage. A, Extremely low + Glutamic acid 0 mg·L-1; B, Extremely low + Glutamic acid 10 mg·L-1; C, Moderately low + Glutamic acid 0 mg·L-1; D, Moderately low + Glutamic acid 10·mg L-1; E, Optimal + Glutamic acid 0 mg·L-1; F, Optimal + Glutamic acid 10 mg·L-1. *, **, and *** represent p < 0.05, p < 0.01, or p < 0.001, respectively. ABA, Abscisic acid; PA, Phaseic acid; DPA, Dihydrophaseic acid; ABA-GE; Abscisic acid glucose ester; GLP, Glucolepiddin; GBN, Glucobrassicanapin; GBS, Glucobrassicin; 4MGBS, 4-Methoxyglucobrassicin; GNS, Gluconasturtiin; GNBS, Neoglucobrassicin.
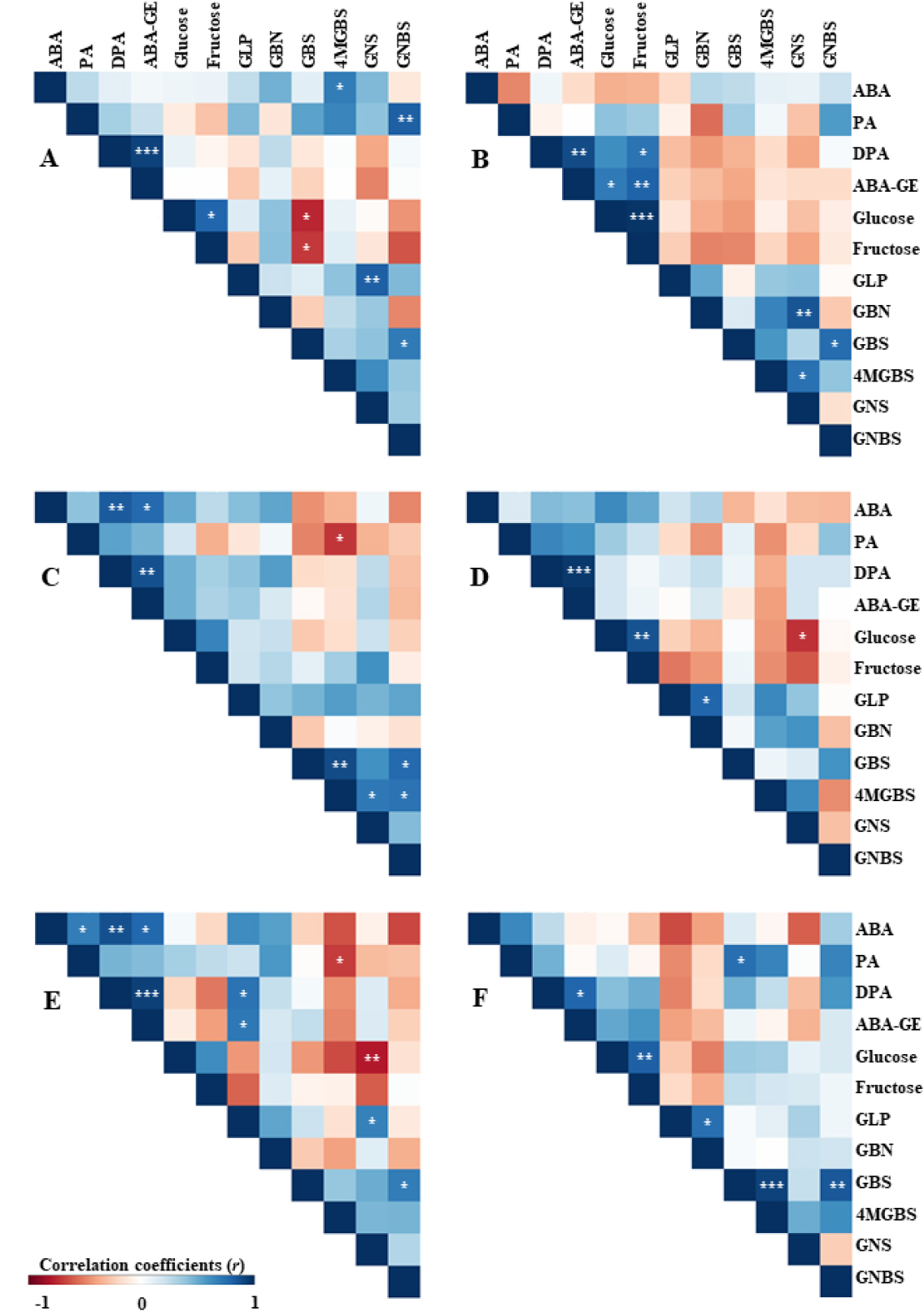
Fig. 4.
Pearson correlation coefficient for analyzed components following glutamic acid foliar application four days after commencing extreme temperature during head formation stage. A, Extremely low + Glutamic acid 0 mg·L-1; B, Extremely low + Glutamic acid 10 mg·L-1; C, Moderately low + Glutamic acid 0 mg·L-1; D, Moderately low + Glutamic acid 10·mg L-1; E, Optimal + Glutamic acid 0 mg·L-1; F, Optimal + Glutamic acid 10 mg·L-1. *, **, and *** represent p < 0.05, p < 0.01, or p < 0.001, respectively. ABA, Abscisic acid; PA, Phaseic acid; DPA, Dihydrophaseic acid; ABA-GE; Abscisic acid glucose ester; GLP, Glucolepiddin; GBN, Glucobrassicanapin; GBS, Glucobrassicin; 4MGBS, 4-Methoxyglucobrassicin; GNS, Gluconasturtiin; GNBS, Neoglucobrassicin.
결 론
온도 및 글루탐산 엽면 처리 2일 후 E 및 Glu 10 처리의 PA와 DPA함량에서 급격한 변화를 확인하였고, 몇몇 개별 glucosinolate 함량(GLP, GBS, 4MGBS, GNBS 및 GNS)은 저온과 글루탐산 처리에 따라 유의적 차이를 확인할 수 있었다. 또한, fructose는 glucose 대신 fructan을 에너지원으로 사용하였기 때문에 처리 4일후 E와 M처리에서 O 처리에 비하여 유의적으로 낮은 함량을 보였다. 이처럼 저온과 글루탐산 엽면 처리에 따른 PA, DPA, glucose, fructose 및 개별 glucosinolate 물질들의 변이를 확인하였지만, 저온과 글루탐산의 효과에 관한 명확한 상관관계를 평가할 수는 없었다. 배추과 작물은 호냉성 채소로서 저온에 민감하게 반응하지 않고, 대부분 내한성을 가지고 있기 때문으로 판단된다.




