서 론
발광다이오드(LED, light-emitting diode)는 형광등에 비해 수명이 길고, 전력소모량이 적어 시설내 공조비용 절감효과가 높고(Bula 등, 1991;Tennessen 등, 1994;Heo 등, 2002;Morrow, 2008) 열 발생이 적어 식물체에 근접 조명이 가능하다(Kozai, 2007). 특히 식물체 내 유 용 물질이나 색소 합성 조절 등의 기능을 수행할 수 있 다는 장점이 있다(Caldwell과 Britz, 2006;Heo 등, 2010). 적색광은 여러 작물들에서 초장, 근장, 생체중, 엽면적 등의 생장에 효과적이고(Johkan 등, 2010;Nishimura 등, 2007, 2009;Nishioka 등, 2008), 콩 모종 에서 엽면적, 베타 카로틴 및 항산화도를 증가시키는 것 으로 보고되었다(Wu 등, 2007). 청색광은 상추 지하부 및 잎 두께(Johkan 등, 2010), 오이잎의 루비스코(rubisco) 활성, 자당 및 전분 함량(Wang 등, 2009), 질소 및 엽록 소 함량과 기공전도도(Hogewoning 등, 2010;Savvides 등, 2012)를 증진시키는 것으로 보고되었다. 또한 청색광 은 제라늄 모종 초장을 억제시키는데(Appelgren, 1991) 이는 크립토크롬 색소와 관계가 있다고 하였다(Zhao 등, 2007). 이러한 특정 파장대의 광을 흡수하는 광 수용체 는 피토크롬(적색광 및 원적색광 파장 흡수), 크립토크롬 및 포토트로핀(청색광 및 근자외선 [UVA] 파장 흡수)이 있다고 알려져 있으며, 이들은 각 파장 자극을 인식하고 광 신호전달 기작에 의해서 개화, 굴광성, 기공 개폐 및 안 토시아닌 합성 등에 영향을 주게 되는데, 이런 현상을 광 형태형성(photomor-phogenesis) 반응이라고 한다(Carvalho 등, 2011;Sulivan과 Deng, 2003). 자외선(Ultraviolet radiation)은 파장에 따라 UVA(315-380nm), UVB (280- 315nm), 및 UVC(100-280nm) 영역으로 구분되는데 UVC 는 오존층에 의해 차단되어 지표면에 도달하는 자외선 95%가 UVA다(Kim과 Lee, 2016). 많은 선행 연구결과에 서 UVA광을 부가적으로 조사하였을 때 엽채류의 엽록소, 안토시아닌 및 아스코르브산 함량이 증가되는 것으로 보 고되었다(Basahi 등, 2014;Kim과 Lee, 2016;Lee와 Kim, 2014;Li와 Kubota, 2009;Tsormpatsidis 등, 2008).
시금치는 카로틴과 섬유소가 풍부하여 변비에 효능이 뛰어나고 엽록소가 다량 함유되어 항암 효과 및 동맥경 화를 예방하는 대표적인 알칼리성 채소로 알려져 있다 (Maeda 등, 2005). 질병관리본부의 국민건강영양조사 결 과에 의하면 시금치의 주요 영양소 급원 순위는 식이섬 유, 칼륨, 리보플라빈은 21위, 비타민 A는 11위, 비타민 C는 9위로 사과, 감, 배추김치, 오렌지, 딸기, 참외, 무, 고구마 다음으로 비타민 C의 주요 급원이다(KNHNES, 2017). 비타민 C함량은 채소 생장 조건에 따라 다를 수 있다고 하였다(Kim 등, 2010). 시금치는 신선한 상태로 섭취하므로 무엇보다도 위생적이고 청결해야 하므로 무 공해, 청정 신선채소를 선호하는 소비자의 요구와 부합 되기 위해 환경 친화형 수경재배 시스템으로 재배하는 것이 필요하다. 시금치의 수경재배에 대한 기존 연구는 수경재배에 의한 고랭지 시금치의 여름철 안정생산 기술 개발(Lee 등, 2011) 등이 있다. 본 연구는 LED 및 UVA 광원에 의한 시금치 식물공장 재배에서 시금치 생 육 및 아스코르브산 함량에 대해 구명하고자 하였다.
재료 및 방법
식물재배 및 재배환경
본 실험은 식물공장에서 2016년 12월 14일부터 2017 년 2월 5일까지 3회 반복 수행되었다. 동양계 시금치 수 시로 품종(Spinaci oleracea cv. Sushiro)(Asia Seed Co., Ltd. Seoul, Korea) 종자를 Ethanol(에탄올) 70% 용액, NaOCl(차아염소산나트륨) 1% 용액, 1차 증류수에 차례 로 세척 후 1차 증류수에 실온에서 24시간 침지하였다. 침지 처리된 종자를 여과지를 깔고 증류수 4 mL를 넣은 페트리디쉬 1개 당 종자 10개씩 파종하여 생육상 (20±2°C)에서 최아 시킨 후 버미큘라이트가 충진 된 72 구 육묘용 트레이에 이식하였다. 이식 후 식물공장의 형 광등(150μmol·m-2·s-1)(FL 20SD, City Lighting Co. Ltd. Incheon, Korea)이 설치된 재배벤치(온도 20°C, 습도 60%)에서 10일간 육묘하였다. 정식은 본엽 2~3매 나왔 을 때 NFT 수경재배기(45cm(L)×32cm(W)×23cm(H))에 EC 1.0dS·m-1, pH 6.0로 조정된 코넬대시금치배양액 (NP- K-Ca-Mg-S = 8.9-1.0-5.5-2.1-1.0-0me·L-1, Fe-EDTA 3.0, H3BO3 0.5, MnSO4·H2O 0.05, ZnSO4·7H2O 0.05, CuSO4·5H2O 0.02, Na2MoO4·2H2O 0.01 mg·L-1) 13L를 채운 뒤 각 재배기에 처리별 14주를 정식하였다. 배양액 pH는 주 2회 보정하였고 배양액은 1주일 간격으로 완전 교체하였다. 재배환경은 Watchdog 데이터로거(Watchdog 2450, Spectrum Technologies Inc., IL, USA)로 30분 간 격으로 저장하였다. 온도는 명기에 22±2°C, 암기에 18±2°C로, 상대습도는 60±10%로 유지되도록 냉·난방기 (CSV-Q075U, Carrier, Seoul, Korea) 및 가습기(Cairs, Woongjin, Seoul, Korea)를 이용하여 조절하였고, 광주기 는 16/8(명기/암기) 시간으로 하였고 탄산가스의 공급은 별도로 실시하지 않았다. 광강도는 LED조명 전원 공급 장치(SMPS, Switched Mode Power Supply, LRS-350- 36, Mean Well, New Taipei, Taiwan)로 광원으로부터 25cm 떨어진 식물체 상부 잎 표면에서의 평균 광합성유 효광양 자속(photosynthetic photon flux density, PPFD) 을 광합성유효광(PAR) 미터기(3415FSE, Spectrum Technologies Inc., IL, USA)을 이용하여 130μmol·m-2·s-1 으로 고정하였고, UVA 측정기(SKU420, SKYE, Powys, UK)로 평균 광 조사강도는 70mW·m-2로 조정하였다.
실험처리
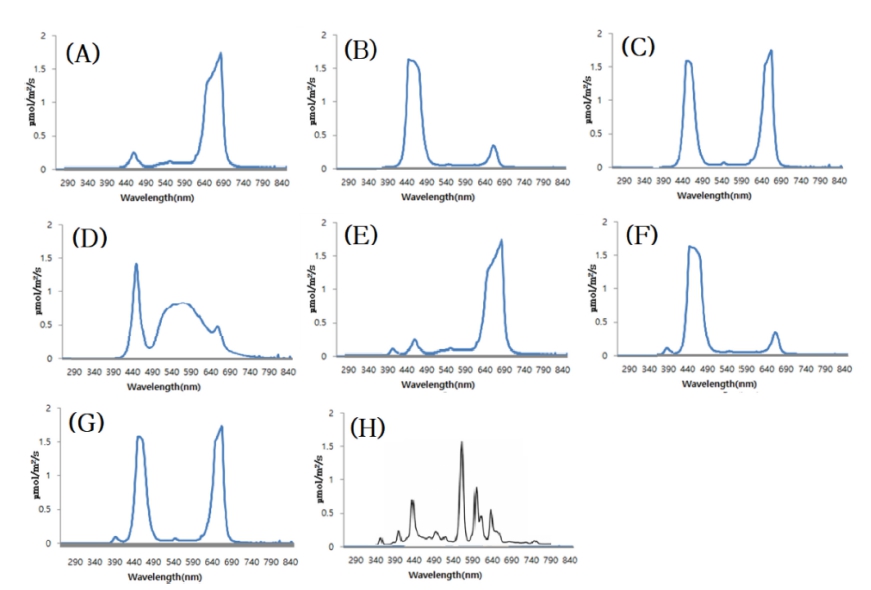
실험처리는 형광등(FL 20SD, City Lighting Co. Ltd. Incheon, Korea)을 대조구로 하여 LED 칩(ZVAS-02-03000, SungHyun HighTech, Co. Ltd., Kyunggido, Korea)의 개수 비율을 조합하여 적색광(R), 청색광(B), 적색과 청색의 혼 합광(2:1비율)(R:B), 백색광(W), 적색광+UVA(RUV), 청색 광+UVA(BUV), R:B(2:1)+UVA(RBUV) 총 8 종류로 제작 하여 광 조사 처리 하였다(Table 1). 실험에 사용된 UVA(SungHyun HighTech, Co. Ltd., Kyunggido, Korea)는 380~400nm 파장대를 포함하는 광을 사용하였다. 광 스펙 트럼 분포는 휴대형 분광 복사계(BLACK-Comet C-50, Stellarnet..Inc. Fl, USA)로 식물재배 위치에서 측정하여 광 스펙트럼의 강도로 표현하였다(Fig. 1)
조사 및 측정항목
생육조사는 정식 후 7, 14, 21, 28일에 엽장, 엽폭, 엽 병, 엽수, 엽면적, 뿌리길이, 지상부 및 지하부의 생체중, 건물중을 조사하였다. 엽면적은 간이 엽면적측정기(GA- 5, Leaf area meter, Kiya Seisakusho, Japan)를 이용하여 측정하였다. 지상부와 지하부로 구분된 시금치의 생체중 과 건물중은 전자저울(HS-4104, Hansung machine Inc, China)로 측정하였다. 건물중은 65°C 온도로 설정된 항 온건조기 (HB-504F-O, Hanback Science Inc, Korea)에 서 72시간 건조시킨 후 측정하였다. 상편생장지수(leaf epinasty index)는 재배 중 상편생장(leaf epinasty)을 보 인 처리구에 대하여 LW(엽폭)과 LD(수하된 잎 양쪽 선 단사이 거리)를 측정하여 계산하였다(leaf epinasty index = 1-0.5 × (LD/LW))(Fukuda, 등, 2008). 비엽중(specific leaf weight, SLW)은 엽면적당 건물중(mg)으로 표현하였 다. 엽형태는 엽장과 엽폭을 측정한 후 엽형지수(엽장/엽 폭)로 표현하였다.
아스코르브산 함량을 분석하고자 수확 한 시금치 잎 생체중 10g에 10% 메탄인산용액(Daejung Chemical & Metals Co., Siheung, Korea)을 넣고 마쇄기(IKA DI25, Wilmington, NC, USA)를 이용하여 마쇄 하였다(Korea Food and Drug Administration, 2008). 마쇄된 시료를 10% 메탄인산용액으로 50mL를 정용하여 0.45μm의 membrane filter로 여과한 후 HPLC(Ultimate 3000, Thermo Fisher Scientific, Sunnyvale, CA, USA)로 분석 하였다. 이때 C-18 column(inno C18 column 4.6*250, 5μm, Innopia, Anyang, Korea)을 사용하였고, UV검출기 파장 264nm, 이동상은 A: 0.05M (NH4)H2PO4, B: MeOH로 분석하였다. 0.8mL·min-1의 유속을 갖는 이동 상 A와 B의 gradient는 0-5min에서 각각 100, 0%이었 고, 8-13min에서는 각각 20, 80% 이었으며, 15-20min에 서는 100, 0%이었다.
결 과
정식 후 7일째 엽폭 및 엽수는 처리 간 유의차가 크 지 않았으나 엽장은 R 처리구에서 가장 길었고 RBUV 와 RB에서 유의적으로 가장 짧았다(Table 2). 엽장은 R 처리구에서 대조구인 형광등(FL)에 비해 약 48.9% 증가 되었고 RBUV와 RB 처리구는 각각 9.1, 12.33% 감소 되었다. 엽병길이는 R 처리구에서 다른 모든 처리구보다 가장 길었고 이는 FL 처리구에 비해 약 2배(88%) 긴 것으로 나타났다. 따라서 엽장을 엽폭으로 나눈 엽형지 수(leaf shape index)는 R 처리구에서 FL 처리구보다 73% 높았다. 정식 후 14일 째 측정된 엽장도 R 처리구 에서 다른 처리구에 비해 길었고 그 다음으로 RUV 처 리구에서 가장 길었다. RBUV, RB와 B 처리구에서 엽 장이 다른 처리에 비해 유의적으로 짧았다(Table 3). 엽 수는 RUV, BUV에서 다른 처리구에 비해 유의적으로 많 았다. 또한 RUV와 BUV 처리구가 R과 B 단독광 처리구 에 비해 각각 1개씩의 엽수가 증가되었다. 엽병길이는 R 처리구에서 대조구 형광등(FL)에 비해 2배 길었고, 그 다 음으로 BUV 처리구에서 길었다. 또한 RBUV와 B 처리 구에서 유의적으로 가장 짧았다. 정식 후 21일 째에 측 정된 엽장도 R 처리구에서 다른 처리구에 비해 길었고, 그 다음으로 BUV와 RUV 처리구가 뒤를 이었다. 또한 RBUV, RB와 B에서 엽장이 다른 처리에 비해 유의적으 로 짧았다(Table 4). 엽수는 BUV 처리구에서 다른 처리 구에 비해 유의적으로 많았고 B보다 BUV 처리구에서 엽수가 2개 더 많았다. 또한 다른 처리구에 비해 FL, W, B 처리구에서 엽수가 유의적으로 적었다. 엽병길이 는 R에서 유의적으로 가장 길었고 그 다음으로 BUV에 서 길었으며, RBUV에서 유의적으로 가장 짧았다. 정식 후 28일째에 엽장은 R 처리구에서 유의적으로 가장 길 었고 엽형지수도 가장 높았다. RBUV 처리구에서 엽장 이 가장 짧았다. 엽수는 BUV 처리구에서 가장 많아 B 처리구에 비해 BUV의 엽수가 8개 더 많았다. 엽병은 BUV와 R 처리구에서 가장 길었다(Table 5). 정식 후 28일 째에 측정된 지상부 생체중 및 건물중은 R, RUV 및 BUV 처리구에서 유의적으로 가장 높았고 W와 FL 처리구에서 유의적으로 낮았다(Table 6). R, RUV 및 BUV 처리구에서 지상부 건물중은 FL에서 재배된 시금 치보다 약 2.0배 높았다. 지하부 생체중은 BUV 처리구 에서 유의적으로 가장 높았고 다음으로 R에서 높았다. 지하부 생체중은 BUV처리구에서 FL에 비해 약 2배 증 가되었다. 엽면적은 BUV 처리구에서 유의적으로 가장 높았고 다음으로 R에서 높았다. 정식 28일째 수확된 시 금치의 아스코르브산 함량은 B 처리구에서 유의적으로 가장 높았고 그 다음으로 BUV에서 높았으며 대조구인 FL과 R 처리구에서 유의적으로 낮았다(Fig. 2). 아스코르 브산 평균 함량은 B 처리구에서 BUV 처리구 보다 약 16mg·L-1 높았고 R과 RUV 처리구는 유의차가 없었다.
Table 2. Leaf length and width, leaf number, and petiole length of Spinacia oleracea cv. Sushiro grown for 7 days after transplanting (DAT) under the different light-emitting diodes (LED) and ultraviolet radiation (UVA) light in plant factory system.
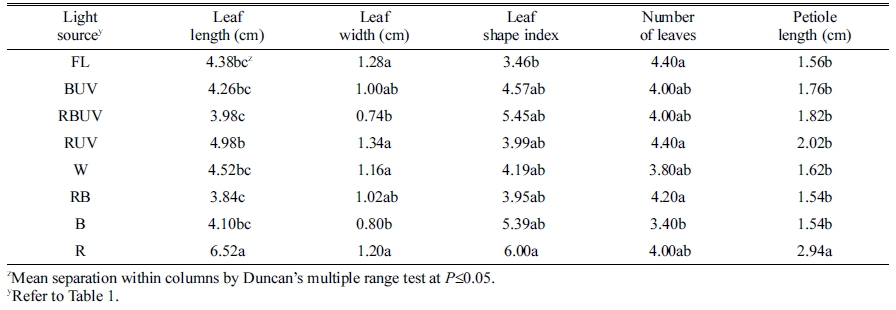 |
Table 3. Leaf length and width, leaf number, and petiole length of Spinacia oleracea cv. Sushiro grown for 14 days after transplanting (DAT) under the different light-emitting diodes (LED) and ultraviolet radiation (UVA) light in plant factory system.
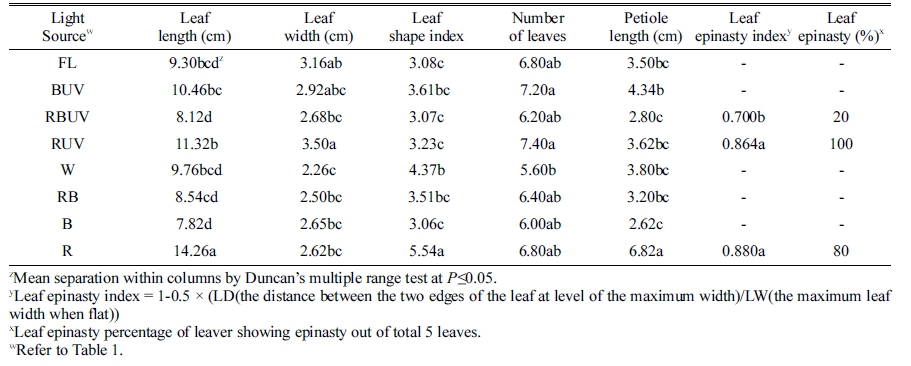 |
Table 4. Leaf length and width, leaf number, and petiole length of Spinacia oleracea cv. Sushiro grown for 21 days after transplanting (DAT) under the different light-emitting diodes and ultraviolet radiation (UVA) light in plant factory system.
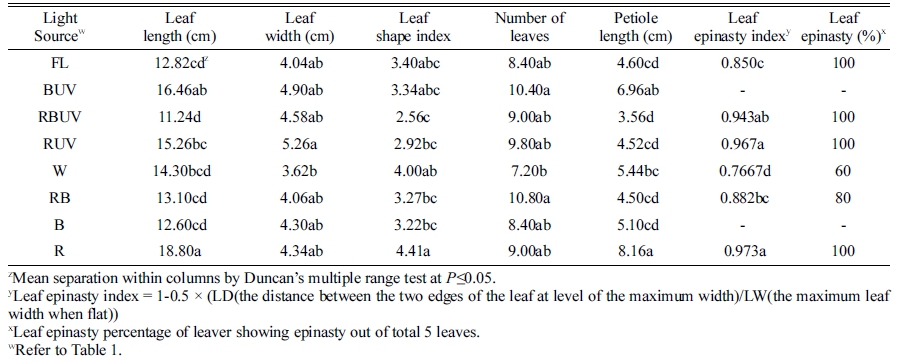 |
Table 5. Leaf length and width, leaf number, and petiole length of Spinacia oleracea cv. Sushiro grown for 28 days after transplanting (DAT) under the different light-emitting diodes (LED) and ultraviolet radiation (UVA) light in plant factory system.
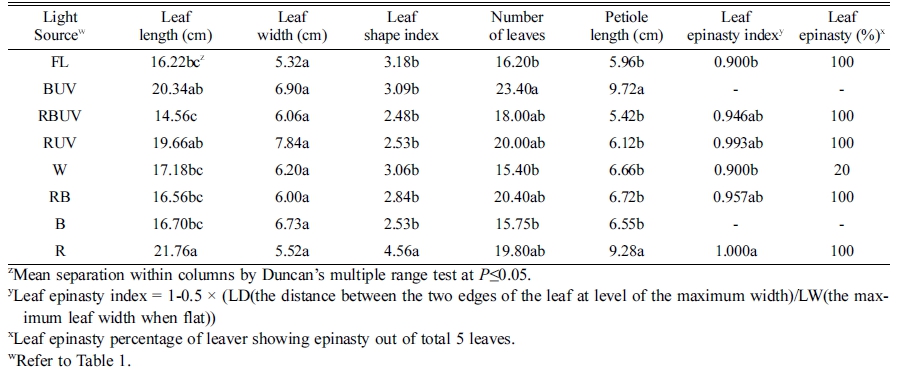 |
Table 6. Fresh and dry weights(wt.) of shoot and root, leaf area, specific leaf weight and leaf epinasty index of Spinacia oleracea grown for 28 days after transplanting (DAT) under the different light-emitting diodes (LED) and ultraviolet radiation (UVA) light in plant factory system.
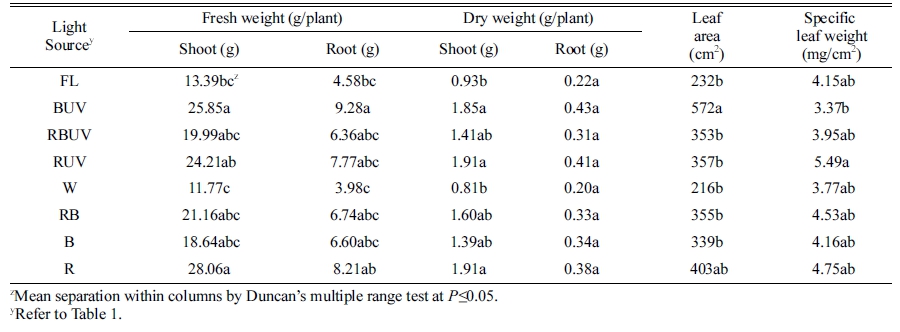 |
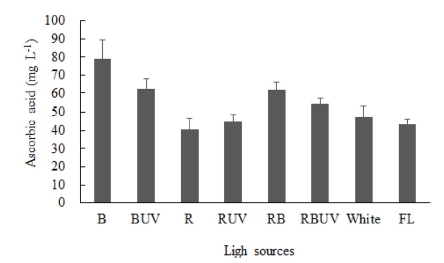
Fig. 2
Ascorbic acid concentration in leaf of Spinacia oleracea cv. Sushiro grown for 28 days after transplanting (DAT) under the different light-emitting diodes (LED) and ultraviolet radiation (UVA) light in plant factory system. The data indicate the means ± S.E. (n = 3). Refer to Table 1.
고 찰
본 연구결과에서 R이 포함된 모든 광원은 시금치 엽 장을 길게 유도하는 것으로 나타났는데 본 연구팀의 선 행 연구에서도 같은 결과를 얻었다(Lee 등, 2018). 흥미 롭게도 R 처리구에 비해 RUV 처리구에서 엽장은 20.6% 감소되어 엽형지수가 41.7% 유의적으로 낮아지고 엽수는 더 많았는데 이는 UVA 광원이 R 처리로 유도된 비정상적인 엽장길이를 감소시키고 엽수는 증가시켜 품질 을 향상시키는 것으로 보인다. Khoshimkhujaev 등 (2014) 에 의하면 R 처리구 보다 R과 UVA 혼합 처리구에서 토 마토 모종 줄기(hypocotyl + internodes) 길이가 현저히 감 소되었다고 보고하여 UVA가 B와 유사하게 식물생장에 작용한 것으로 보인다(Ohashi-Kaneko 등, 2006). 또한, 본 실험에서 RBUV 처리구의 엽장이 다른 처리구보다 가 장 짧아 UVA와 B가 엽장을 감소시키는데 상승적 효과 를 준 것으로 보인다. BUV 처리구에서 B 처리구보다 엽수가 많아져 엽면적이 유의적으로 높았는데 이는 UVA 의 부가 조사로 인하여 상추의 엽면적이 감소한 연구 결 과와(Kim과 Lee, 2016) 상반된다. 또한 RBUV 처리구에 서 RB 처리구와 비교하여 생체중, 건물중 및 엽면적 유 의차가 없어 역시 UVA에 의한 엽면적 감소 결과와는 상 반된다. 또한, 아스코르브산 함량이 B 처리구에서 BUV 처리구 보다 유의적으로 높았는데 Kim과 Lee(2016)에 의 하면 BUV 처리구에서 B 처리구에 비해서 1.1-1.3배 높았 다고 하여 상반된다. 이는 청색광과 UVA의 광수용체로서 작용하는 크립토크롬(cryptochrome)이 작물 종류에 따라 생육 뿐 아니라 기능성 물질 함량 축적에도 다르게 작 용할 수 있다는 것을 나타낸다. 본 연구팀이 실시한 광 원 종류에 따른 다채의 안토시아닌 함량 구명 실험에서 도 안토시아닌 함량이 B 처리구에서 BUV 처리구보다 유의적으로 높았다(논문 미제출). 본 실험에서 사용된 UVA 조사광도가 70mW·m-2 이였고 Kim과 Lee(2016) 연구에서는 80mW·m-2로 약간 차이가 있는데 UVA 효율 이 가시광선 LED에 비해 매우 낮아 조사강도 차이로 인해 효과가 다르게 나타났을 수 있다고 보인다. 따라서 UVA의 부가적 조사를 위해서는 작물 종류 별 적정 조 사강도와 효율에 대한 추가적인 연구가 필요할 것으로 판단된다.
본 연구에서 R이 포함된 모든 처리구에서 정식 21일 부터 시금치 잎의 상편생장(leaf epinasty)이 나타나 상품 성이 떨어지는 결과를 얻었는데 이는 제라늄 잎에 R광 을 조사하였을 때 잎 가장자리(Abaxial) 상편생장이 유 도되었다는 결과와 유사한 결과이다(Fukuda 등, 2008). 저자들은 상편생장 제라늄 잎에 다시 B를 조사하였을 때 정상적인 잎 생장이 유도되어 R과 B에서 각각 재배 된 제라늄 잎 세포크기를 조사한 결과 B에서 재배된 잎 세포길이가 더 긴 것으로 관찰되었다. 이 결과는 B를 R 에서 자란 잎 가장자리에 조사했을 때 그 부위의 표피 세포 길이가 길어지면서 잎 상편생장이 억제된 것이라고 하였다. 본 연구팀의 선행연구에서는 반대로 R 처리구에 서 상편생장을 보인 잎 가장자리(edge part)에서 잎 가운 데(center part)보다 세포밀도가 낮고 세포크기가 큰 것 으로 나타났다(Lee 등, 2018). 이 결과는 비록 제라늄 잎에서 표피세포 길이가 길어지면서 잎 상편생장이 억제 된다는 결과와 상반되지만 상편생장과 잎 가운데와 가장 자리 부위의 세포크기 차이 연관성을 뒷받침하고 있다. R은 광합성 유효광 효율이 높은 광으로 잎 가운데 부분 에 세포분열 에너지원인 탄소함량을 높여 세포밀도가 증 가되고 잎 가장자리는 빛의 반대 방향으로 이동하는 옥 신 함량 증가로 세포 신장이 일어나 세포크기가 커져 세포밀도가 낮아짐으로 상편생장이 일어난 것으로 가설 을 세워볼 수 있다.
본 실험의 모든 결과를 종합해 보면 생육과 품질적인 측면에서 BUV광이 가장 시금치 식물공장 재배에 적합 한 것으로 보인다. 하지만 시금치가 어린잎 채소로 활용 될 경우 정식 후 14일에 상편생장을 유도하지 않은 W 또는 FL도 적합한 것으로 판단된다.