서 론
재료 및 방법
1. 실험재료
2. 재배환경
3. 생육조사 항목 및 측정방법
4. 통계분석
결과 및 고찰
1. 컨테이너 육묘 시스템과 플라스틱 온실의 재배환경 비교
2. 접수와 대목 생육 비교
3. 접목활착 후 경과일에 따른 생육 비교
4. 참외 접목묘 묘의 충실도 비교
서 론
최근 인공광 기반 컨테이너 육묘 시스템의 발전과 함께 식물공장 내 재배 기술의 혁신으로 연중 최적 환경 조건에서 식물을 생산하는 것에 관심이 증가하고 있다. 이상 현상으로 인한 농작물 피해에 대응하여 인공광 이용 육묘 시스템 활용은 태양광 등의 자연조건에 의존하지 않고 균일한 묘를 안정적으로 생산 및 확보하는 방식으로 육묘 농가의 많은 기술적인 문제를 해결하고자 개발되었다(Okabe, 2004). 인공광 이용형 식물공장은 자연광 이용형에 비하여 안정된 재배환경을 유지할 수 있으며 생육 예측이 용이하다는 장점이 있으며, 대부분의 국내 육묘장은 자연광 의존도가 높아, 기후변화로 인한 고온기 생리장해와 저온기 저일조로 인하여 고품질 묘의 안정된 공급에 어려움을 겪고 있다(Cha 등, 2014). 여름철 육묘 시 고온 조건은 생리장해와 도장 등을 발생시키며 겨울철의 저온과 일조량 부족은 양수분 흡수를 불량하게 하고 생육을 저하시킨다고 하였다(Cho 등, 2009; Um 등, 2011). Shim 등(2013)은 기후변화에 의한 이상 현상의 증가로 농작물 생육 피해 현상은 더욱 심해질 것으로 예상되며, 작부방식의 개선과 피해 대책을 강구해야 한다고 하였다.
참외(Cucumis melo L. var. makuwa Mak.)의 영명은 오래전부터 ‘Oriental melon’으로 사용되어 왔으나, 수출을 위하여 식품분류를 개정하였다. 그 결과 ‘국내산 참외’가 국제식품규격위원회(Codex Alimentarius Commission, CODEX)에서 2016년부터 ‘코리안 멜론(Korean melon)’으로 채택되었고 한국산 참외의 수출을 확대할 수 있는 계기가 되었다(Shin 등, 2018). 참외는 박과의 한해살이 덩굴식물로서 다른 과채류 작목에 비해 높은 온도에서 육묘하기 때문에 전열온상을 만들어 자가육묘를 하고 있다(Lee 등, 2016). 국내에서 널리 재배되는 참외 촉성재배 작형의 육묘 관리는 보통 10-12월경에 이루어지며 보온 및 가온 시설장비를 이용하는 형태로 이루어지고 있다. 조기수확을 목적으로 참외의 파종 및 정식 시기가 점차 앞당겨지고 있으며, 고온기에도 안정적으로 묘를 생산할 수 있도록 육묘 기술의 발전과 보완이 중요하다. 육묘업체의 채소 묘 주요 작목별 접목·실생 비율 및 예비 묘 생산율(KOSIS, 2021)에 따르면 참외의 접목묘 이용률은 비접목묘에 비해 31%로 추정되었다. 박과 채소에서의 접목재배는 덩굴쪼김병과 급성 위조를 막을 수 있으며, 저온 신장성의 강화와 초세유지 등의 이점이 있기에 생산에 많은 노력이 필요하지만 널리 이용되고 있다. 그리고 접목묘를 생산하는 시설 또는 농가에서는 대부분 관리자의 경험에 의해 환경 요소가 관리되기 때문에 최적의 생육을 위한 세심하고 정확한 환경조절이 어려운 것으로 알려져 있다(Kim 등, 2001).
인공광원을 기반으로 한 채소 육묘는 기온과 광원 및 광도(Lee 등, 2016; Kim 등, 2018)의 영향을 많이 받으며, 접목묘의 활착과 생존율은 기온과 수증기압포차(vapor pressure deficit, VPD)의 영향을 받게 된다(Kim 등, 2001, Jang 등, 2009). 인공광 이용형 육묘 시스템과 관련한 선행 연구들은 주로 다양한 인공광원과 발광다이오드광 및 광 환경 조절을 이용한 육묘 기술에 초점을 맞추었지만, 인공광 기반 육묘시설과 관행적인 육묘 방법 간의 비교는 상대적으로 덜 이루어졌다. 따라서, 본 연구는 참외의 생육에 불리한 고온 조건에서 외부 환경에 대응한 컨테이너형 육묘 시스템과 고온 조건의 플라스틱 온실 육묘에서 재배 환경이 참외 접목묘의 초기생육 및 묘소질에 미치는 영향을 조사하고, 비교 분석함으로써 인공광 기반 육묘 시스템의 효율성과 참외 접목묘의 생산성을 검증하고자 수행되었다.
재료 및 방법
1. 실험재료
참외 접목묘의 접수와 대목은 2022년 8월 31일에 접수 ‘부자꿀참외(Farmhannong, Seoul, Korea)’와 2022년 9월 2일에 대목 ‘신토좌호박(Farmhannong, Seoul, Korea)’을 한아름상토(Shinsung mineral, Seongnam, Korea)를 충진한 50공 플러그 트레이에 접수 및 대목을 파종하였다. 파종 후 플러그 트레이를 컨테이너 육묘 시스템과 플라스틱 온실 내 재배단에 위치시켜 7-9일간 육묘한 접수와 대목의 묘소질을 조사하였다. 컨테이너 육묘 시스템에서 육묘한 접수와 대목을 이용 이용하여 단근편엽합접을 실시하였고 원예용 상토를 충진한 32공 플러그 트레이에 삽목하였다. 접목 직후 컨테이너 내 자체 제작한 활착실(기온 25°C, 상대습도 95%)에서 9일간 활착하였으며, 이후 컨테이너 육묘 시스템과 플라스틱 온실 내 재배단으로 위치시켜 육묘하였다. 원예연구소 개발 육묘용 표준배양액(EC 1.4dS·m-1)을 파종 다음 날부터 활착 기간을 제외하고 매일 0-2회로 10분간 저면관수로 공급하였다.
2. 재배환경
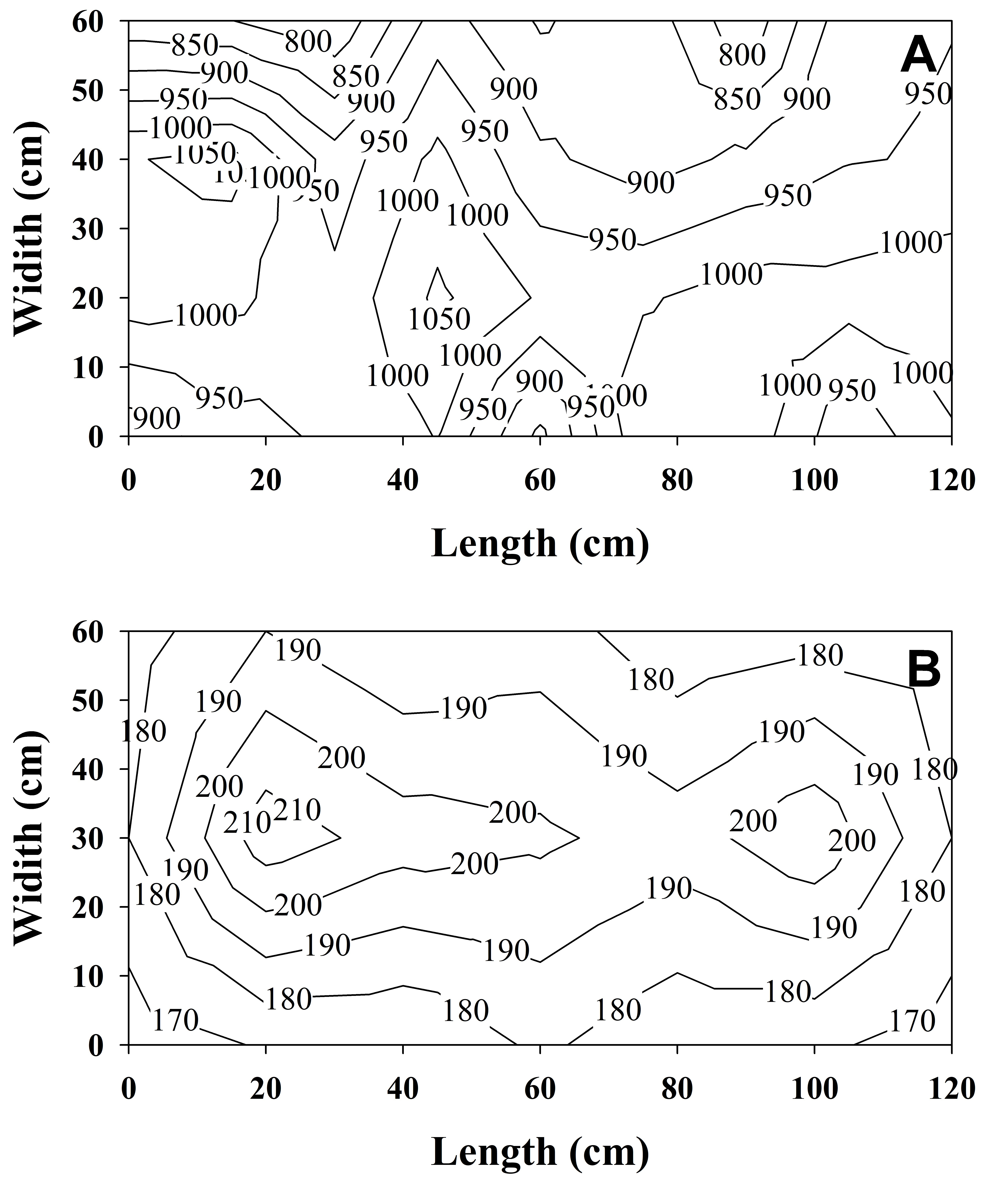
본 실험은 전라남도 무안군 목포대학교 부속 농장(34˚54'51.7"N 126˚24.5"E)에 소재한 인공광 이용형 컨테이너 육묘 시스템(L 6,000×W 3,000×H 3,000mm, Korea Scientific Technique Industry, Suwon, Korea)과 곁창 환기가 가능한 플라스틱 온실(8.2×19.5×5m)에서 수행되었다. 컨테이너 육묘 시스템 내에 설치된 4대의 다단식 육묘선반(L 700×W 1,350×H 1,980mm)은 3단으로 이루어졌으며, 각 단의 높이는 450mm였다(Fig. 1). 각 단에는 4개의 플러그 트레이를 배치시킬 수 있는 저면관수식 Ebb&Flow 베드가 설치되었으며, 각 육묘베드 상단에는 발광다이오드등(18W, LED, White + Red(660nm) + Far-red(730nm), HI18-G2, Zecos, Incheon, Korea)이 설치되었다. 컨테이너 육묘 시스템 내 각 재배단의 광원으로부터 30cm 거리의 광합성유효광양자속밀도(photosynthetic photon flux density, PPFD)는 200µmol·m-2·s-1로 설정하였으며 일장은 16/8h로 제어하였다. 컨테이너 육묘 시스템 내 환경은 복합환경 컨트롤러를 이용하여 주야간 온도를 26/19°C로 조절되었으며, 플라스틱 온실 내 기온, 상대습도 데이터는 데이터 로거(TR-72wb, T&D, Matsumoto, Japan)를 이용하여 수집하였다. 처리에 따른 재배단 내 광 분포, 광량 및 광질은 광스펙트럼 측정기(Li-180, Li-Cor Inc., NE, USA)를 이용하여 분석하였다.
3. 생육조사 항목 및 측정방법
접목에 이용되는 접수는 파종 후 9일간 대목은 파종 후 7일간 육묘하였고 규격화된 모종 생산에 있어 접수와 대목의 묘소질을 5주씩 조사하였다. 활착 후 경과일에 따라 0, 4, 7, 11, 14일 접목묘의 초장, 줄기 직경, 엽장, 엽폭, 엽면적, 생체중 및 건물중, 뿌리 길이 및 엽록소 함량(SPAD)을 조사하였다. 초장은 지제부로부터 생장점까지의 거리를 측정하였다. 엽수는 엽장이 3cm 이상인 본엽의 개수를 기준으로 조사하였다. 엽면적은 ImageJ(v1.8.0, LOCI, University of Wisconsin, USA) 프로그램을 활용하였으며 SPAD 값은 휴대용 엽록소 측정기(SPAD-502, Konica Minolta Inc., Tokyo, Japan)를 이용하여 측정하였다. T/R률(T/R ratio)과 묘의 충실도(compactness)는 농촌진흥청 농업과학기술 연구조사 분석기준(RDA, 2012)을 기초로 산출하였다.
4. 통계분석
각 처리구별로 임의로 선정된 5주의 참외 생육 데이터를 Excel 프로그램(Microsoft, USA)을 사용하여 산술 통계 값들을 계산하였다. 조사한 작물은 R project(4.2.3, R Foundation, USA)를 이용해 t-검정(t-test, P ≤ 0.05)를 진행하였으며 시그마플롯(Sigmaplot 15.0, Systat, CA, USA)을 이용하여 그래프를 작성하였다.
결과 및 고찰
1. 컨테이너 육묘 시스템과 플라스틱 온실의 재배환경 비교
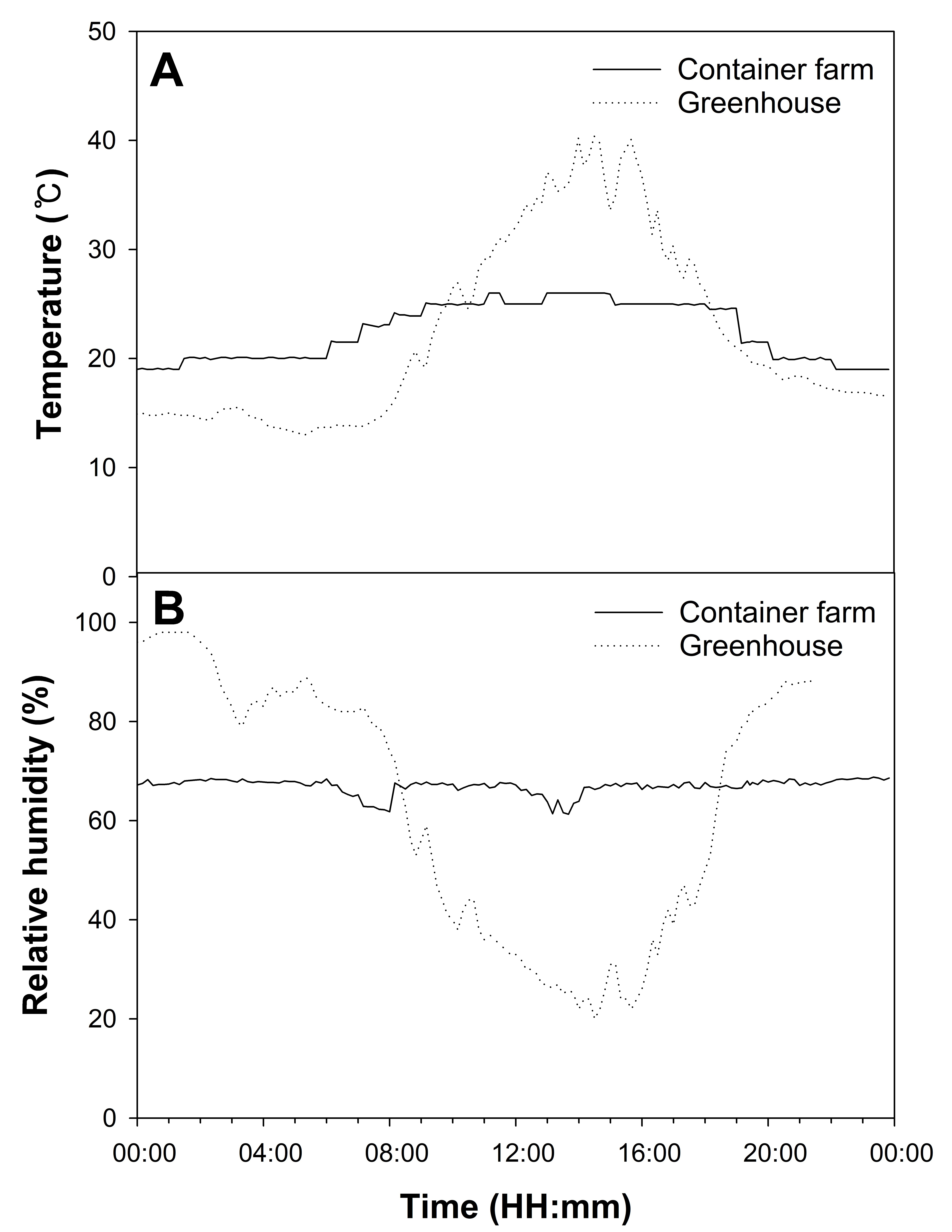
컨테이너 육묘 시스템과 플라스틱 온실의 주·야 평균기온과 상대습도(Fig. 2)는 25.6/19.1°C 및 28.1/15.4°C로 나타났으며, 일 평균 상대습도는 각각 67.1%와 66.1%로 나타났다. 일 상대습도의 변화를 보면 육묘 시스템 내 습도는 균일하게 유지된 것에 비해 플라스틱 온실 내 상대습도는 시간에 따라 급격한 차이가 나타났다. 컨테이너 육묘 시스템에서 기온과 상대습도의 설정값과 관측된 데이터를 비교하였을 때, 잔차의 평균은 0.4°C와 2.9% 수준으로 매우 유사하게 제어되었다. 플라스틱 온실의 일 최고기온, 최저기온은 40.4°C와 14.6°C로 다소 높은 주간 온도와 주야간 온도차(DIF)를 확인하였다.
재배단 내 평균 PPFD는 컨테이너 육묘 시스템에서 183µmol·m-2·s-1, 플라스틱 온실에서 945µmol·m-2·s-1로 나타났다(Fig. 3). DIF와 광량의 조절에서 묘의 소질 및 초기생육 변화는 이전 많은 연구에서 확인되었고, 기온과 광 환경은 작물의 형태, 광합성, 생장에 크게 영향을 미친다고 보고되었다(Kwak 등, 2021; Heuvelink와 Dorais, 2005; Went, 1953).
2. 접수와 대목 생육 비교
Table 1은 플라스틱 온실과 컨테이너 육묘 시스템에서 육묘한 참외 접수와 호박 대목의 생육 결과이다. 오이 접목묘 생산 시 ‘편엽합접’과 ‘단근편엽합접’ 방법을 이용할 때, 접수의 파종시기를 대목보다 1-2일(고온기)에서 3-4일(저온기) 먼저 파종하여 접수의 잎 전개속도와 대목의 하배축의 신장을 조정한다고 하였다(Jang 등, 2014). 본 연구에서는 접수를 대목보다 2일 먼저 파종하였고, 접수의 경우 9일간 대목의 경우 7일간 육묘하여 재배 환경에 따른 접수와 대목의 묘소질을 비교하고자 하였다. 과채류의 묘의 품질은 지상부와 지하부의 건물중 비율을 의미하는 T/R률과 지상부 건물중을 초장으로 나눈 묘의 충실도로 나타낼 수 있다(Lee 등, 2001; Jeong 등, 2020a). 고온기 플라스틱 온실 육묘와 컨테이너 육묘 시스템에서 생육한 접수와 대목의 초장, 줄기굵기, 묘의 충실도는 통계적으로 유의미한 차이를 나타냈다. 접수와 대목의 초장은 고온기 플라스틱 온실에서 생육한 묘에서 상대적으로 도장하는 경향을 보였으며, 묘의 충실도는 컨테이너 육묘 시스템에서 육묘한 묘에서 더 높게 나타났다. 컨테이너 육묘 시스템을 이용한 접수와 대목의 육묘는 고온 조건의 플라스틱 온실 육묘에 비해 도장하지 않고 균일한 묘를 생산할 수 있었다. An 등(2021)은 인공광을 이용한 식물공장형 육묘 시스템의 활용이 오이 접수와 대목 육묘에서 육묘 일수를 단축하고 접목에 적합한 균일한 묘를 안정적으로 생산할 수 있다고 하였다. 본 연구에서도 컨테이너 육묘 시스템을 활용한 참외 접수와 대목 육묘 시 고온 조건의 온실에 비해 균일하게 묘를 생산할 수 있었다.
Table 1.
Growth characteristics of Korean melon seedlings grafted onto rootstocks 7 days after sowing, and onto scions 9 days after sowing (n=5).
| Experimental site |
Plant height (cm) |
Stem diameter (mm) | Dry weight (mg·plant-1) |
Compactness (mg/plant) | ||
| Shoot | Root | |||||
| Scion | Greenhouse | 5.36 ± 0.07z | 1.57 ± 0.03 | 27.44 ± 0.76 | 4.24 ± 0.57 | 5.11 ± 0.13 |
| Container farm | 3.40 ± 0.16 | 1.75 ± 0.02 | 24.26 ± 1.15 | 3.48 ± 0.40 | 7.18 ± 0.39 | |
| Significance | *** | ** | NS | NS | ** | |
| Rootstock | Greenhouse | 5.44 ± 0.43 | 3.16 ± 0.06 | 166.64 ± 3.67 | 31.58 ± 1.11 | 31.37 ± 2.46 |
| Container farm | 3.26 ± 0.30 | 2.83 ± 0.05 | 144.28 ± 3.23 | 24.88 ± 3.41 | 44.72 ± 3.72 | |
| Significance | ** | ** | NS | NS | * | |
3. 접목활착 후 경과일에 따른 생육 비교
박과 채소의 적정 육묘일수는 파종 시기에 따라 다르지만, 30일 내외로 알려져 있으며 접목육묘의 경우 접목 후 7일 정도 되면 활착이 거의 완료된다. 육묘업체에서 접목 후 묘를 출하하는 시기를 고려하여 접목활착 후 경과일(day after graft-taking, DAG)에 따라 플라스틱 온실과 컨테이너 육묘 시스템에서 생산한 참외 접목묘의 생육을 비교하였다(Fig. 4, Table 2). 접목활착 직후 참외 접목묘의 초장과 엽면적의 평균 및 표준오차는 각각 6.1±0.28cm 및 7.1±0.53cm2였으며, SPAD는 36.2±1.84였다. DAG 0, 4, 7, 11, 14에 따른 참외 접목묘의 초장은 고온 조건의 플라스틱 온실 육묘에서 6.1, 8.7, 11.3, 15.5, 18.8cm로 나타났으며 컨테이너 육묘 시스템에서의 초장은 6.1, 6.3, 8.7, 11.6, 15.8cm로 조사 기간 내 컨테이너 육묘 시스템에서 생육한 접목묘의 초장이 더 작은 것을 확인하였다(Fig. 5A). 플러그육묘 시 주야간 온도처리(DIF)에서 초장은 야간온도보다는 주간온도의 증가에 의해 크게 증가된다고 보고되었다(Lim 등, 1997). 본 연구에서는 플라스틱 온실 육묘와 컨테이너 육묘 시스템에서 DIF와 광원 및 광질을 고려한 참외 접목묘의 생육 비교를 수행하였으며, 자연광 하에서 DIF가 큰 플라스틱 온실 육묘에서 참외 접목묘의 초장이 더 길게 나타남을 확인하였다. 공정육묘에서 도장을 억제하고 공정묘의 품질을 높이기 위한 방법으로는 트리아졸계 생장억제제 처리, DIF 조절, 광 조절, 양·수분 조절, 물리적 자극 등을 이용하고 있으며(Jeong 등, 2020b), 컨테이너 육묘 시스템에서 생육한 묘의 도장이 억제된 것은 주야간 설정온도와 광 환경의 영향이 나타난 것으로 생각된다. 엽수, 엽장, 엽폭 및 엽면적 등의 생장 반응에서는 처리 간 통계적으로 유의한 차이가 나타나지 않았지만, 접목활착 후 14일 기준 SPAD 값은 플라스틱 온실 육묘에서 30.5, 컨테이너 육묘 시스템에서 41.1로 컨테이너 육묘 시스템에서 생육한 모종에서 조사 기간 내 높게 나타나는 경향이었다. 플라스틱 온실 육묘에서의 생육한 참외 접목묘의 뿌리 길이는 21.9cm였으며, 컨테이너 육묘 시스템에서 뿌리 길이는 30.6cm로 플라스틱 온실 육묘 처리구에 비해 지하부의 생장이 우수하였다(Fig. 5B). 참외 접목묘 육묘에서 뿌리의 발달 및 활력은 지온과 대목의 종류에 영향을 받는 것으로 알려져 있으며(Shin 등, 2006), 지하부의 발달은 정식 후에도 초기 활착에 긍정적인 효과가 있을 것으로 사료된다.
Table 2.
Growth characteristics of Korean melon seedlings measured on 0, 4, 7, 11 and 14 days after graft-taking (n=5).
| DAGz | Treatment | No. of leaves |
Leaf length (cm) |
Leaf width (cm) |
Leaf area (cm2) |
Relative chlorophyll content (SPAD) |
| 0 | - | 1 ± 0.0y | 2.9 ± 0.11 | 3.0 ± 0.09 | 7.1 ± 0.53 | 36.2 ± 1.84 |
| 4 | Greenhouse | 2.6 ± 0.24 | 4.3 ± 0.21 | 5.4 ± 0.42 | 45.2 ± 5.44 | 27.7 ± 1.59 |
| Container farm | 2.2 ± 0.20 | 4.2 ± 0.14 | 4.8 ± 0.27 | 40.0 ± 1.48 | 40.5 ± 2.25 | |
| Significance | NS | NS | NS | NS | ** | |
| 7 | Greenhouse | 3.4 ± 0.24 | 5.7 ± 0.18 | 7.4 ± 0.40 | 95.7 ± 10.77 | 26.5 ± 0.39 |
| Container farm | 3.8 ± 0.20 | 6.0 ± 0.10 | 8.5 ± 0.23 | 118.1 ± 11.19 | 38.1 ± 1.91 | |
| Significance | NS | NS | * | NS | ** | |
| 11 | Greenhouse | 5.8 ± 0.37 | 8.4 ± 0.20 | 11.3 ± 0.27 | 266.7 ± 16.77 | 34.6 ± 0.76 |
| Container farm | 5.2 ± 0.37 | 8.2 ± 0.37 | 11.4 ± 0.41 | 280.1 ± 24.64 | 41.6 ± 1.23 | |
| Significance | NS | NS | NS | NS | ** | |
| 14 | Greenhouse | 6.8 ± 0.58 | 9.0 ± 0.22 | 11.5 ± 0.49 | 328.0 ± 24.60 | 33.3 ± 1.44 |
| Container farm | 8.6 ± 0.81 | 9.1 ± 0.38 | 13.0 ± 0.49 | 443.6 ± 41.33 | 44.1 ± 1.40 | |
| Significance | NS | NS | NS | * | *** |
4. 참외 접목묘 묘의 충실도 비교
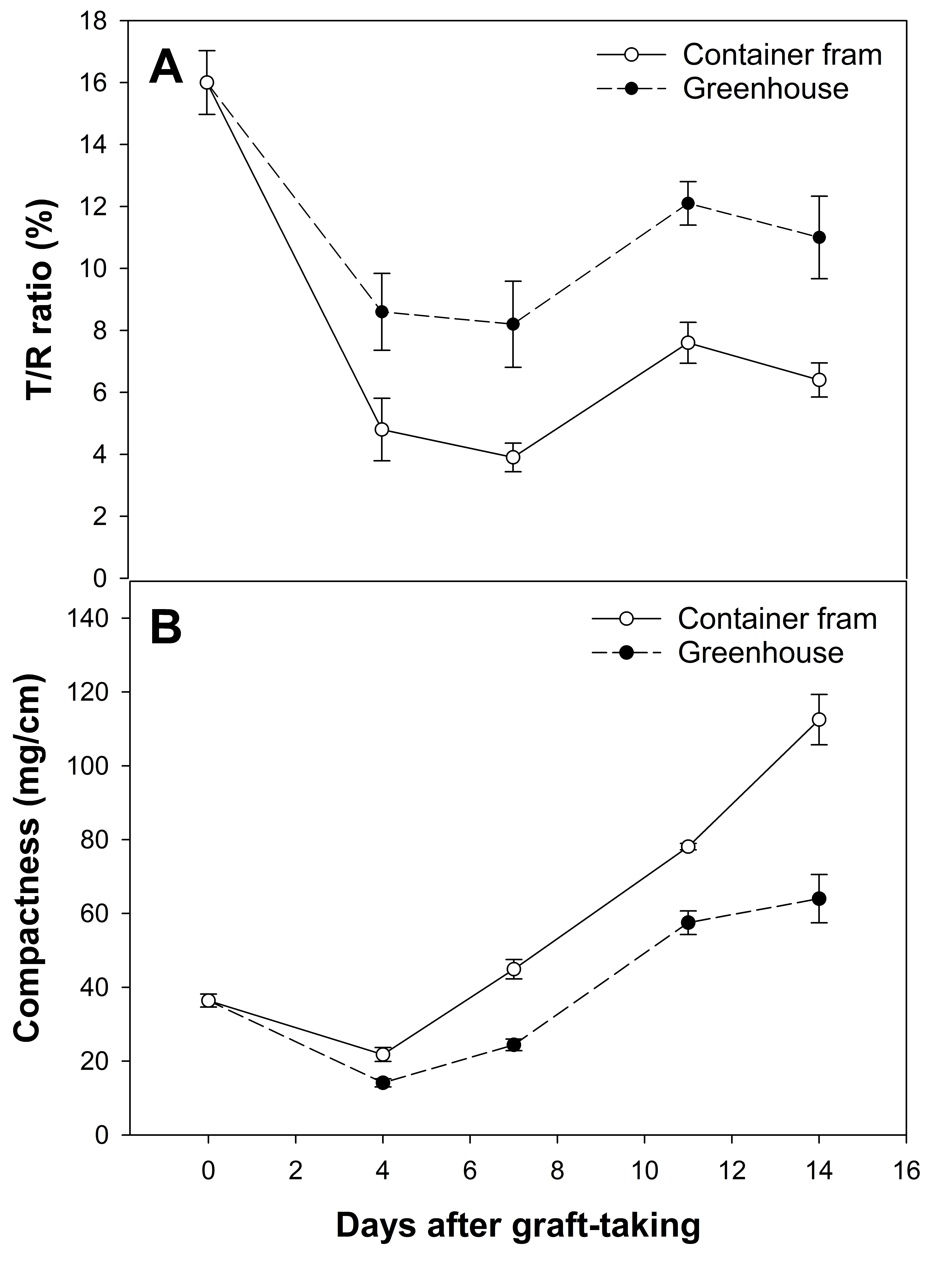
Table 3는 참외 접목묘의 지상부와 지하부의 생체중 및 건물중을 조사한 것이다. T/R률은 뿌리를 단근한 후 접목을 진행하였기 때문에 접목활착 후 0일에 가장 높았고, 접목활착 후 4일까지 점차 감소한 뒤 이후 다시 증가하는 경향을 보였다(Fig. 6A). 접목활착 후 14일에는 T/R률이 플라스틱 온실 처리보다 컨테이너 육묘 시스템에서 유의적으로 낮게 나타났다. 이러한 경향은 T/R률이 낮을수록 조직 충실도가 무거워 이식 후 몸살이 적고 활착에 유리하다는 선행연구 결과와 일치한다. 또한 묘의 충실도는 접목활착 후 4일부터 점차 증가하였으며, 접목활착 후 14일 기준으로 컨테이너 육묘 시스템에서 더 높은 값을 보였다(Fig. 6B).
Table 3.
Growth characteristics of Korean melon seedlings measured on 0, 4, 7, 11 and 14 days after graft-taking (n=5).
| DAGz | Treatment | Fresh weight (g/plant) | Dry weight (g/plant) | ||
| Shoot | Root | Shoot | Root | ||
| 0 | - | 1.6 ± 0.10y | 0.1 ± 0.01 | 0.12 ± 0.01 | 0.009 ± 0.0010 |
| 4 | Greenhouse | 1.7 ± 0.14 | 0.3 ± 0.05 | 0.28 ± 0.03 | 0.016 ± 0.0024 |
| Container farm | 1.6 ± 0.13 | 0.6 ± 0.34 | 0.14 ± 0.01 | 0.019 ± 0.0025 | |
| Significance | NS | NS | NS | NS | |
| 7 | Greenhouse | 3.9 ± 0.36 | 0.6 ± 0.10 | 0.30 ± 0.18 | 0.027 ± 0.0036 |
| Container farm | 5.2 ± 0.48 | 1.4 ± 0.36 | 0.39 ± 0.04 | 0.059 ± 0.0023 | |
| Significance | NS | ** | n.s. | ** | |
| 11 | Greenhouse | 11.1 ± 0.76 | 0.9 ± 0.04 | 0.89 ± 0.06 | 0.061 ± 0.0062 |
| Container farm | 12.7 ± 1.18 | 1.8 ± 0.36 | 0.90 ± 0.08 | 0.118 ± 0.0195 | |
| Significance | NS | NS | NS | * | |
| 14 | Greenhouse | 15.1 ± 1.38 | 1.5 ± 0.22 | 1.20 ± 0.12 | 0.084 ± 0.0095 |
| Container farm | 21.2 ± 2.05 | 3.4 ± 0.41 | 1.81 ± 0.22 | 0.164 ± 0.0238 | |
| Significance | * | ** | NS | * | |
본 연구를 통해 컨테이너 육묘 시스템에서 자란 참외 접목묘는 고온 조건의 플라스틱 온실 육묘 처리에 비해 높은 묘의 충실도와 낮은 T/R률을 가지고 있었습니다. 결과적으로 컨테이너 육묘 시스템에서 생육한 묘는 이식 후 적은 몸살과 높은 활착률 등 긍정적인 효과를 나타냈습니다. 그러나 고온기 또는 저일조 시기에 고품질 모종을 생산하려면, 생장 특성 및 정식 전 생육에 영향을 미치는 주요 요인을 분석하고 정식 후 생육 및 생산량을 기반으로 하는 컨테이너 육묘 시스템의 이용 효과에 대한 연구가 필요할 것으로 예상됩니다.